西瓜种质抗病性的分子标记检测和人工接种鉴定
2021-10-11易丽聪王运强龚钰邱益纯焦春海徐上军戴照义
易丽聪 王运强 龚钰 邱益纯 焦春海 徐上军 戴照义


摘 要:病害是西瓜生产中导致产量和品质下降的关键因素。利用已报道的西瓜抗枯萎病、炭疽病和白粉病分子标记对230份西瓜种质资源进行抗病性鉴定,分别筛选出相应的抗性种质60份、20份和35份,其中兼抗枯萎病和炭疽病的资源6份,兼抗枯萎病和白粉病的资源8份,兼抗炭疽病和白粉病的资源6份。对其中23份种质进行抗枯萎病人工接种鉴定,筛选出8份高抗西瓜种质,为西瓜抗病育种提供了宝贵的种质资源。
关键词:西瓜;种质;抗病性;分子标记;人工接种
中图分类号:S651 文献标志码:A 文章编号:1673-2871(2021)09-007-08
Screening of watermelon germplasm for disease resistance by molecular markers and artificial inoculation
YI Licong1, WANG Yunqiang1, GONG Yu1, QIU Yichun1, JIAO Chunhai2, XU Shangjun3, DAI Zhaoyi1
(1. Hubei Key Laboratory of Vegetable Germplasm Enhancement and Genetic Improvement/Institute of Economic Crops, Hubei Academy of Agricultural Sciences, Wuhan 430064, Hubei, China; 2. Hubei Academy of Agricultural Sciences, Wuhan 430064, Hubei, China; 3. Bureau of Agriculture and Rural Affairs of Shishou City, Shishou 434400, Hubei, China)
Abstract: Disease is a crucial reason leading to yield and quality decline in watermelon production. In this paper, three previously reported molecular markers for resistant to fusarium wilt, anthracnose and powdery mildew were employed to detect the potential disease resistance of 230 watermelon germplasm resources, and 60, 20 and 35 resistant germplasm were identified, respectively. Also, eight watermelon germplasm that highly resistant to fusarium wilt were obtained by artificial inoculation. This work provides valuable germplasm resources for watermelon disease resistance breeding.
Key words: Watermelon; Germplasm; Disease resistance; Molecular marker; Artificial inoculation
西瓜(Citrullus lanatus)是一種重要的经济作物,在全球范围内广泛栽培。根据联合国粮农组织数据库(FAOSTAT)统计,2018年我国西瓜栽培面积达151.0万hm2,占全球总面积的46.58%,总产量超6000万t,占世界总产量的60.64%。西瓜产业已成为我国农业经济发展的重要支柱产业之一。
病害是导致西瓜产量和品质下降的一个关键因素。西瓜生长过程中常见的病害包括枯萎病(Fusarium wilt)、炭疽病(Anthracnose)、蔓枯病(Gummy stem blight)和白粉病(Powdery mildew)等。在所有病害中,枯萎病是危害西瓜产量和制约西瓜产业发展最严重的病害。枯萎病由半知菌亚门尖孢镰孢菌西瓜专化型(Fusarium oxysporium)感染引起,是一种土传性病害,其孢子能在土壤中存活达10年[1]。炭疽病由半知菌亚门黑盘孢目刺盘孢西瓜炭疽病菌(Colletotrichum orbiculare Berk. et Mont)感染引起,在西瓜整个生育期及果实贮运过程中均可产生危害,可感染西瓜的幼苗、茎蔓、叶片和果实[2-3]。白粉病为多循环真菌性病害,寄主有甜瓜、南瓜、冬瓜、黄瓜等多种葫芦科作物。白粉病主要侵染叶片,严重时可侵染茎蔓和果实[4],导致品质下降和大幅度减产。生产上主要通过土壤消毒、喷施化学药剂和选用抗病品种等方法防治病害。随着消费者对西瓜品质和质量安全要求的提高,选用抗病品种已成为防治西瓜病害的首要手段。
在传统育种中,培育一个抗病品种时间长、工作量大、效率低。随着生物技术的进步,利用分子标记辅助选择可显著提高抗病育种和聚合育种的效率[5]。目前已报道多个与西瓜抗病、品质、外观等性状相关的分子标记[6-8]。在枯萎病抗性方面,张屹[1]、李娜等[9]分别利用不同的遗传分析群体定位出西瓜抗枯萎病主效基因位点,并开发出7716_fon、InDel1_fon1等抗病分子标记。Jang等[10]对西瓜炭疽病菌生理小种1抗性基因完成定位并开发出分子标记CL14-27-9,该标记对41份栽培西瓜的抗性检测准确率达100%。Kim等[11]利用F2抗感分离群体定位1个抗瓜类白粉病菌生理小种1W的主效基因,并开发出分子标记PMR2.1。上述分子标记为西瓜抗病种质筛选和抗病育种提供了良好基础。
笔者利用上述报道的抗枯萎病、炭疽病和白粉病分子标记进行西瓜抗病种质初步筛选,并对部分材料开展枯萎病抗性人工接种鉴定,为西瓜抗病育种提供基础材料。
1 材料与方法
1.1 材料
参试的230份西瓜种质主要为湖北省农业科学院经济作物研究所瓜类课题组自主创制的高代自交系材料,少部分为国内外引进,包含栽培种、地方种和野生种。所有材料均为二倍体。
1.2 抗病分子标记
1.2.1 抗枯萎病分子标记 抗枯萎病分子标记7716_fon由张屹开发[12],针对枯萎病菌生理小种1,引物序列见表1。7716_fon为CAPS标记,PCR扩增产物为170 bp,感病材料存在碱基C>T的突变,产生1个TaqⅠ酶切位点。感病材料能被TaqⅠ酶切割成2个小片段(104 bp + 66 bp),抗病材料不能被酶切。
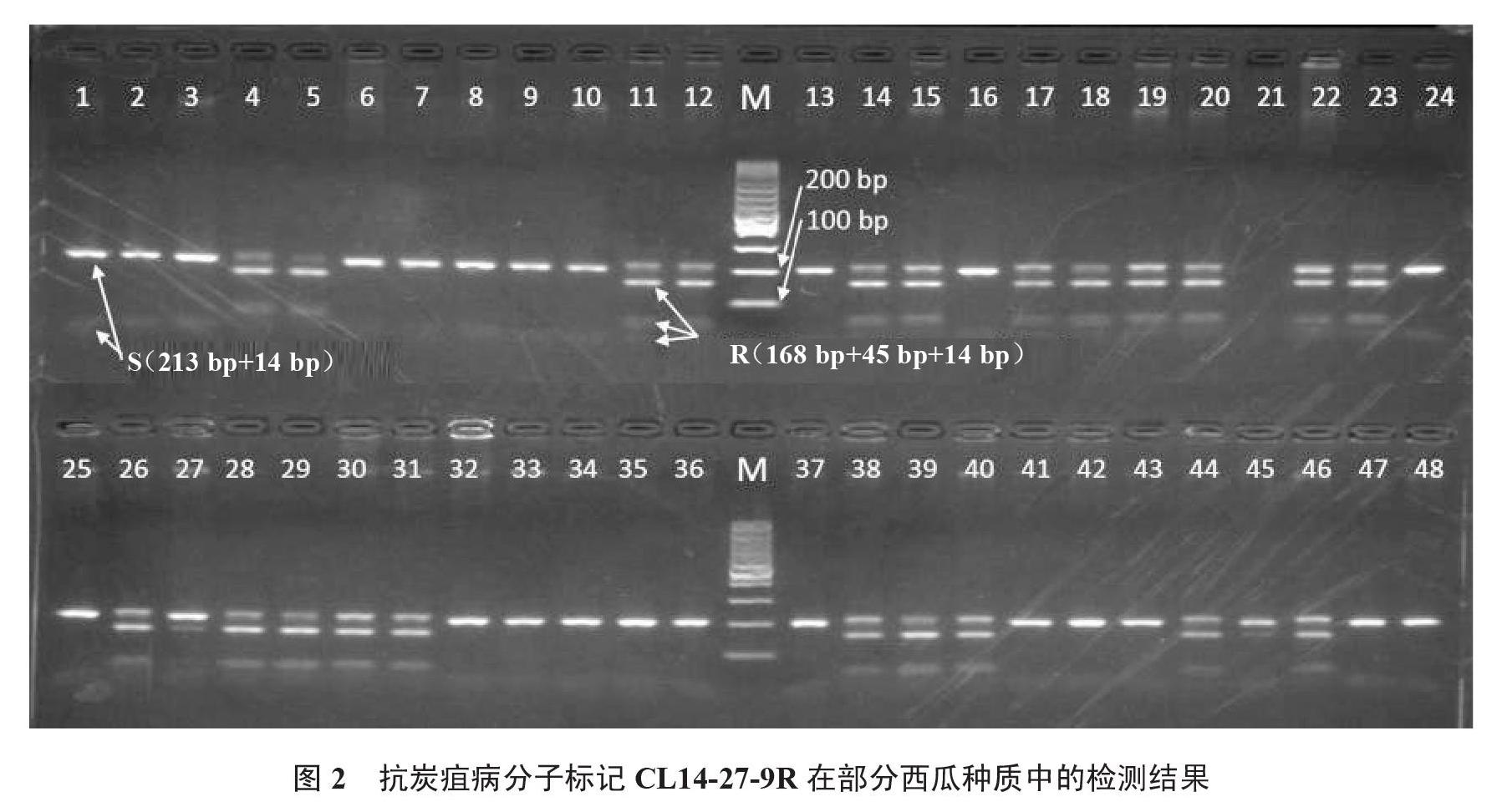
1.2.2 抗炭疽病分子标记 抗炭疽病分子标记是在Jang等[10]开发的CL14-27-9标记上改良而来,命名为CL14-27-9R,针对西瓜炭疽病菌生理小种1,引物序列见表1。CL14-27-9R为CAPS标记,PCR扩增产物为227 bp,抗病材料存在碱基G>A突变,产生1个新的HindⅢ酶切位点。感病材料包含1个HindⅢ位点,酶切后产生2个片段(213 bp + 14 bp);抗病材料包含2个HindⅢ位点,酶切后产生3个片段(168 bp + 45 bp + 14 bp)。
1.2.3 抗白粉病分子标记 抗白粉病分子标记PMR2.1为Kim等[11]开发,针对白粉病菌生理小种1W,引物序列见表1。PMR2.1为CAPS标记,PCR扩增产物为527 bp,感病材料存在碱基A>G突变,产生1个Taq Ⅰ酶切位点。感病材料经Taq Ⅰ酶酶切后产生2个片段(334 bp +223 bp),抗病材料不能被酶切。
1.3 标记检测
1.3.1 基因組DNA提取 对230份西瓜种质资源进行浸种催芽,待胚根伸长至1~2 cm时采样,每份材料至少混合10个单株。采用CTAB法提取基因组DNA(gDNA),DNA样品溶解在50 μg·mL-1的RNA酶溶液中,随后用1%的琼脂糖凝胶电泳检测样品的完整性和质量浓度,将质量浓度调整为约50 ng·μL-1,然后放置于-20 ℃保存备用。
1.3.2 PCR扩增和酶切检测 分子标记检测于2019年在蔬菜种质创新与遗传改良湖北省重点实验室完成。采用2×Taq Master Mix(莫纳生物)进行PCR扩增,反应体系为20 μL,包含1.0 μL gDNA 模板,正反向引物各0.4 μL(100 μmol · L-1),10 μL 2×Taq Master Mix,Inc.),ddH2O 补足至20 μL。反应程序为:94 ℃预变性2 min;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸1 min,共35个循环;72 ℃延伸5 min;PCR 产物经2%琼脂糖凝胶电泳检测。PCR产物用快速限制性内切酶TaqⅠ或HindⅢ酶切(Thermo Scientific?),反应体系为20 μL,包含5.0 μL PCR产物,2 μL缓冲液1 μL 内切酶,ddH2O 补足至20 μL。反应程序为:37 ℃酶切20 min;80 ℃变性10 min。酶切产物经2%琼脂糖凝胶电泳检测。
1.4 抗枯萎病人工接种鉴定
人工接种试验于2020—2021年在蔬菜种质创新与遗传改良湖北省重点实验室完成。
接种鉴定参照耿丽华等[13]的方法,即将种子表面消毒后浸种催芽,发芽后播种于高温高压灭菌的蛭石基质中,在子叶平展期,将苗轻轻取出,清水洗净根系,在浓度为5×106个·mL-1的枯萎菌孢子悬浮液中浸根15 min,对照植株在无菌水中浸根15 min。西瓜枯萎病生理小种1由浙江大学李大勇教授提供。
接种后幼苗移栽至经过高压湿热灭菌的蛭石和草炭等体积混合的基质中。在室温为25 ℃条件下培养,3 d后剔除不正常植株,植株出现萎蔫症状时开始调查记录发病情况,直至接种后21 d结束调查。每种材料接种30株,设3次重复。
抗性分级参照Smarty 和 Bruton[14]提出的标准:高抗(HR)病株率≤20%;中抗(MR)病株率为21%~50%;轻抗(LR)病株率为51%~80%;感病(S)病株率>80%。
2 结果与分析
2.1 西瓜抗枯萎病的分子标记检测
7716_fon标记在西瓜种质中扩增出目标片段,PCR产物经TaqⅠ限制性酶切和电泳后产生预期的2种带型(图1),一种为不能被切割的原始条带(170 bp),对应材料判断为抗病种质,如材料BH1003(编号1)等;另一种新增2个小片段(104 bp + 66 bp),对应材料判断为感病种质,如材料QZ26-1(编号8)。在230份材料中共筛选出60份携带枯萎病抗性标记的种质,详见表2。
2.2 西瓜抗炭疽病的分子标记检测
CL14-27-9R标记的PCR产物经HindⅢ内切酶酶切和电泳后产生2种带型(图2),其中2条带型(213 bp + 14 bp)对应材料判断为感病种质,如材料BH1003(编号1)等;另一种新增3个小片段(168 bp + 45 bp +14 bp),对应材料判断为抗病种质,如材料XGSN001(编号11)。在230份材料中共筛选出20份携带炭疽病抗性标记的种质,详见表2。
2.3 西瓜抗白粉病的分子标记检测
标记PMR2.1的PCR产物经TaqⅠ限制性酶切和电泳后产生2种带型(图3),包含2个较小片段(334 bp + 223 bp)的材料判断为感病种质,如材料BH1003(编号1)等;包含1个较大片段(527 bp)的材料判断为抗病种质,如材料XGNR001(编号17)。在230份材料中共筛选出35份携带白粉病抗性标记的种质,详见表2。
2.4 西瓜抗枯萎病的人工接种鉴定
对23份西瓜种质进行抗枯萎病人工接种鉴定,其中2份携带感病标记的材料均表现为高感枯萎病,在21份携带抗病标记的材料中8份为高抗、2份为中抗、2份为轻抗、9份为高感枯萎病。根据本试验结果,7716_fon标记检测与人工接种鉴定结果的吻合度为60.87%(表3)。
3 讨论与结论
基因组测序技术的飞速发展使得基因定位和克隆越来越高效,大量与基因紧密连锁或功能分子标记被开发,进而推动了分子标记辅助选择技术在育种中的广泛应用。目前,在水稻、玉米、小麦等主粮作物和番茄、黄瓜等蔬菜中,一系列与产量、品质和抗性等相关的分子标记已实现在育种中的应用[15-17]。
分子标记辅助选择可以避免环境对性状的影响,提高育种选择的准确性,同时可以在育种早期世代中进行选择,以缩短育种周期,提高育种效率。但分子标记辅助选择也有一定的局限性,尤其是对數量性状,在不同遗传背景下的选择效率可能有较大差异。植物抗病性是复杂的数量性状,不仅受多个基因调控,同时也和病原菌存在互作。病原菌一般有多种生理小种,不同地理区域优势小种不同并且小种分化演替快,因此育种材料抗病性的分子标记检测需更加细致和有针对性。目前已报道4种枯萎病生理小种[1],分别为小种0、1、2和3。我国枯萎病致病菌主要为小种1,笔者利用针对小种1的抗性标记7716_fon进行种质抗病性检测,筛选出60份潜在的抗枯萎病材料,占比26.1%。选择其中23份种质资源进行抗枯萎病人工接种鉴定,结果表明,标记检测和接种鉴定的吻合度为60.87%,低于张屹[1]对164份西瓜资源(98.7%)和李娜等[9]对130份西瓜资源的鉴定结果(70.8%),主要原因是鉴定材料的遗传背景不同,其次是本试验中接种鉴定的材料数量偏少,其他材料的人工接种工作将在后续展开。经人工接种鉴定,23份材料中共有9份材料的枯萎病抗性与分子标记检测不相符:原因一是标记7716_fon与抗枯萎病基因之间还存在一定的遗传距离,标记和抗病基因未达到共分离;二是西瓜枯萎病抗性受多个基因调控,可能存在其他抗病基因位点的变异。因此,进一步对抗枯萎病基因进行精细定位和克隆,开发检测准确度更高的分子标记非常有必要。本试验中从材料sugarlee鉴定出的抗性等级与前人试验有一定偏差[18],但并不相矛盾,可能是不同接种方法和操作人员的试验误差所导致。
与枯萎病相比,西瓜炭疽病菌和白粉病菌的生理小种类型更多,抗病机制也更为复杂。目前已报道7种西瓜炭疽病生理小种(小种1~7),生产上危害最多的是小种1、2和3[2-3]。笔者利用抗炭疽病生理小种1的标记CL14-27-9R在230份西瓜种质中筛选出20份潜在的抗炭疽病种质,占比8.7%。已鉴定出能引起白粉病的真菌有3个属6个种[4],危害最严重的二孢白粉菌(Erysiphe cichoracearum)和单囊壳菌(Sphaerotheca fuliginea)分别有2个和11个生理小种。目前西瓜中报道的抗白粉病基因非常少[11],但在甜瓜和黄瓜中分别鉴定出12个和4个与白粉病抗性相关的基因[19]。笔者利用Kim等[11]开发的抗白粉病生理小种1W的分子标记PMR2.1在230份西瓜种质中筛选出35份抗性种质,占比15.2%。孙洪宝等[20]利用接种鉴定从820份美国PI西瓜种质资源中筛选出27份抗生理小种2WF的种质,其中7份兼抗生理小种1W。由于缺乏炭疽病菌和白粉病菌生理小种的鉴别寄主,笔者不能确定收集的炭疽病菌和白粉病菌的小种类型,因此暂未开展该这2类病害抗病材料的人工接种鉴定。缺乏完整的病原菌生理小种鉴别寄主和标准的接种鉴定技术规程也是国内大多数学者和育种家共同面临的问题。因此,急需形成一套统一的鉴别寄主和接种鉴定方法,进而促进对西瓜炭疽病抗性和白粉病抗性的遗传研究、分子机制研究和分子标记开发,以满足西瓜抗病育种需求。
综上所述,笔者利用分子标记筛选出60份抗枯萎病、20份抗炭疽病、35份抗白粉病的西瓜种质资源,其中兼抗枯萎病和炭疽病的资源6份(表2)、兼抗枯萎病和白粉的资源8份、兼抗炭疽病和白粉病的资源6份。通过人工接种鉴定筛选出8份高抗枯萎病西瓜种质,为西瓜抗病改良和抗病聚合育种中亲本材料的选择提供了依据。
参考文献
[1] 张屹.栽培西瓜品种抗枯萎病基因Fon_1定位[D].长沙:中南大学,2013.
[2] 郜森,王恩煜,杨小振,等.西瓜炭疽病及抗性育种研究进展[J].中国瓜菜,2021,34(5):1-7.
[3] 张慧青,孙玉燕,范敏.西瓜炭疽病研究进展[J].浙江农业科学,2020,61(2):292-295.
[4] 周生茂,班美玲,尚小红,等.瓜类蔬菜白粉病及其抗性分子遗传的研究进展[J].浙江农业学报,2013,25(6):1456-1461.
[5] MOHANTY B.Molecular markers and its applications in plant breeding[J]. Molecular Biomarkers & Diagnosis,2020,11(7):443.
[6] LAMBEL S,LANINI B,VIVODA E,et al.A major QTL associated with Fusarium oxysporum race 1 resistance identified in genetic populations derived from closely related watermelon lines using selective genotyping and genotyping-by-sequencing for SNP discovery[J].Theoretical and Applied Genetics.2014,127(10):2105-2115.
[7] REN Y,MCGREGOR C,ZHANG Y,et al.An integrated genetic map based on four mapping populations and quantitative trait loci associated with economically important traits in watermelon (Citrullus lanatus)[J].BMC Plant Biology,2014,14(33).
[8] WEI C H,ZHU C Y,YANG L P,et al.A point mutation resulting in a 13 bp deletion in the coding sequence of Cldf leads to a GA-deficient dwarf phenotype in watermelon[J].Horticulture Research,2019,6:132.
[9] 李娜,王吉明,尚建立,等.西瓜枯萎病生理小種1抗性QTL精细定位与InDel标记开发[J].中国农业科学,2017,50(1):131-141.
[10] JANG Y J,SEO M,HERSH C P,et al.An evolutionarily conserved non-synonymous SNP in a leucine-rich repeat domain determines anthracnose resistance in watermelon[J].Theoretical and Applied Genetics,2019,132(2):473-488.
[11] KIM K H,HWANG J H,HAN D Y,et al.Major quantitative trait loci and putative candidate genes for powdery mildew resistance and fruit-related traits revealed by an intraspecific genetic map for watermelon ( Citrullus lanatus var.lanatus )[J].Plos One,2015,10(12):e0145665.
[12] 张屹,张海英,郭绍贵,等.西瓜枯萎病菌生理小种1抗性基因连锁标记开发[J].中国农业科学,2013,46(10):2085-2093.
[13] 耿丽华,郭绍贵,吕桂云,等.西瓜枯萎病菌生理小种鉴定技术体系的建立和验证[J].中国蔬菜,2010(20):52-56.
[14] MARTY R D,BRUTON B D.An initial survey of the United States for races of Fusarium oxysporum f.sp.niveum[J].HortScience,1989,24:696-698.
[15] 黎裕,王建康,邱丽娟,等.中国作物分子育种现状与发展前景[J].作物学报,2010,36(9):1425-1430.
[16] 丁蕾,张俊红,王涛涛,等.蔬菜作物重要基因鉴定及其分子育种应用[J/OL].分子植物育种:1-18[2021-06-04].http://kns.cnki.net/kcms/detail/46.1068.S.20210316.1131.008.html.
[17] 刘英,陈柏杰,金荣荣,等.分子标记技术在甜瓜育种中的应用研究进展[J].中国瓜菜,2009,22(5):46-50.
[18] 王吉明,尚建立,董亚玲,等.西瓜抗枯萎病育种的分子辅助选择[J] .中国农学通报,2015,31(7):66-71.
[19] 甘露,马含月,高京草,等.瓜类蔬菜白粉病抗性诱导及抗性遗传研究进展[J].中国瓜菜,2021,34(3):1-6.
[20] 孙洪宝,许勇,张海英,等.美国西瓜种质资源对白粉病生理小种2WF的抗性筛选[J].中国瓜菜,2019,32(8):185-186.
