高邮湖大型底栖动物群落结构及影响因素
2021-10-09申恒伦朱天顺潘保柱武大勇蒋万祥
陈 静,申恒伦,朱天顺,潘保柱,武大勇,蒋万祥,,,*
1 枣庄学院生命科学学院, 枣庄 277160 2 西北旱区生态水利国家重点实验室西安理工大学水利水电学院, 西安 710048 3 河北省湿地生态与保护重点实验室(筹), 衡水 053000
图1 高邮湖底栖动物调查样点位置 Fig.1 Location of macroinvertebrate sampling sites in the Gaoyou LakeGY1—GY21代表调查样点
我国是一个“人口-资源-环境”矛盾凸显、水问题和生态环境问题十分突出的发展中国家[1]。资源性缺水、时空性缺水、污染性缺水、浪费性缺水等,已严重影响和制约社会经济的可持续发展[2]。南水北调工程(South to North Water Transfer Project)是我国进行水资源优化调配,解决北方地区资源性缺水的重大战略工程,其东线和中线工程的运行,有效缓解了华北地区及沿线城市水资源短缺问题。与此同时,工程的实施也给水域生态环境带来了许多不确定性,如(1)调水期河道水流方向由自然状态的由北向南变为由南向北,各调蓄湖泊水文环境(如水深、蓄水量)较之工程运行前发生不同程度的改变;(2)水生生物群落受到不同程度的影响,如工程运行后高邮湖水生植物由调水前的158种锐减为8种[3];喜河口和近海生活的须鳗虾虎鱼(Taenioidescirratus)和双带缟虾虎鱼(Tridentigerbifasciatus)已随调水通道侵入南四湖、东平湖[4]。
高邮湖作为南水北调东线工程沿线距长江最近的湖泊,具有渔业生产、供水、蓄水、泄洪排涝等作用[5]。近年来,伴随城市扩张和经济快速发展,产生的大量生活和工业污水使高邮湖入湖污染物总量已经超过其自净能力,总氮、总磷和高锰酸盐指数均已经达到轻度或中度富营养化水平[3,6],严重威胁流域内水资源的利用和生态环境。
大型底栖动物(以下简称底栖动物)是淡水生态系统重要组成部分,对改变沉积物理化性质,促进营养元素循环和系统能量流动等具有重要作用[7-8];同时,由于具有较高的生物多样性(不同生境中都有分布)、移动能力弱、对不利环境因子没有或很少有回避性,能够很好地反映水域的空间异质性,一直是评价淡水生态系统健康的重要类群之一[9-10]。目前,有关高邮湖底栖动物的系统研究尚鲜见报道。本文对丰水期和枯水期高邮湖底栖动物群落进行了研究,以期厘清如下基本问题:1)阐明高邮湖底栖动物物种区系组成;2)解析底栖动物群落和生物多样性格局;3)明确影响高邮湖底栖动物的主要环境因子。
1 材料和方法
1.1 研究区域概况及样点设置
高邮湖(119°06′—119°25′E、 32°30′—33°05′N)位于淮河下游地区的安徽省天长市和江苏省高邮市,是南水北调东线工程的源头,全国第六大淡水湖[5]。湖区长48 km,最宽处28 km,水域面积760.67 km2[11]。近年来,随着周围城镇工业的发展,使得水体受到不同程度的污染,已呈现富营养化状态[3,6,11]。本研究采用网格布点方法,兼顾生境特征,于高邮湖共设样点21个(GY1—GY21),其中GY1—GY4位于紧挨湖区的京杭大运河(图1)。
1.2 底栖动物采集与鉴定
2018年4(枯水期)、9月(丰水期)对高邮湖底栖动物进行了调查。使用采样面积0.0625 m2的改良彼得森采泥器(modified Peterson grab)采集底栖动物,于每个样点重复采集2—3次,用孔径为500 μm的筛网冲洗后,将网中剩余物质倒入自封袋,自封袋中加少量湖水放入装有冰块的保温箱。样品运回后将底栖动物拣出,装标本瓶中,用10%的福尔马林液固定。在显微镜和体视镜下参考相关资料对物种进行鉴定[12-15]、计数。由于水生植物大量繁殖船只不能通行等原因,4月份GY1、GY6、GY9、GY13样品缺失,9月份GY18样点样品缺失,共采集底栖动物样本37个。
1.3 水质因子测定
水温(WT)、水深(Dep)、pH值(pH)、电导(Cond)、总溶解性固体(TDS)、盐度(Sal)、溶解氧(DO)、氧化还原电位(ORP)用YSI EXO- 1多参数水质分析仪现场测定;透明度(SD)用塞氏盘现场测定;总氮(TN)、硝态氮(NO3-N)、氨氮(NH3-N)、总磷(TP)、磷酸盐(PO4)、高锰酸钾指数(CODMn)、硅酸盐(Si)使用SKALAR公司San++型连续流动分析仪(Continuous Flow Analyzer, CFA)测定。叶绿素a(Chla)采用丙酮提取,分光光度法测定[16]。
1.4 数据分析
本研究样点图制作使用的软件为ArcGIS 10.0;底栖动物密度和生物多样性采用配对样本t检验进行比较;指示物种分析(Indicator species analysis)用于筛选区分两次调查间底栖动物群落差异的关键物种;非度量多维标度排序(Non-matric Multi-Dimentional Scaling, NMDS)和多响应置换过程(Multi-response permutation procedures, MRPP)用于分析底栖动物群落的差异;基于距离的冗余度分析(Distance-based redundancy analysis, dbRDA)用于分析对底栖动物群落结构影响的主要环境因子。指示物种分析、非度量多维标度排序和多响应置换过程分析前均将群落物种数据转换为相对丰度。基于距离的冗余度分析过程中首先将物种数据和环境数据进行log(x+1)转换,然后将转化后的数据分别基于BRAY-CURTIS SIMILARITY,EUCLIDEAN DISTANCE构建矩阵,基于矩阵构建生物群落-环境模型。
配对样本t检验采用的软件为SPSS 19.0;指示物种分析、非度量多维标度排序、多响应置换过程分析使用的软件为PC-ORD 5.0;基于距离的冗余度分析使用软件为PERMANOVA+ for PRIMER;柱状图采用Oringin 8.0制作。
2 结果
2.1 底栖动物物种组成
本研究共鉴定底栖动物42种,隶属3门7纲15目22科。软铗小摇蚊(Microchironomustener)、霍甫水丝蚓(Limnodrilushoffmeisteri)、齿吻沙蚕(Nephtyssp.)、苏氏尾鳃蚓(Branchiurasowerbyi)、厚唇嫩丝蚓(Teneridrilusmastix)为调查期间优势物种,相对丰度分别为24.0%、17.7%、8.1%、7.2%、6.5%(表1)。其中,4月份共鉴定底栖动物30种,优势分类单元为软铗小摇蚊、霍甫水丝蚓、厚唇嫩丝蚓和苏氏尾鳃蚓(表1)。9月份共鉴定底栖动物25种,齿吻沙蚕、苏氏尾鳃蚓、中国长足摇蚊(Tanypuschinensis)、沼虾(Macrobrachiumsp.)、河蚬(Corbiculafluminea)、梨形环棱螺(Bellamyapurificata)、霍甫水丝蚓、钩虾属一种(Gammarussp.)为研究区域优势物种[17](表1)。
2.2 底栖动物密度和生物多样性
对底栖动物密度和生物多样性格局进行分析(图2),结果表明,4月份底栖动物平均密度为376 个/m2,GY4号样点密度最高,为688 个/m2,GY8号样点密度最低,为16 个/m2;9月份密度均值为115 个/m2,GY12密度最高,为336 个/m2,GY8、GY16密度最低,均为16 个/m2。4月份物种丰富度均值为5.3,其中,GY4物种丰富度最高,为13种,GY8最低,仅采集到1种底栖动物;9月份物种丰富度均值为3.4, GY2、GY9物种丰富度最高,均为6种,GY8、GY16物种丰富度最低,均采集到1种。4月份香浓指数均值为1.19,GY4最高,为2.25,GY8最低,为0;9月份均值为0.96,GY2最高,为1.68,GY8、GY16最低,均为0。4月份均匀度指数均值为0.75,GY11最高,为1,GY8最低,为0;9月份均值亦为0.75,GY7、GY15、GY19最高,均为1,GY8、GY16最低,均为0。采用配对样本T检验比较密度和多样性指数于两个季节间的差异,结果表明,密度、物种丰富度、香浓指数均表现为4月份显著高于9月份(P<0.05);而均匀度指数差异不显著(P>0.05)。
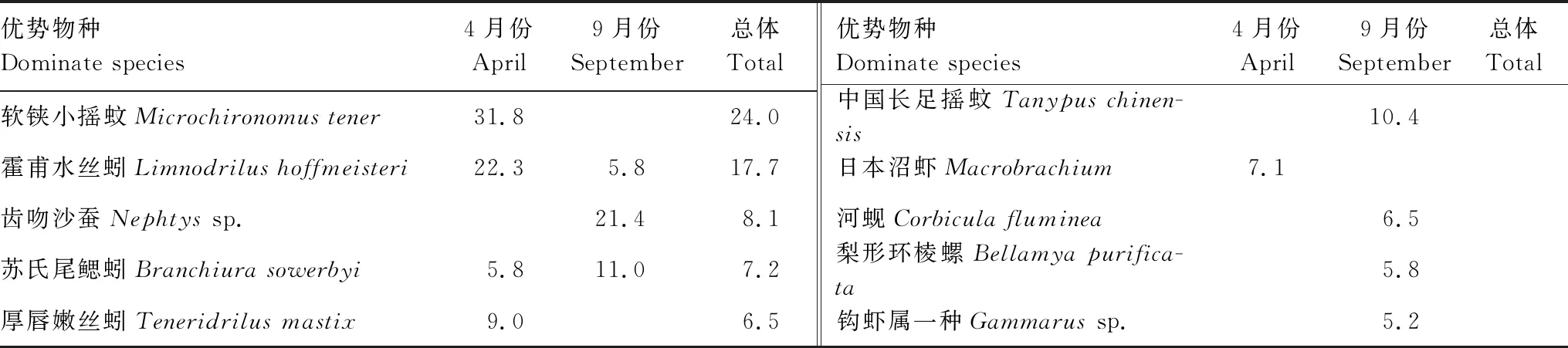
表1 高邮湖底栖动物群落优势物种及其相对丰度
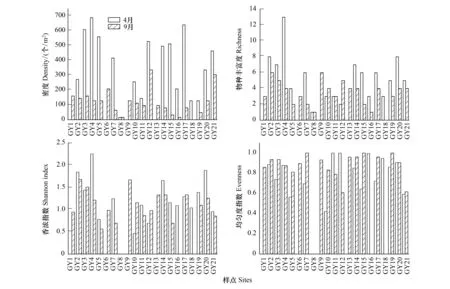
图2 高邮湖各样点底栖动物密度、物种丰富度、香浓指数和均匀度指数Fig.2 Values of maroinvertebrate density, spiecies richness, Shannon index and Evenness index in the sites of Gaoyou Lake
2.3 底栖动物群落结构比较
基于非度量多维标度排序(NMDS)对底栖动物群落进行排序(图3),结果表明,4月份和9月份底栖动物群落组成存在较大差异(Sress=25.6)。其中,4月份底栖动物群落主要分为3组,即Apr.1、Apr.2、Apr.3;9月份底栖动物也主要分为3组,即Sep.1、Sep.2、Sep.3。采用多响应置换过程(MRPP)对两次调查不同组底栖动物群落结构进行比较,结果表明,4月份和9月份不同底栖动物群落均存在显著差异(P<0.05)。
指示物种分析用于解析造成各组分间差异的关键物种(表2),结果表明,软铗小摇蚊、霍甫水丝蚓、有栉管水蚓(Aulodriluspectinatus)是造成4月份和9月份底栖动物群落差异的关键物种,均表现为4月份显著高于9月份。4月份共筛选出2种指示物种,即齿吻沙蚕和软铗小摇蚊,最大值分别出现在Apr.3和Apr.1。9月份共有指示物种5种,其中,沼虾、河蚬、梨形环棱螺、方格短沟蜷(S.cancellata)最大值出现在Sep.1,齿吻沙蚕最大值出现在Sep.3。

图3 高邮湖底栖动物群落非度量多维标度排序Fig.3 Non-matric multidimentional scaling ordination of macroinvertebrat communiesG1—G21代表4月份底栖动物群落,GY1—GY21代表9月份底栖动物群落
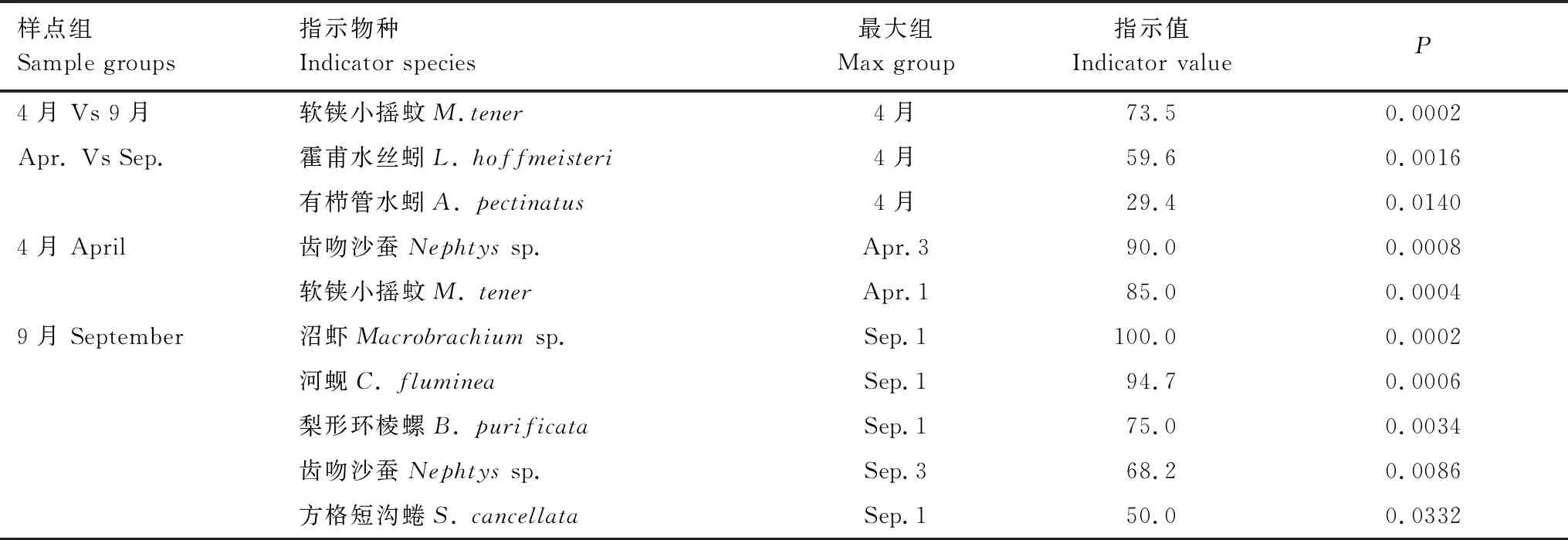
表2 高邮湖底栖动物群落指示物种
2.4 环境因子对底栖动物群落的影响
采用基于距离的冗余分析(dbRDA)解析环境因子对底栖动物群落的影响,结果表明,4月份高邮湖底栖动物群落主要受硅酸盐(Si)和总磷(TP)影响(P<0.05);9月份水深(Dep)和叶绿素a(Chla)含量对底栖动物群落影响显著(P<0.05)(图4,表3)。

图4 落基于距离的高邮湖底栖动物群冗余分析Fig.4 Distance-based redundancy analysis of macroinvertebrate communities in the Gaoyou LakeTP、Si、Chla、Dep分别代表总磷、硅酸盐、叶绿素a、水深 TP、Si、Chla、Dep stand for total phosphate, silicate, chlorophyll a and water depth
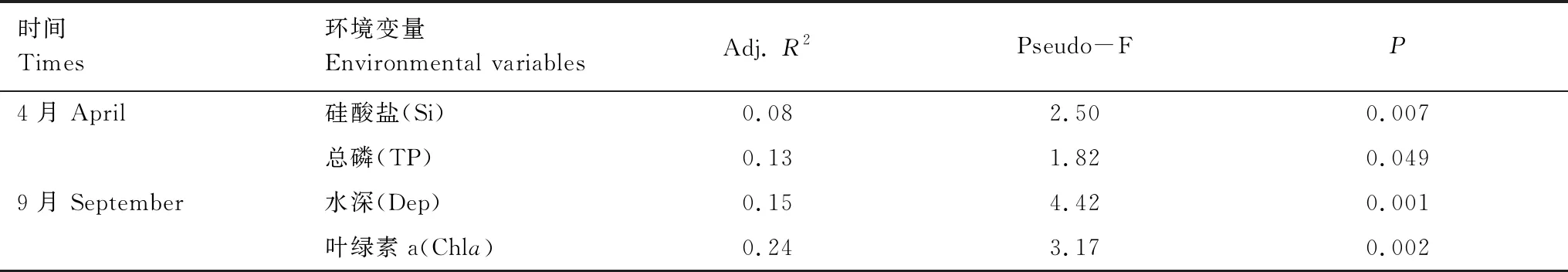
表3 基于距离的高邮湖底栖动物群落冗余分析结果
3 讨论
近年来,随着高邮湖周边地区工业和农业生产、围网(圈圩)养殖的发展,水环境发生了较大变化,水体污染不断加剧[6]。研究表明,随着营养水平的不断增加,底栖动物群落会逐渐被小个体的耐污种类所主导,且具有趋于简单化的演替趋势[8]。本研究高邮湖底栖动物优势物种组成也验证了这一说法。优势类群主导底栖动物分类格局,调查期间高邮湖底栖动物动物优势物种均为富营养化耐受种,对水体污染耐受性较强。如霍甫水丝蚓、苏氏尾鳃蚓丰度通常与湖泊营养状态密切相关[18],其在水体中大量孳生是环境污染严重的重要标志[19]。这和Hu 等[20]对本区域内浅水湖泊的调查结果基本一致,即寡毛类(主要是霍甫水丝蚓和苏氏尾鳃蚓)和摇蚊主导该区域底栖动物群落分布格局。
4月份优势物种组成相对简单,主要由耐污的寡毛类和摇蚊组成。而9月份优势物种组成相对4月份变化较大,甲壳类(钩虾和沼虾)和软体动物(河蚬和梨形环棱螺)出现在优势类群中;丰度最高的类群由4月份的软铗小摇蚊演变为相对敏感种齿吻沙蚕。可能主要因为1)4月份优势物种软铗小摇蚊在9月份之前绝大部分已经羽化;2)9月份丰水期大量外水汇入,水体交换速率加快,水质趋于变好,如叶绿素a平均含量由4月份的18.7 mg/L降为13.9 mg/L,水体TN含量均值由4月份1.86 mg/L降为0.75 mg/L。
密度和生物多样性指数于各样点间变化幅度较大,是各样点间生境特征差异较大的反映。底栖动物密度、物种丰富度和香浓指数均表现为4月份显著高于9月份,主要归因于1)4月份沉水植物大量生长(主要为菹草Potamogetoncrispus),遍及全湖;而9月份仅在个别区域出现[3]。水生植物能够增加生境异质性,为底栖动物提供栖息、避难、产卵场所及食物资源(植物本身及附着藻类),并能消耗水体的营养盐,可有效提高底栖动物多样性[21-23]。此外,4月份处于禁渔期,人为活动对湖泊底质的干扰减少也是底栖动物密度和多样性相对较高的重要因素。
因始终受到水域环境完整性的影响,样本分类或排序一直是环境监测的有效工具[24-25]。底栖动物群落结构的改变,与水域环境变化及人为干扰程度的加剧密不可分[26-27]。非度量多维标度排序(NMDS)从群落层面证实了两次调查期间水环境的差异,无论基于两次调查群落整体,还是同一站位的两个底栖动物群落(两次调查)在排序图上的位置。虽然多样性指数和其它群落层面的变量可以表明广泛的生态模式或格局[28],但可能掩盖种间差异[29]。与此相似,大多数多元方法允许分析整个群落对环境的响应,但不能区分这种响应是由所有物种驱动还是由一个物种子集驱动。指示物种分析能够确定造成样点组(或生境)间差异的关键物种,对深入解析生物、环境变化具有重要作用[30]。对污染和富营养化耐受力较强的软铗小摇蚊、霍甫水丝蚓、有栉管水蚓是造成两次调查底栖动物群落差异的关键物种,这和上述对两次调查期间生境的分析是一致的。同时,我们基于群落排序将两次调查底栖动物群落结构均进行了分类(4月份Apr.1、Apr.2、 Apr.3和9月份Sep.1、Sep.2 、Sep.3),并明确区分各组的关键物种。9月份,组Sep.1样点全部位于京杭运河,沼虾、河蚬、梨形环棱螺、方格短钩蜷仅在组Sep.1采集到;而区分湖区样点组Sep.2 和Sep.3的关键物种齿吻沙蚕在组Sep.3丰度较高,且该组样点主要位于高邮湖南部。这一结果是咸水、半咸水物种(如齿吻沙蚕)在高邮湖自南向北迁移的重要体现,表明江湖连通对维持生物多样性具有重要作用[31]。4月份,季节性较强的软铗小摇蚊大量孳生,主导高邮湖底栖动物分布格局,主要体现在:1)17个有效样本中的9个属于组Apr.1;2)相比9月份,齿吻沙蚕主导的样点显著减少(仅G11和G16),尽管一些位于湖泊南部的样点(如G7、G10、G14、G15)仍有齿吻沙蚕被采集到。
厘清影响底栖动物群落的关键环境因子对于区域生物多样性保护、湖泊管理具有重要意义。与水体营养状态相关的因子通常对底栖动物群落结构具有重要影响[32-33]。在高营养盐浓度的水体中,水体底层的溶解氧浓度较低,直接限制了敏感物种的生存;厌氧条件还会增加沉积物中硫化物的含量,从而增大了对大型底栖动物的潜在毒性[34]。同时,富营养化对底栖动物的生长、繁殖和存活率也有一定影响[31]。总磷和叶绿素a含量对湖泊营养水平具有重要影响,常用于指示水体营养水平[35]。总磷(通常为富营养化的限制因子)和叶绿素a 含量保留在模型(dbRDA)中,表明水体营养水平对高邮湖底栖动物群落具有重要影响。与总磷和叶绿素a不同,水体中硅酸盐浓度增高可提高硅藻的生物量和种类,从而促进其同蓝、绿藻的竞争,抑制蓝、绿藻的生长[36]。水深能够影响沉积物-水界面溶解氧含量,水生植物、底栖藻类生长,风力对底质的扰动,以及其它生物地理化学过程;Qin 等[37]研究认为水深在湖泊富营养化过程中可能起关键性作用。9月份高邮湖不同区域水深波动较大(1.2—3.2 m),严重影响了底栖动物的生存及分布格局。此外,两次调查dbRDA前两轴对总体方差的解释率均不高(分别为25.6%,36.5%),主要因为本研究中涉及到的环境变量有限,其它诸如水生植物、土地利用、空间变量及随机过程等可能对底栖动物群落影响较大的因子并未被涉及[38-40];除环境因子外,生物间的相互作用以及生物因子也是影响生物群落结构的重要因素[41]。
