核桃青皮提取物对非酒精性脂肪肝的作用
2021-10-09方琼莲王蒙蒙乔雪李欣坪黄丰林玉萍赵声兰
方琼莲,王蒙蒙,乔雪,李欣坪,黄丰,林玉萍,赵声兰
(云南中医药大学 中药学院,云南省南药可持续利用重点实验室,云南 昆明,650500)
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是一种慢性进行性肝脏疾病,病理过程始于肝脂肪沉积,可进展为非酒精性脂肪肝炎、肝纤维化、肝硬化和肝癌等,已成为全球终末期肝病的主要病因,影响全球约25%的人群[1-2]。NAFLD常伴有高血脂、高血压、冠心病等,增加心血管疾病发生率和死亡风险,已成为威胁人群健康和生命的重要疾病[3]。研究显示,脂质过氧化及炎症因子失衡是NAFLD病情发展过程中致肝细胞损伤的重要原因[4]。
核桃青皮是胡桃科植物胡桃楸未成熟果实的青果皮,又名青龙衣,主要分布在河北、山东、云南等省[5-6]。核桃青皮味苦、涩,性平,微寒,有小毒,具有清热解毒、祛风疗癣、止痛止痢等功效[7-8]。现代药理研究表明,核桃青皮提取物具有抗氧化、抗菌、抗肿瘤、抗病毒、治疗皮肤病、杀虫等药理活性[9-11]。云南是我国著名的核桃主产区之一,核桃年产量居全国之首,但核桃青皮的利用价值低,大多丢弃在农间地头,不仅资源浪费还会污染环境[12]。为促进资源的综合利用,本文研究核桃青皮不同溶剂提取物对NAFLD大鼠的体重变化、肝脏病理学改变及血清中甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、谷氨酸氨基转移酶(glutamate aminotransferase,ALT)水平、肝脏丙二醛(malondialdehyde,MDA)含量和超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性的影响,以期能揭示其对NAFLD损伤大鼠的作用活性部位,为资源开发与利用奠定基础。
1 材料与方法
1.1 材料与试剂
核桃青皮(walnut green husk)为核桃未成熟的外果皮,采自云南省丽江市华坪县;SPF级雄性SD大鼠36只,6~8周龄,体重180~200 g,购于湖南斯莱克景达实验动物有限公司[许可证号:SCXK(湘)2016-0002]),动物伦理学审查编号R-0620170043。
胆酸钠,深圳百晟精细化有限公司;胆固醇,广州亿宝莱生物科技有限公司;猪油,四川瑞洋油脂有限公司;蛋黄粉,实验室购买鸡蛋后自制;0.9%氯化钠注射液,广西裕源有限公司;75%乙醇消毒液,昆明利健消毒制品有限公司;水飞蓟宾胶囊,天津天力士圣特制药有限公司(国药准字:H20040299);TG、TC、HDL-C、LDL-C、ALT、AST试剂盒,南京建成生物工程研究所;MDA(批号:120718190301)、GSH-Px(批号:112618190311)、SOD(批号:032219190408),上海碧云天生物技术有限公司;乙醇、乙酸乙酯、正丁醇均为分析纯,中国天津市化学试剂一厂。
1.2 仪器与设备
电热恒温水浴锅,上海医疗器械五厂;INFINITE M200 PRO酶标仪,瑞士TECAN公司;湘仪H1850R台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;先行者TM(OHAUS)分析天平,上海奥豪斯有限公司;DY89-Ⅱ型电动玻璃匀浆机,宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1 核桃青皮提取物的制备
核桃青皮干燥后粉碎成粗粉,取500 g用2 000 mL 95%(体积分数)乙醇加热回流提取3次,每次3 h;合并3次提取液,减压蒸馏浓缩得乙醇浸膏(浸膏得率20.40%),冷冻干燥,即得乙醇提取物(102 g)。取部分乙醇提取物,加适量水溶解,形成混悬溶液,再依次用乙酸乙酯、正丁醇各200 mL进行萃取,分别萃取4次;合并相同萃取部分,回收溶剂浓缩成浸膏(浸膏得率分别为18.55%、21.89%),冷冻干燥,得到乙酸乙酯萃取物(18.92 g)和正丁醇萃取物(22.33 g)。
1.3.2 大鼠肝损伤模型的建立与试验设计
36只SPF级SD雄性大鼠饲养于云南中医药大学动物房,实验室条件为室温18~25 ℃、湿度(55±5)%,随机选取6只为正常组,给予正常饲料;其余30只大鼠给予高脂饲料[13](82.5%普通饲料、2%胆固醇、10%猪油、5%蛋黄粉、0.5%胆酸钠),连续喂养12周,建造NAFLD大鼠肝损伤模型。造模成功的30只大鼠随机分为5组,即模型组(生理盐水)、阳性对照组(水飞蓟宾12.6 mg/kg)、核桃青皮乙醇提取物组(300 mg/kg)、核桃青皮乙酸乙酯萃取物组(300 mg/kg)、核桃青皮正丁醇萃取物组(300 mg/kg),每组6只。各组大鼠自由饮水和进食,昼夜交替周期12 h,每天灌胃给药1次,连续给药6周,给药期间每周监测大鼠体重、饮水量和进食量。末次给药后禁食12 h,以10%水合氯醛腹腔注射麻醉,腹主动脉取血,4 ℃静止30 min后,低温离心(3 000 r/min)15 min,分离得到血清[14];迅速取出肝脏,用0.9%(质量分数)的生理盐水漂洗,部分按肝组织与生理盐水1∶9(g∶mL)制备匀浆,于-4 ℃、3 500 r/min离心15 min,吸取上层匀浆清液[15];部分用4%多聚甲醛固定,脱水制成石蜡切片,用苏木精-伊红染色(hematoxylin-eosin staining,HE)进行组织病理学观察[16]。
1.3.3 病理切片观察
HE染色后的各组大鼠肝组织切片,置于显微镜下观察病理切片并采集图像。
1.3.4 肝比重的测定
肝比重的测定如公式(1)所示:
(1)
1.3.5 生化指标的检测
血清中的TG、TC、HDL-C、LDL-C、ALT和AST含量的测定:取上述制备各组大鼠的血清,按照试剂盒说明书,检测各组大鼠血清TG、TC、HDL-C、LDL-C、ALT、AST含量。
肝组织中的TG、TC、ALT、AST、MDA含量和SOD、GSH-Px活性的测定:取上述各组大鼠的肝组织匀浆上清液,按照试剂盒说明书,检测各组大鼠肝脏中TG、TC、ALT、AST、MDA的含量和SOD、GSH-Px的活性。
1.4 统计学处理
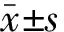
2 结果与分析
2.1 核桃青皮提取物对NAFLD大鼠体重的影响
核桃青皮不同提取部位对大鼠体重的影响结果如表1所示。给药前到实验结束,正常组、模型组、水飞蓟宾组、核桃青皮乙醇提取物组、乙酸乙酯萃取物组、正丁醇萃取物组大鼠的体重均逐日增加。其中模型组体重上升趋势较为明显,而水飞蓟宾组、核桃青皮乙醇提取物组、乙酸乙酯萃取物组、正丁醇萃取物组大鼠的体重随给药周数的增加上升缓慢,特别是核桃青皮乙酸乙酯萃取物组和正丁醇萃取物组大鼠体重在实验结束时与正常组较为接近,说明核桃青皮提取物具有降低NAFLD大鼠体重的作用。
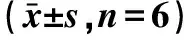
表1 各实验组大鼠的体重变化Table 1 Body weight changes of rats in each experimental group after administration
2.2 肝损伤病理切片分析
各组大鼠肝损伤病理切片结果如图1所示。正常组(图1-a)中大鼠肝细胞以中央静脉丛呈放射状分布、排列整齐、结构清晰,肝小叶结构完整,形态正常;模型组(图1-b)大鼠肝小叶结构破坏,肝索和肝窦结构不清晰,部分肝细胞坏死,有炎性细胞浸润,表明肝损伤模型复制成功。水飞蓟宾组(图1-c)和核桃青皮不同极性部位(图1-d~图1-f)可改善肝细胞的损伤程度,肝小叶结构完整,细胞排列整齐,大小均匀,分界清楚,病变情况有较大改善,其中核桃青皮正丁醇萃取物改善肝损伤病理组织的作用最为明显。

a-正常组;b-模型组;c-水飞蓟宾组;d-核桃青皮乙醇提取物组;e-核桃青皮乙酸乙酯萃取物组;f-核桃青皮正丁醇萃取物组图1 各实验组大鼠肝组织HE染色(×200)Fig.1 HE staining of rat liver tissues in each experimentalgroup(×200)
2.3 肝损伤病理切片分析
核桃青皮不同提取物对大鼠肝比重的影响结果如图2所示。与正常组比较,模型组肝比重急剧升高(P<0.001)。与模型组比较,水飞蓟宾组和核桃青皮不同提取物显著降低(P<0.001),说明核桃青皮不同提取物皆有较好降低肝比重的作用。

图2 核桃青皮提取物对大鼠肝比重的影响Fig.2 Effects of the extract of walnut green husk on liver specific gravity of rats注:与正常组相比,###P<0.001;与模型组相比,*P<0.05,**P<0.01,***P<0.001(下同)
2.4 核桃青皮提取物对肝损伤大鼠血清TG、TC、HDL-C、LDL-C、ALT、AST含量的影响
核桃青皮不同提取物对肝损伤大鼠血清TG、TC、HDL-C、LDL-C、ALT、AST含量的影响结果如图3所示。与正常组比较,模型组大鼠血清TG、TC、LDL-C、ALT、AST含量显著升高(P<0.001),HDL-C显著降低(P<0.001),表明肝损伤模型复制成功。与模型组比较,核桃青皮不同提取物组TG、TC含量显著降低(P<0.001),说明核桃青皮具有较好的降脂作用。由于脂肪的过度沉积会引起细胞质中自由基增加和氧化应激反应,引起线粒体和细胞膜损伤,增加通透性,从而使血清中AST和ALT的含量升高。
2.5 核桃青皮对肝损伤大鼠肝组织中MDA、GSH-Px、SOD活性的影响
核桃青皮提取物不同部位对大鼠肝组织中MDA、GSH-Px、SOD活性的影响结果如图4所示。与正常组比较,模型组大鼠肝组织MDA的含量明显升高(P<0.001),GPS-Px、SOD活性显著降低(P<0.001),表明肝损伤模型复制成功。与模型组比较,水飞蓟宾和核桃青皮不同提取物均可显著降低肝匀浆中MDA含量(P<0.001,P<0.05),显著增强GPS-Px和SOD的活性(P<0.001),其中核桃青皮正丁醇萃取物的效果更明显。
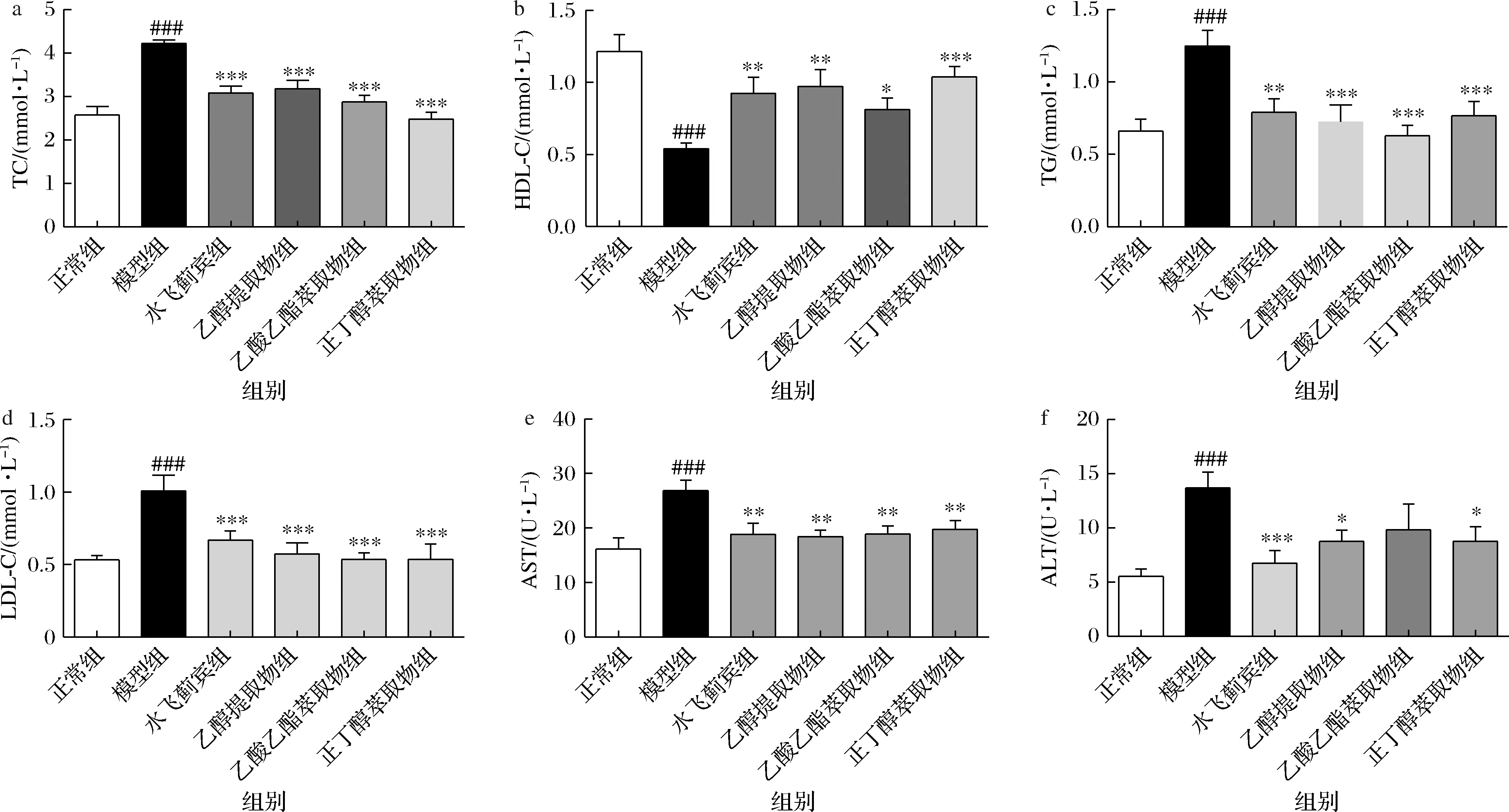
a-TC;b-HDL-C;c-TG;d-LDL-C;e-AST;f-ALT图3 核桃青皮提取物对大鼠血清中TG、TC、HDL-C、LDL-C、ALT、AST的影响Fig.3 Effects of the ethanol extract of walnut green husk on the level of TG, TC, HDL-C, LDL-C, ALT, AST in serum of rats
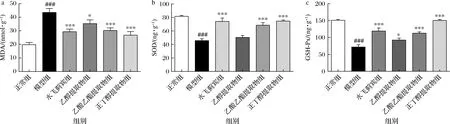
a-MDA含量;b-SOD活性;c-GSH-Px活性图4 核桃青皮提取物对大鼠肝组织中MDA含量和SOD、GSH-Px活性的影响Fig.4 Effects of the extract of walnut green husk on the level of MDA and SOD, GSH-Px activity in liver of rats
3 结论
核桃(JuglansregiaL.)属于胡桃科(Juglandaceae)胡桃属(JuglansL.),目前中国是最大的核桃生产国(约170万t)[17-18]。研究报道,胡桃属植物具有强劲的抗氧化、抗肿瘤、杀菌和止痛等功能[19],核桃青皮乙醇提取物具有较强的抗氧化能力[20],能有效减轻高果糖(high-fructose,HF)饮食引起的肝损伤[21]。而植物来源的抗氧化剂在预防代谢综合征和由长期高脂肪、高糖饮食引起的代谢疾病方面显示出潜在的生物学效应[22]。为明确核桃青皮对高脂饲料诱导的NAFLD具有改善作用和抗氧化活性部位。本实验研究核桃青皮95%乙醇提取物及其乙酸乙酯萃取物和正丁醇萃取物对高脂饲料诱导的NAFLD的作用。
水飞蓟宾有抗脂质过氧化、消除自由基、维持细胞膜稳定性和促进肝细胞再生的作用,对于各种原因引起的急慢性肝炎、脂肪肝的肝功能异常等均具有治疗作用,是天然的保肝药,所以选择其为阳性药[23]。大鼠的体重、肝比重、TG、TC、HDL-C、LDL-C是反应大鼠肥胖程度的重要指标;ALT和AST是诊断肝功能障碍的重要指标[24],当肝脏损伤时,ALT和AST从肝细胞进入血液,导致血液中ALT和AST含量明显升高[25]。MDA是机体内脂质过氧化的产物之一,可间接反映细胞膜脂损伤程度;当肝细胞氧化损伤时,SOD、GSH-Px不断消耗清除超氧化物、自由基及有害物质等,其含量可反映肝组织过氧化损伤的程度[26-27]。
本研究结果显示,核桃青皮乙醇提取物、乙酸乙酯萃取物和正丁醇萃取物可减轻成年大鼠肝脏质量,减少肝脏脂肪堆积,降低肝比重,降低大鼠血清中TG、TC、LDL-C、ALT、AST含量,升高HDL-C含量,且具有显著性差异;能改善肝组织病理损伤;显著性降低肝匀浆中MDA含量并升高GSH-Px、SOD含量;其中,正丁醇萃取物表现出更好的效果。因此,核桃青皮能调节高脂饲料诱导NAFLD模型大鼠的肝脂水平,改善肝损伤,其正丁醇部位有效活性成分需进一步研究阐明。
