电针额区对血管性痴呆模型大鼠学习记忆能力及海马回CA1区细胞凋亡的影响
2021-10-09马莉陈玉伍思政肖海燕赵鑫宇张雪松
马莉,陈玉,伍思政,肖海燕,赵鑫宇,张雪松*
(1. 黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;2. 黑龙江中医药大学,黑龙江哈尔滨 150040)
血管性痴呆(VD)是由脑卒中(缺血或者出血)引起的一种认知功能障碍及情感障碍的综合征[1]。随着我国社会不断进步和发展,生活条件和医疗环境不断改善,生活习惯不规律和人口老龄化也随之越来越严重,痴呆类疾病也逐渐引起社会的关注。据统计,我国有关痴呆这一疾病的发病率逐年递增,其中VD 位居发病率排名第二,就目前而言在这些痴呆类疾病中,VD是唯一可以通过积极治疗可控制和改善的。VD患者识人不清、记忆力下降、情感表达异常,使患者家庭背负了沉重的负担[2]。VD 的发病主要是因为长期或者反复的脑组织缺血、缺氧,神经元赖以生存的环境遭到破坏,使神经元变性、凋亡等[3]。因此,如何控制、改善或修复脑组织缺血、缺氧的状态,解决这一问题的关键就是脑血管再通问题。脑组织有赖于脑血管中血液的滋养,当出现脑卒中时(主要是脑缺血),会引起血管堵塞,所以在缺血区域改善供血或者建立新的侧支循环是解决该问题的可行方法[4]。本研究探讨电针对VD模型大鼠的影响,现报告如下。
1 材料与方法
1.1 实验动物
本研究实验动物情况详见表1。
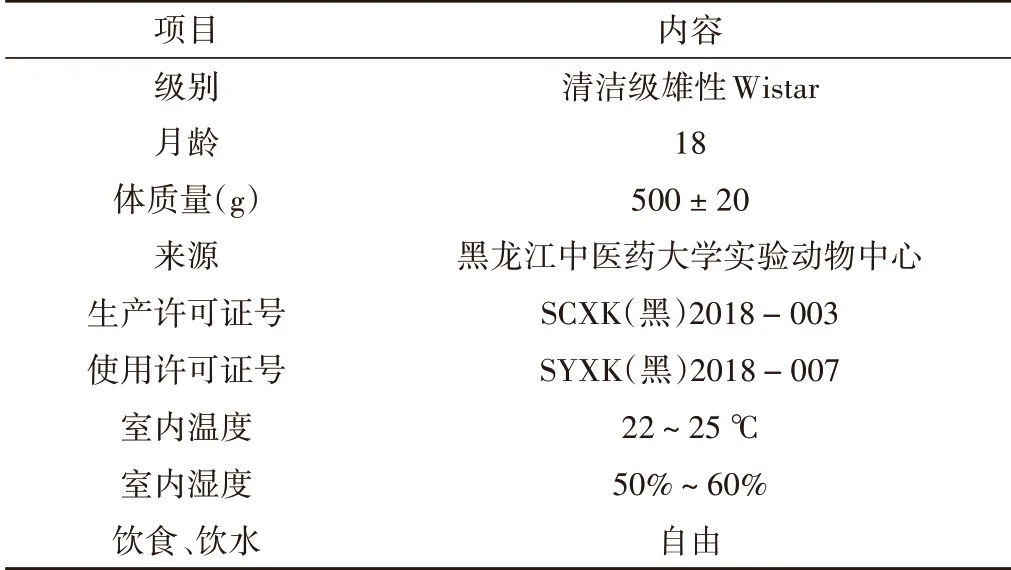
表1 实验动物基本情况
1.2 药物与试剂
脑复康(湖南迪诺制药有限公司,批号:H43020666);大鼠血管内皮生长因子(江苏酶免实业有限公司,批号:2019-10);细胞凋亡试剂盒(Roche Molecular Biochemicals,germany,批号:11684817910)。
1.3 造模与分组
VD 模型参照采用2-VO 法。将大鼠随机分为假手术组(0.9%NaCl,15只)、模型组(0.9%NaCl,15只)、西药组(脑复康,15 只)和电针组(2 Hz 疏密波电针,15只),造模方法见参考文献[5]。
1.4 给药
电针组:将大鼠固定在大鼠台上(采用俯卧位),根据于致顺老师头穴分区针刺这一理论,本实验选取的腧穴都在大鼠额区,分别是前庭和囟会穴以及其向左、右各1寸及2寸的穴位,用脉冲电疗仪连接前庭和囟会穴(参照华兴邦等[6]的《大鼠穴位图谱的研制》),给予疏密波,将这波形的频率调至2 Hz,20 min,1 次/d,连续治疗30 d。其余3组大鼠只束缚在鼠台上20 min。
西药组:脑复康配置为浓度40 mg/mL,大鼠给药时,剂量为6 mL/kg,1次/d,连续治疗30 d。
假手术组:0.9% NaCl 进行灌胃,给药体积、频次和时间同西药组。
模型组:治疗同假手术组。
1.5 观察指标
1.5.1 Morris 水迷宫检测
该实验包括定位航行和空间探索试验。该测试所需要的时间为6 d,每天测验8 次,上午和下午进行测验次数相同。
1.5.2 血清VEGF含量检测
按照试剂盒说明进行严格操作。
1.5.3 细胞凋亡检测
将大鼠脱颈处死取脑组织,浸入10%福尔马林溶液中。利用TUNEL 法,查看光镜下大鼠海马区细胞凋亡状态并拍照。
1.6 统计学方法
采用SPSS 22.0软件分析系统对各组数据进行统计学计算,所有数据以±s表示,P≤0.05为有统计学意义。
2 结果
2.1 Morris水迷宫检测结果比较
2.1.1 大鼠逃避潜伏期时间比较
与模型组比较,其余3 组均低于模型组(P<0.05),电针组与西药组比较差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠逃避潜伏期时间比较(±s)

表2 各组大鼠逃避潜伏期时间比较(±s)
注:与模型组比较,1)P <0.05;与西药组比较,2)P >0.05。
组别模型组假手术组西药组电针组n 15 15 15 15逃避潜伏期(s)53.90±4.31 39.46±2.391)42.47±3.261)40.25±1.221)2)
2.1.2 穿过平台次数比较
与模型组比较,其余3 组均高于模型组(P<0.05),电针组与西药组比较差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠穿过平台次数比较(±s)
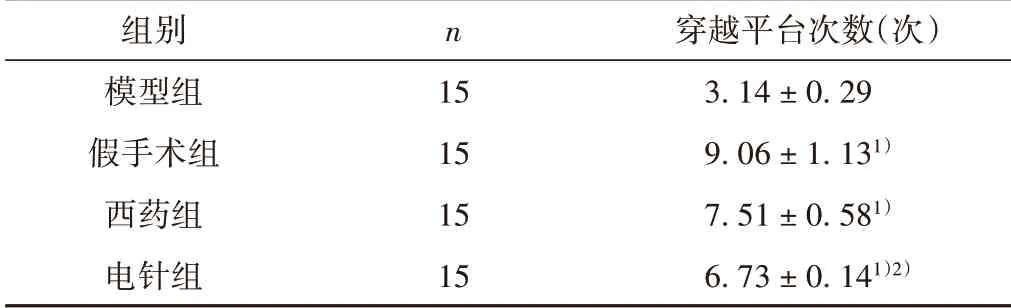
表3 各组大鼠穿过平台次数比较(±s)
注:与模型组比较,1)P <0.05;与西药组比较,2)P >0.05。
组别模型组假手术组西药组电针组n 15 15 15 15穿越平台次数(次)3.14±0.29 9.06±1.131)7.51±0.581)6.73±0.141)2)
2.2 各组大鼠血清VEGF含量比较
西药组和电针组大鼠血清VEGF 含量明显高于模型组,并且模型组高于假手术组(P<0.05);电针组与西药组在血清VEGF 含量方面比较,差异无统计学意义(P>0.05)。见表4。
表4 各组大鼠血清中VEGF的含量比较(±s)
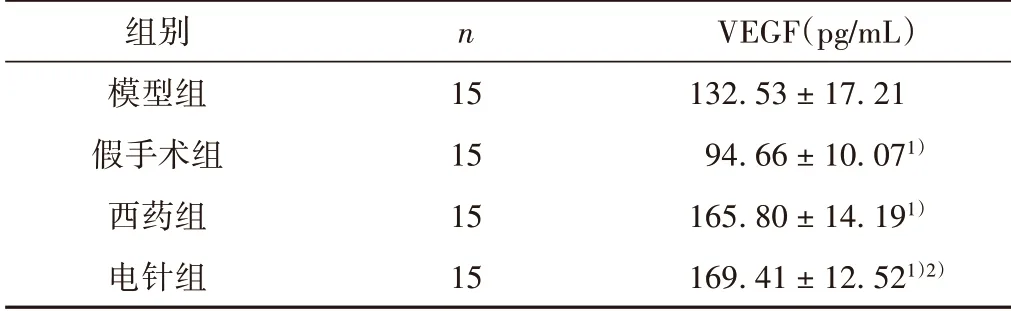
表4 各组大鼠血清中VEGF的含量比较(±s)
注:与模型组比较,1)P <0.05;与西药组比较,2)P >0.05。
组别模型组假手术组西药组电针组n 15 15 15 15 VEGF(pg/mL)132.53±17.21 94.66±10.071)165.80±14.191)169.41±12.521)2)
2.3 各组大鼠海马回CA1 区锥体细胞结构和凋亡细胞情况
锥体细胞结构情况:假手术组可见这一结构致密;模型组可见这一结构模糊,细胞核深染,结构变得残缺;西药组其结构排列比模型组稍许紧;电针组可见其结构排列比模型组明显致密。细胞凋亡情况:假手术组可见少量凋亡细胞;模型组可见大量凋亡细胞;西药组和电针组可见凋亡细胞,相较于模型组而言,其数量相对较少,但高于假手术组。详见图1。
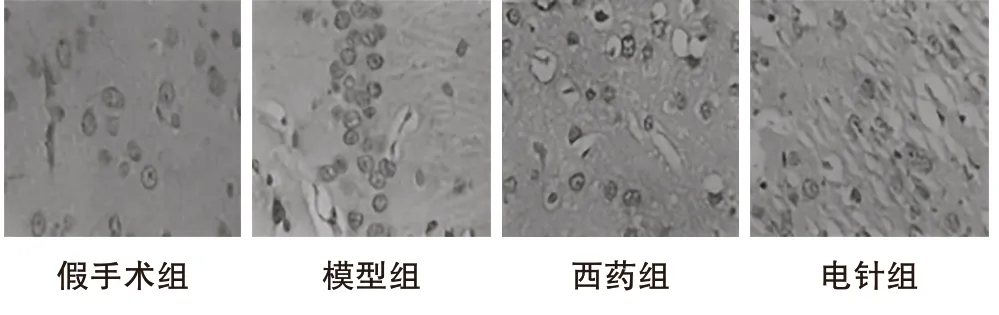
图1 大鼠海马回CA1区细胞凋亡情况(TUNEL,×400)
3 讨论
VD 在中医学中可归属“痴证”或者“呆病”范畴,病位在脑,脑为髓海,脑失所养,髓海不足,就会引发痴证的发生。引起脑失所养的病因有很多,比如老年肾精亏少,脏腑功能低下,髓海不足等[7]。VD 主要是因为瘀血阻滞脑窍,使气血运行不畅,脑窍无气血滋养而发病。和早期老年性痴呆不同,VD 在早期是可以通过积极治疗得到控制和改善的。临床常口服美金刚、安理申等,这两种药物所代表的两大类药物其实都是治疗阿尔茨海默病的代表药物,还有神经营养剂(脑复康)和抗精神病类药物,这些对于血管性痴呆来说也有一定作用,但不明显,而且长期服用,会产生不良反应[8]。中医学对VD 的早期治疗效果明显[9]。
VD 发病究其根本原因和过程其实就是发生脑血管疾病之后,因为脑组织缺血或者出血原因使脑血管破裂或脑血管堵塞,血液循环障碍,最终导致相应神经元受到破坏(尤其是海马,其主要功能就是记忆,而且对缺血、缺氧十分灵敏),最终导致神经细胞凋亡的过程。当脑组织一开始受到损伤时,其中心出血或者缺血区域的神经细胞会发生变性或者凋亡,但周围远离中心区域的部位神经细胞要经过1~2 d 后才出现退化,然后慢慢凋亡。这种逐渐自我凋亡过程是具有潜伏性的,而海马CA1 区对这种逐渐自我凋亡过程的病理变化最为突出和明显,尤其是海马CA1 区的椎体细胞。当脑血管疾病急性发作时,这种细胞凋亡程度会有高峰期,一般是1~5 d 内,但是这种持续细胞凋亡的状态会持续1 个月[10]。近年来研究表明,积极促进侧支循环的建立,这就让血液在新的通路得以通畅循环,使脑组织损伤得以控制和缓解,在很大程度上对脑神经细胞起到了积极有效的保护作用[11]。
有关头穴丛刺这一理论主要来源于于致顺教授临床和理论知识的总结[12]。该理论大致内容是在对头部进行针刺时,其针刺局部会产生一种“场”,这种“场”有着直接的渗透作用,可以作用于大脑皮层和脑组织(不同脑区域对应不同疾病),达到缓解相对应症状的作用[13]。本实验研究的是VD 大鼠学习记忆能力,而根据头穴丛刺这一理论,其需要针刺的部位即是前额区域,在这一区域针刺可以缓解记忆和情感障碍的症状,因此笔者选取的腧穴是额区的前庭等穴位。对于头穴丛刺治疗VD 的文献已经很多,但是在头穴丛刺基础上加用电针的方法,这一研究文献相对较少,而且电针2 Hz 疏密波在兴奋这一方面具有很大优势,具有促进血液循环,消除炎性水肿等特点[14]。有研究表明,在脑组织受到损伤时,运用电针治疗,可以让已经受损的神经传导通路再次得到建立[15]。
VEGF 又称血管通透因子,当脑组织出现血液循环障碍进而神经细胞发生凋亡时,因其可以促进血管再生,形成侧支循环,并且有着非常高的生物活性,这就使得血液循环得以维序,血液循环的通畅与否关系着神经细胞的生存环境,因此VEGF 对神经细胞有着保护作用,并且它还有着极高的特殊性[16]。有研究发现,当脑缺血时,其中心缺血区域VEGF 含量在第1 天或者第2 天会达到最高峰,有血管结构从周围缺血部位向中心缺血部位延伸,7 d 后中心缺血区域VEGF 含量逐渐降低,但周围缺血区域VEGF 含量增加,因此,当脑缺血时,如何采取治疗措施,促进中心缺血区域VEGF 含量增加或者不持续降低以及让周围缺血区域VEGF 含量保持增加不降低,是目前面临的巨大问题[17]。本实验表明,假手术组在血清VEGF 的含量方面明显低于模型组,电针组(2 Hz 疏密波电针额区)和西药组(脑复康)的血清VEGF 含量明显高于模型组,这就说明VEGF 在VD 发病时,其含量会增加,促进血管再生进行自我修复,但是如果不进行有效早期积极治疗,其增加的量相对较低,自我修复的速度会相对缓慢。在水迷宫实验和海马回CA1 区细胞凋亡方面,不管是电针组(电针额区),还是西药组(脑复康),又或者是假手术组,都比模型组有优势。电针组(电针额区)与西药组(脑复康)在上述观察指标方面比较无差异,说明在VD 治疗结果上,两者疗效相当。
综上所述,电针额区(2 Hz疏密波电针额区)对VD的作用机制之一可能是通过调节血清VEGF,促进脑血管再生,血液循环障碍情况得以缓解,神经细胞的生存环境得到改善,抑制减缓细胞凋亡,神经传导通路建立,最终改善临床症状。
