基于HPLC指纹图谱的白芍及酒白芍比较分析△
2021-10-09杨艳玲刘彩凤黄嘉怡杨海菊李花花杜守颖白洁
杨艳玲,刘彩凤,黄嘉怡,杨海菊,李花花,杜守颖,白洁
北京中医药大学 中药学院,北京 102488
白芍始载于《神农本草经》,为毛茛科植物芍药Paeonia lactifloraPall.的干燥根,性微寒,味微苦、酸,具有养血调经、敛阴止汗、柔肝止痛、平抑肝阳等功效[1]。现代研究表明,白芍所含的化学成分有单萜类、三萜类、黄酮类、鞣质、多糖等化合物[2],具有抗炎、镇痛、保肝、抗氧化等多种药理作用[3-6]。《中华人民共和国药典》(以下简称《中国药典》)2020 年版白芍项下收载了炒白芍、酒白芍2 种炮制品,炒白芍长于养血敛阴,酒白芍长于缓急止痛、缓和酸寒之性[7]。宋代《扁鹊心书》中首次出现白芍“酒炒”炮制[8],一直沿用至今。与炒白芍相比,酒白芍的炮制工艺有更多的影响因素,如黄酒用量、浸润时间等。《中国药典》2020 年版规定,白芍酒炒时每100 kg 饮片的黄酒用量为10~20 kg,但并未规定具体的工艺参数,如温度、时间等。酒白芍炮制工艺的常用评价指标为芍药苷含量,但不同研究者筛选出的最佳炮制条件不完全相同[9-10]。酒炒会使芍药苷含量降低,也会使其他成分如多糖、苯甲酸等的含量发生变化,从而影响白芍的药效[11-12]。只以芍药苷作为指标性成分往往过于单一,难以反映中药整体成分群的变化。因此,对酒白芍整体质量进行评价,比较酒炒前后的变化,有利于酒白芍的质量控制及炮制工艺的研究。
指纹图谱具有整体性、模糊性的特点,中药成分复杂,采用指纹图谱技术可以充分反映中药中化学成分的整体状况,适合中药整体质量控制,同时结合指标性成分含量测定和出膏率,有利于从多指标角度比较生品与炮制品的区别[13-14]。白芍药材主要为栽培品,主产于安徽亳州、四川中江、浙江磐安和山东菏泽[15-16]。为了比较白芍酒炒前后的变化,且考虑到白芍多以水煎液入药,本实验选择安徽亳州、四川中江、浙江磐安3 个主产地的白芍样品,建立了白芍及炮制得到的酒白芍水煎液的指纹图谱,对其进行相似度评价。芍药苷是白芍中的主要活性成分,所以同时选择芍药苷含量作为评价指标,结合炮制前后出膏率变化,对其进行系统的质量研究。
1 材料
1.1 仪器
U3000型高效液相色谱仪(DAD检测器、CM 7.2色谱工作站,赛默飞世尔科技中国有限公司);QE-200 型高速万能粉碎机(浙江屹立工贸有限公司);BSA 224S型电子分析天平、BT 125D型电子分析天平(赛多利斯科学仪器北京有限公司);JM-B10002型电子天平(余姚市及纪铭称重校验设备有限公司);HH-6型电热恒温水浴锅(北京科伟永兴仪器有限公司);SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司);DZF-6051型真空干燥器(北京利康达圣科技有限公司)。
1.2 试药
对照品芍药苷(批号:110736-201842,纯度:97.4%,中国食品药品检定研究院);水为娃哈哈纯净水(杭州娃哈哈集团有限公司);甲醇、乙腈、磷酸为色谱纯(美国Thermo Fisher Scientific公司)。
白芍及酒白芍均由亿帆医药股份有限公司提供,经北京中医药大学中药学院刘春生教授鉴定为毛茛科植物芍药Paeonia lactifloraPall.的干燥根及炮制品,详细信息见表1。

表1 白芍及酒白芍来源
2 方法与结果
2.1 酒白芍的制备
依据《中国药典》2020 年版标准,取白芍样品,加黄酒拌匀,闷透,置炒制容器内,用文火炒至规定的程度时,取出,放凉[1]。每100 kg白芍用黄酒15 kg,文火炒至微黄色。
2.2 对照品溶液的制备
精密称取芍药苷对照品11.14 mg,置于25 mL量瓶中,加甲醇制成质量浓度为445.60 μg·mL-1的对照品母液。
2.3 供试品溶液的制备
精密称取白芍(或酒白芍)3.0 g 于500 mL 的圆底烧瓶中,加水200 mL,100 ℃加热回流65 min,用2 层300 目尼龙纱布滤过后放冷,滴加去离子水调整体积至200 mL,取滤液10 mL 离心10 min(10 000 r·min-1,离心半径为5.79 cm),过0.45 μm滤膜,即得。
2.4 HPLC指纹图谱的建立
2.4.1 色谱条件 色谱柱:InertSustainSwiftTMC18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.1%磷酸溶液(B),梯度洗脱(0~5 min,3%A;5~25 min,3%~9%A;25~40 min,9%~11%A;40~55 min,11%~12%A;55~70 min,12%~18%A;70~90 min,18%~34%A;90~100 min,34%~47%A;100~115 min,47%~95%A);检测波长:230 nm;柱温:30 ℃;流速:1.0 mL·min-1;进样量:15 μL。
2.4.2 指纹图谱处理方法 将数据以cdf.的格式导入国家药典委员会“中药色谱指纹图谱相似度评价系统”(2012 版)软件,对前8 min 的色谱峰进行剪切,采用中位数法,时间窗宽度为0.1 min,进行全谱峰匹配,计算相似度。
2.4.3 精密度试验 按照2.3 项下方法制备供试品溶液1 份(B15),按照2.4.1 项下色谱条件,连续进样6 次进行测定,图谱按照2.4.2 项下方法处理。结果显示,白芍与酒白芍的相似度均为1.000,剔除芍药苷色谱峰的影响后,白芍与酒白芍的相似度均为1.000。以芍药苷为参照,各共有峰的相对保留时间RSD 均小于0.07%,相对峰面积RSD 均小于2.52%,说明仪器精密度良好。
2.4.4 重复性试验 按照2.3 项下方法制备供试品溶液6 份(B15),分别测定,图谱按照2.4.2 项下方法处理。结果显示,白芍相似度均大于0.999,酒白芍相似度均大于0.995,剔除芍药苷色谱峰的影响后,白芍相似度均大于0.995,酒白芍相似度均大于0.964。以芍药苷为参照,各共有峰的相对保留时间RSD 均小于0.06%,相对峰面积RSD 均小于3.78%,说明该方法重复性良好。
2.4.5 稳定性试验 按照2.3 项下方法制备供试品溶液1 份(B1),分别在0、2、4、8、12、24 h 测定,图谱按照2.4.2 项下方法处理。结果显示,白芍与酒白芍相似度均大于0.999,剔除芍药苷色谱峰的影响后,白芍相似度均大于0.996,酒白芍相似度均大于0.999。以芍药苷为参照,各共有峰的相对保留时间RSD 均小于0.06%,相对峰面积RSD均小于2.81%,说明样品在24 h内保持稳定。2
.5 指纹图谱相似度分析
2.5.1 指纹图谱的采集和共有模式的建立 将15批白芍药材及酒白芍的数据按照2.4.2 项下方法进行处理,系统根据多批次样品色谱图的共有模式生成对照图谱R,经标定有8 个共有峰,结果见图1~2,其中8 号色谱峰为芍药苷。由于芍药苷色谱峰峰面积过大,而其他峰峰面积均较小,为了避免芍药苷贡献率太高,掩盖峰面积较小的峰的差异而导致分析结果的误差,因此相似度评价中剔除了芍药苷色谱峰的影响。为方便下文数据分析及表达,将芍药苷色谱峰编号为8,其余峰按照从左至右顺序进行编号。

图1 白芍药材HPLC指纹图谱

图2 酒白芍HPLC指纹图谱
2.5.2 白芍和酒白芍相似度评价 利用“中药色谱指纹图谱相似度评价系统”(2012版)软件分别生成白芍药材和酒白芍对照图谱,比较各样品与相应对照图谱的相似度,结果见表2,各批次白芍药材与其对照图谱之间相似度为0.988~0.999,各批次酒白芍与其对照图谱之间相似度为0.991~0.999。剔除芍药苷色谱峰的影响后再次计算相似度,结果见表3。各批次白芍药材与其对照图谱之间相似度为0.915~0.995,各批次酒白芍与其对照图谱之间相似度为0.951~0.998,相似度均大于0.9,说明整体上相似性良好。

表2 白芍及酒白芍指纹图谱相似度

表3 白芍及酒白芍指纹图谱相似度(剔除芍药苷后)
2.5.3 白芍与酒白芍HPLC 指纹图谱比较 通过指纹图谱相似度软件评价白芍和酒白芍,两者之间色谱峰相似度较高,区别较小,对照图谱比较相似度达0.999,见图3,表明酒炒对于整个峰群影响较小。因为芍药苷的出峰时间适中,峰面积较大且稳定,因此以芍药苷为参照峰,计算相对峰面积,结果见表4。通过8个共有峰相对峰面积比较可知,炮制后6号峰较生品有所下降,7号峰基本不变,其余的峰相对峰面积均有不同程度的增加。
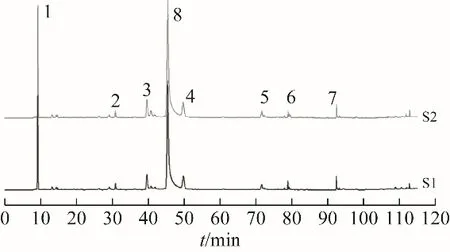
图3 白芍及酒白芍HPLC对照图谱比较
表4 白芍和酒白芍共有峰峰面积分析(,n=15)
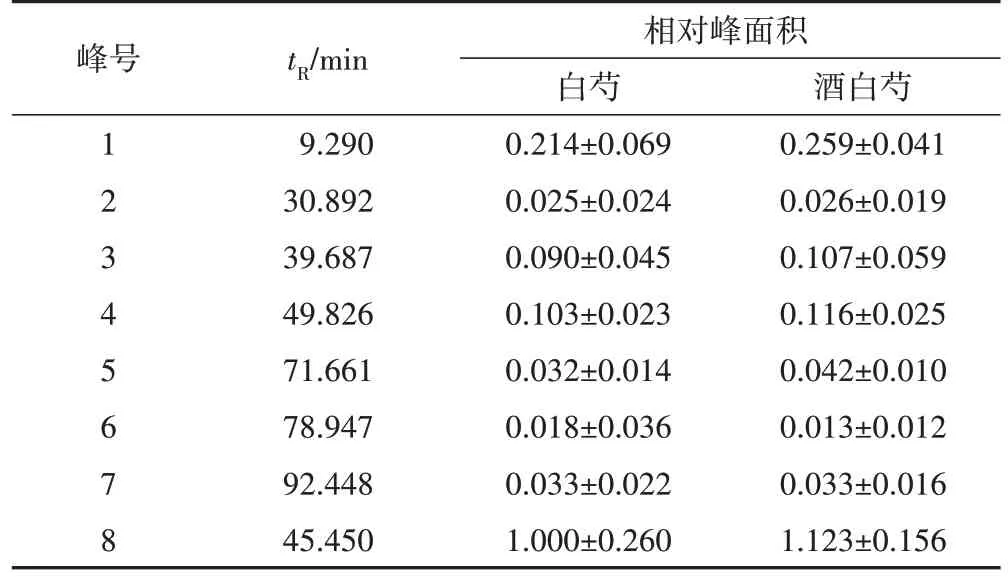
表4 白芍和酒白芍共有峰峰面积分析(,n=15)
注:以白芍中芍药苷峰面积为1计算。
2.6 指标性成分定量分析
取白芍和对应的酒白芍,按照《中国药典》2020 年版一部[1]中白芍项下芍药苷的含量测定方法制样,并进行测定,计算炮制前后芍药苷的含量变化,结果见表5。由表5可知,白芍中芍药苷质量分数为2.20%~5.28%,平均质量分数为3.23%;酒白芍中芍药苷质量分数为2.52%~3.21%,平均质量分数为2.94%。含量变化平均值为-0.29%,说明酒炒会影响芍药苷的含量。

表5 白芍及酒白芍中芍药苷质量分数及变化 %
2.7 水提液出膏率分析
按照2.3 项下方法分别制备白芍炮制前后的供试品溶液,置于已恒重的蒸发皿中,水浴蒸干,60 ℃真空干燥箱中干燥3 d,取出冷却后准确称取质量,按照公式(1)和(2)分别计算出膏率和出膏率变化幅度,结果见表6。

由表6 可见,不同批次样品之间出膏率差别较大,15批白芍药材的平均出膏率为19.73%,整体出膏率为13.53%~24.50%,其中B13 出膏率最高,B15 出膏率最低;炮制后15 批酒白芍的平均出膏率为20.98%,整体出膏率为15.89%~26.82%,其中J8出膏率最高,J3出膏率最低。

表6 白芍及酒白芍出膏率及变化幅度 %
比较白芍炮制前后出膏率的变化可知,第1、11、13、14 批样品炮制后出膏率下降,且第11、13批下降较明显;其余批次均有不同程度的升高,其中第8、15 批样品出膏率升高幅度较大。出膏率变化幅度为-18.57%~36.38%,剔除第1、11、13、14批的异常值后平均变化幅度为2.45%。
3 讨论
3.1 流动相体系及检测波长的选取
本实验分别考察了甲醇-水、甲醇-0.1%磷酸、乙腈-水、乙腈-0.1%磷酸的流动相体系,由出峰数、柱压及指纹图谱整体的分离度,最终选择乙腈-0.1%磷酸水作为流动相;选择210~300 nm 的波长对供试品溶液进行扫描,发现在230 nm 条件下,基线相对平稳,响应值高,峰数量较多,分离度较好,因此选取230 nm作为检测波长。
3.2 白芍及酒白芍质量评价
本实验通过建立白芍酒炒前后的HPLC 指纹图谱,进行相似度评价,发现白芍与酒白芍之间相似度较高;含量测定结果表明,白芍酒炒前后指标性成分芍药苷质量分数变化为-2.13%~0.49%,整体呈下降趋势。白芍酒炒后出膏率整体呈上升趋势,第1、11、13、14 批炮制后出膏率反而降低,原因可能为不同产地及批次白芍之间本身存在质量差异,以及药材净制过程中去细根、去皮操作不完全一致等。这也提示在白芍的生产加工过程中应注意规范化,以保证药材质量。
3.3 白芍炮制前后的成分变化
从整体上分析,白芍炮制前后对芍药苷含量影响较大,由指纹图谱相对峰面积结果可知,峰1 炮制后相对峰面积有不同程度的升高,可能原因为酒润、炒制过程中增加了该成分的溶出[17];峰6炮制后相对峰面积有所下降,可能原因为炒制及煎煮过程中该成分受到破坏,及转化为其他成分等[18]。白芍的主要成分为芍药苷、芍药内酯苷、苯甲酰芍药苷等,本实验结果中,白芍酒炒后芍药苷的含量大部分降低,少数升高。芍药苷的含量有很多影响因素,如炮制温度、储存方式等。刘亮镜等[17]研究表明,白芍酒炒之后芍药苷含量略有升高,原因可能为乙醇促进了芍药苷的溶出。但大部分研究者发现,白芍酒炒会降低芍药苷、苯甲酸的含量,增加芍药内酯苷、苯甲酰芍药苷的含量[19-20]。芍药苷在炮制过程中可能会转化为芍药内酯苷和苯甲酰芍药苷,芍药苷受热不稳定,炒制过程中易被破坏;而苯甲酸是白芍中的有害成分,炮制后含量减少,因此筛选最佳炮制工艺,有利于提高白芍质量[21-22]。
本研究建立的方法稳定可行,可以系统地对白芍酒炒前后整体成分群的相似性和差异性进行比较,同时成分的变化也是炮制前后药理作用研究的基础,也可为其他药材炮制的研究提供参考。
