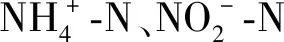一株新型异养硝化-好氧反硝化菌GJWA3的脱氮性能及定量检测*
2021-10-09苏兆鹏潘鲁青何子岩刘丽平张梦宇
苏兆鹏,李 赟,潘鲁青,何子岩,刘丽平,窦 乐,张梦宇
(海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003)
在脱氮菌株的研究应用中,外来菌株由于难以与原生菌株竞争而存在无法在目标环境中定殖、存活或成为微生物群落中的优势种的问题[10]。此外,对脱氮菌株实际表现的评估需要结合它们在环境中的实际丰度来进行。因此,建立一种定量方法来检测脱氮菌株在实际环境中的实时丰度,对于综合评价脱氮菌株的应用潜力具有重要意义。目前细菌的定量方法主要有实时荧光定量PCR (Quantitative Real-time PCR,qPCR)[11]和酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA)。ELISA是一种基于特异性抗原-抗体结合的免疫学检测方法,抗体的类型可以分为单克隆抗体和多克隆抗体。多克隆抗体制备简便、稳定性强、灵敏度高,已广泛应用于细菌的检测和定量中[12-13]。
本研究从对虾海水养殖水体中分离出一株HN-AD菌GJWA3。通过不同氮源条件下的氮平衡分析和环境因子实验研究了其脱氮特性,同时采用间接ELISA方法测定了该菌株在实际海水养殖水体和养殖废水中的应用潜力,并对该菌株的生物安全性进行了评估。以期对该菌株的实际应用提供理论依据。
1 材料方法
1.1 培养基配方

1.2 菌株分离及鉴定
水样取自广东江门对虾养殖池,将5 mL水样加入含有95 mL 富集培养基的250 mL锥形瓶中,于28 ℃、160 r/min条件下培养。每天补充新鲜培养基,富集72 h后,将100 μL的菌悬液涂在筛选培养基平板上,28 ℃好氧培养48 h后通过反复划线得到若干纯化菌株,并对其硝化-反硝化性能进行测定。选择硝化-反硝化能力最强的菌株GJWA3,保藏于实验室并进行进一步实验。采用通用引物27F/1492R[14]扩增菌株GJWA3的16S rDNA基因。PCR产物由生工生物技术公司(中国上海)测序。系统发育树使用软件MEGA7中的neighbor-joining方法构建。并对菌株GJWA3的形态、生理生化特性进行观察分析。
1.3 菌株GJWA3氮去除能力分析

1.4 环境因素对菌株GJWA3硝化-反硝化能力的影响

1.5 菌株GJWA3定量方法的建立与应用
1.5.1 抗原与抗体的制备 将在2216E液体培养基中培养24 h的菌液离心收集菌体,用0.01 mol/L磷酸缓冲液(PBS)洗涤3次后加入甲醛溶液灭活。灭活后再用PBS洗涤3次并调节菌浓度为1 × 109CFU/mL,作为抗原备用。按照苏真真等[13]的方法将抗原注射到新西兰大白兔体内获得具有特异性抗体的血清,注射等量的生理盐水获得阴性对照血清。采用间接ELISA的方法测定血清效价,所用试剂购于北京翰谱医药生物研究所。血清效价以P/N值作为评价指标,P/N ={OD450(兔抗血清)-OD450(空白)}/{OD450(阴性对照)-OD450(空白)},P/N ≥ 2.1代表样品为阳性。获得兔抗血清后,保存于-20 ℃备用。
1.5.2 标准曲线的建立 采用棋盘法[13]对反应过程中的兔抗血清稀释倍数、二抗体稀释倍数和抗原-抗体反应时间进行优化。用PBS将菌悬液稀释至1×108、1×107、1×106、1×105、1×104和1×103CFU/mL。然后采用优化后的间接ELISA法测定相应的OD450并绘制标准曲线。

1.6 菌株GJWA3的安全性评价
将菌株GJWA3接种于含5%羊血的琼脂平板上(青岛希望生物科技有限公司),37 ℃孵育48 h,观察测定其溶血活性。
从山东烟台对虾养殖厂购买凡纳滨对虾,并在实验室进行暂养。一周后将大小均匀的健康对虾随机放入9个水箱(40 L)中,每箱20只,记录每箱中对虾的初始质量。9个水箱随机分为3组(对照组、EG5和EG6),并加入GJWA3菌悬液,使实验组EG5和EG6中的水体菌浓度分别为1×105、1×106CFU/mL,对照组添加等量PBS。实验过程中,每天喂虾3次,每天换水,换水后加入菌悬液补充至相应的菌浓度。饲养14 d后,测定剩余虾的存活数量和质量,根据公式:存活率=最终对虾存活数量/20×100%,增重率=(终末质量-初始质量)/初始质量× 100%,计算存活率和增重率。并通过测定剩余对虾的血细胞总数、血浆的抗菌活性和吞噬活性[6],评价对虾的免疫能力。
1.7 测定方法及数据处理

2 结果
2.1 菌株GJWA3的鉴定
分离菌株GJWA3在2216E琼脂平板上形成的菌落呈圆形,白色,不透明,边缘规则,表面光滑。显色反应表明该菌株为革兰氏阴性。扩增菌株GJWA3的16S rRNA基因序列大小为1 432 bp,BLAST结果表明,菌株GJWA3与Halomonasmeridianastrain SCSIO 43005(GenBank:CP024621.1)的相似度为97.94%,在GenBank挑选与分离菌株相似的10株菌的16S rRNA基因序列构建系统发育树(见图1),结果证明,菌株GJWA3为盐单胞菌。对菌株GJWA3的生理生化鉴定结果显示接触酶、产氨酶、硝酸盐还原酶试验表现阳性,甲基红、V-P、淀粉水解、吲哚、明胶液化试验表现阴性,葡萄糖氧化发酵试验表现为发酵型。

(遗传距离为0.010 0。0.010 0 denotes the genetic distance.)图1 菌株GJWA3与参考菌株的16S rRNA基因序列构建的系统进化Fig.1 Phylogenetic tree constructed from 16S rRNA gene sequences of strain GJWA3 and comparative reference strains
2.2 菌株GJWA3的异养硝化-好氧反硝化特性分析


图2 菌株GJWA3在不同氮源下的脱氮表现和生长情况Fig.2 Nitrogen removal performance and cell growth of strain GJWA3 under different nitrogen sources


表1 菌株GJWA3在不同氮源下的氮平衡Table 1 Nitrogen balance of strain GJWA3 under different nitrogen sources
2.3 单一环境因素对菌株GJWA3的去除能力的影响

图3 不同因素对菌株GJWA3的去除能力影响Fig.3 Effects of different factors on removal ability of strain GJWA3
2.4 间接ELISA菌株定量方法的建立与应用
2.4.1 间接ELISA定量方法的建立 菌株GJWA3免疫兔抗血清的效价见表2。P/N值在稀释比例为1∶32 000时大于2.1,在稀释比例为1∶64 000时小于2.1。因此,兔抗血清的效价为1∶32 000,满足间接ELISA定量检测的要求。ELISA的最佳条件为抗血清稀释1∶1 000,抗原抗体反应30 min,二抗稀释1∶3 000。在上述条件下,菌株GJWA3的菌浓度与OD450之间存在很强的相关性(R2=0.957 2)。间接ELISA对菌株GJWA3的检测范围为1×104~1×108CFU/mL (见图4)。

表2 菌株GJWA3对应的抗体效价Table 2 Antibody titer corresponding to strain GJWA3

图4 间接ELISA法测定菌株GJWA3浓度标准曲线Fig.4 The standard curve of GJWA3 concentration was determined by indirect ELISA


图5 菌株GJWA3接种到实际海水养殖水(a)和养殖废水(b)中的氮浓度、菌株浓度(BC)变化Fig.5 Changes of nitrogen concentration and bacterial concentration (BC)of strain GJWA3 inoculated into actual mariculture water (a)and aquaculture wastewater (b)
2.5 菌株GJWA3的安全性评估
在血平板上未发现溶血圈,证明菌株GJWA3不具有溶血活性(见图6)。在凡纳滨对虾实际养殖实验中,经过14 d的养殖,添加菌液的实验组(EG5、EG6)对虾存活率均略高于对照组(见表3),但并无统计学显著差异。此外,对虾的增重率无显著差异,对虾的血细胞总数、抗菌活性和血浆吞噬率指标三组间也无明显差异。综合结果表明,菌株GJWA3对凡纳滨对虾具有较高的生物安全性。

图6 菌株GJWA3的溶血活性Fig.6 Hemolysis activity of strain GJWA3

表3 菌株GJWA3对凡纳滨对虾生长、存活和部分免疫指标的影响Table 3 Effects of strain GJWA3 on the growth,survival and some immune indexes of Penaeus vannamei
3 讨论
3.1 菌株的分离与脱氮特性
3.2 不同环境条件下菌株GJWA3的去除特性

3.3 菌株定量方法的建立与应用
间接ELISA检测技术已广泛应用于水产养殖中的致病菌的检测和定量,Anand等[30]利用间接ELISA技术建立了副溶血弧菌的检测方法,并证明具有很高的特异性;祝璟琳等[31]利用间接ELISA技术建立无乳链球菌的检测方法,并对感染无乳链球菌死亡的罗非鱼脑组织进行检测,阳性率为100%。本研究采用间接ELISA建立了HN-AD菌GJWA3的定量检测方法。菌株丰度和OD450值的相关性与标准曲线高度一致,R2=0.957 2,精度高于V.alginolyticus的ELISA标准曲线[13]。定量范围为1×104~1×108CFU/mL,大于Campylobacterjejuni[32]的检测范围,具有较强的实际应用价值。
除了在无菌合成培养基中具有出色的氮去除能力,更重要的是在实际养殖水环境中进行高效的氮去除,因为具有复杂离子成分和菌群结构的实际养殖水对添加菌株的生存和氮去除具有巨大挑战[10]。在海水实际养殖水和实际养殖废水中,菌株GJWA3对总氮的去除率分别为49.01%、62.48%,与其他HN-AD菌的去除率相似[33]。此外,利用间接ELISA定量方法检测到菌株在养殖实际水体和废水中的丰度保持在1×106CFU/mL,略高于已报道的虾养殖池中异养菌丰度(1.5×104~8.1×105CFU/mL)[34],一方面表示建立的间接ELISA定量方法在其他菌落存在的情况下仍能对菌株GJWA3进行准确定量;另一方面表现菌株GJWA3对于海水养殖环境具有较强的适应能力,后期菌株丰度的降低可能是由于水和废水中能量物质的缺乏造成的。本研究的结果显示,盐单胞菌GJWA3能够有效去除海水养殖水和养殖废水中的氮,间接ELISA定量方法验证了该菌株可以在海水养殖水和废水中定植并保持较高的丰度,并为以后菌株GJWA3实际应用的检测提供了切实可行的方法。
3.4 菌株GJWA3的安全性评价
菌株GJWA3具有良好的脱氮能力,可作为一种潜在的益生菌应用于水产养殖。然而,在实际应用之前评估潜在益生菌的安全性是至关重要的一步[35]。Yun等为了评价益生菌对凡纳滨对虾的安全性[36],将细菌浓度调整为1×105CFU/mL,有研究将细菌浓度调整为1×105和1×108CFU/mL[6]。本研究所用细菌浓度分别为1×105和1×106CFU/mL,结果显示,对凡纳滨对虾的生长、存活和部分免疫参数均无显著影响。此外,有报道称多种细菌都能产生能够引起细胞膜损伤、细胞裂解等毒性作用的溶血素[37],检测菌株是否产生溶血素已成为评价菌株安全性的重要标准。菌株GJWA3在血平板上无溶血反应,与Pseudomonassp.ABSK55[38]相似。因此,菌株GJWA3可以安全地用于养殖水体中的脱氮。
4 结语