高山松miR482a的鉴定及其表达分析
2021-10-09王稳利曾倩倩邱宗波
王稳利,曾倩倩,刘 岩,邱宗波
(河南师范大学生命科学学院/河南省农业微生物生态与技术国际联合实验室,河南 新乡 453007)
MicroRNA(miRNA)是一类由21~24个核苷酸组成的内源性单链非编码小分子RNA,主要是在转录和转录后水平指导靶miRNA的剪切或抑制翻译来调控基因的表达[1],作为近年来一直研究的热点调控分子,miRNAs在调控高山松(Pinusdensata)的生长发育[2]、落叶松的体胚发育[3]以及生物和非生物胁迫应答过程中起着重要的作用[4]。
miR482作为植物体内一类重要的miRNA,近年来一直受到研究者们的广泛关注。利用生物信息学技术,张玉娟等[5]从棉花中鉴定出miR395a、miR396a、miR397a、miR399a、miR414a、miR482b、miR7485等64个与棉花黄萎病抗性相关的miRNA,并对获得的miRNA进行靶基因预测和功能分析。过表达马铃薯miR482e能够增强植物对黄萎病菌的敏感性[6]。Zuo等[7]研究发现miR482在番茄果实成熟软化过程中显示出不同的表达模式。利用高通量测序技术,Li等[8]从豌豆中鉴定出miR482,并发现miR482能够明显增加豌豆结荚数目。尽管miR482在多个植物中已有较为深入的研究,但目前在裸子植物高山松中,miR482的鉴定及其在高山松生长发育过程中的功能尚不清楚。
高山松是一种具有重要生态意义的针叶树裸子植物[9]。本研究从课题组前期高山松小RNA高通量测序结果中获得miR482a,并利用PCR技术进行miR482a前体序列的克隆与分析。通过在线预测网站获得miR482a的靶基因,并利用RLM-5′RACE进行验证。同时还对miR482a及其靶基因在高山松根、茎和针叶中的表达模式进行了分析,为进一步揭示miR482a在高山松生长发育中的作用提供一定的理论依据。
1 材料与方法
1.1 材料
高山松幼苗于2020年9月在人工气候室中进行培养,培养条件为昼/夜温度25℃/18℃,光周期16 h/8 h,相对湿度65%~70%。
1.2 方法
1.2.1 高山松miR482a前体序列的克隆及其二级结构预测 使用植物总RNA提取试剂盒RNAiso Plus Reagent(TaKaRa,大连)从高山松幼苗中提取高质量RNA。从课题组前期高山松miRNA高通量测序结果中得到高山松miR482a的前体序列:UGAGAAGU GAAGGGAUGUGUUUUGUGGAUGGGAGUCUUGAG GAGUGGGAGCAUAGGAUAAGGCUGCUUCAUAUC ACCAGUCUUUCCUACUCCUCCCAUUCCUAUUGCC UUCACCACACAUCCCUUCCCAA。用Primer 5.0软件设计特异性引物进行PCR扩增(表1)。利用Clustalx 2.0软件,将高山松pde-miR482a的成熟序列与玉米zma-miR482a、大豆gma-miR482a、火炬松pta-miR482a、毛果杨ptc-miR482a、欧洲云杉pabmiR482、葡萄vvi-miR482以及人参pgi-miR482的成熟序列进行序列比对。并利用MEGA 7.0软件构建miR482a前体与其他物种miR482前体的系统进化树。采用RNAfold web server在线软件预测miR482a前体序列的二级结构。
1.2.2 高山松miR482a靶基因的预测与切割位点验证 高山松miR482a的成熟序列利用在线预测网站psRNATarget(http://plantgrn.noble.org/psRNATarget/)进行靶基因的预测。在高山松的转录组数据库中进行miR482a靶基因的预测,设置罚分小于3,其余参数为默认。依据靶基因的cDNA序列用Primer 5.0软件设计用于RLM-5′RACE的引物(表1)。RLM-5′RACE试验参照孔雷等[10]的方法,将扩增出的特异产物进行克隆测序。
1.2.3 实时荧光定量PCR 使用RNAiso Plus Reagent(TaKaRa,大连)分别提取高山松幼苗根、茎和针叶的总RNA。利用SuperscriptⅡreverse transcriptase(Invitrogen)进行反转录反应。荧光定量试验使用SYBR Premix Ex TaqTMⅡ试剂盒(TaKaRa,大连)。高山松Actin作为miR482a和靶基因Unigenes45569的内参基因。利用Rotor-Gene 3000型实时PCR扩增仪检测,每个样品3次生物学重复。基因的相对表达量采用2-ΔΔCt法[11],在根中的表达水平人为设成1。
2 结果与分析
2.1 pde-miR482a前体序列的扩增及二级结构的预测
从前期高山松miRNA高通量测序数据中筛选得到高山松miR482a的前体序列,进行引物设计,以高山松基因组DNA为模板,进行PCR扩增,得到高山松miR482a的前体序列长为130 bp(图1)。利用RNAfolder软件在线分析其二级结构,发现高山松miR482a的前体序列能形成典型的茎环发夹结构(图2),所预测的二级结构的最小折叠自由能(Mini⁃mal folding free energy,MFE)为-60.90 kcal/mol,最小折叠自由能指数(Minimal folding free energy index,MFEI)是0.98。miR482a的 成 熟 序 列 为5′-UCUU UCCUACUCCUCCCAUUC-3′,22 bp,位于前体序列的3′端茎结构上。

表1 RT-PCR、RT-qPCR和RLM-5′RACE的引物
2.2 高山松miR482a成熟序列和前体序列的分析
对miRBase数据库中不同植物的miR482a成熟序列与高山松miR482a(pde-miR482a)的成熟序列进行比对,发现除了葡萄vvi-miR482与pdemiR482a的成熟序列完全一致外,其他物种如欧洲云杉pab-miR482、人参pgi-miR482、火炬松ptamiR482a、毛 果杨ptc-miR482a、玉米zma-miR482a以及大豆gma-miR482a与高山松pde-miR482a的成熟序列有一个或多个碱基的差异(图3),表明高山松pde-miR482a的成熟序列在不同物种中保守性不高。利用MEGA 7.0对毛果杨、玉米、人参、葡萄、火炬松、欧洲云杉、大豆、苜蓿和高山松的miR482共23个成员构建系统发育树。结果显示不同物种的pre-miR482前体保守性不高(图4),高山松与欧洲云杉的前体序列聚为一类,二者进化关系较近。
2.3 高山松miR482a靶基因的预测及RLM-5′RACE验证
为了进一步了解高山松pde-miR482a的生物学功能,研究以高山松的转录组数据库作为靶标,使用在线软件psRNATarget预测高山松miR482的靶基因,共预测到2个靶基因,分别为组蛋白去乙酰基酶(Unigenes7264)和NBS-LRR抗 性 蛋 白(Unigenes 45569),其中pde-miR482a与高山松NBS-LRR抗性蛋白(Unigenes45569)匹配程度最高(表2)。
为了进一步验证高山松miR482a对潜在靶基因是否有剪切作用,利用RLM-5′RACE方法对靶基因Unigenes45569mRNA的3′端剪切产物进行扩增。测序结果表明,高山松pde-miR482a对NBS-LRR抗性蛋白的剪切位点位于第10、第11个碱基之间(图5),表明NBS-LRR抗性蛋白(Unigenes45569)确实是miR482a的靶基因,miR482a可以在转录后水平调控NBS-LRR抗性蛋白基因的表达。
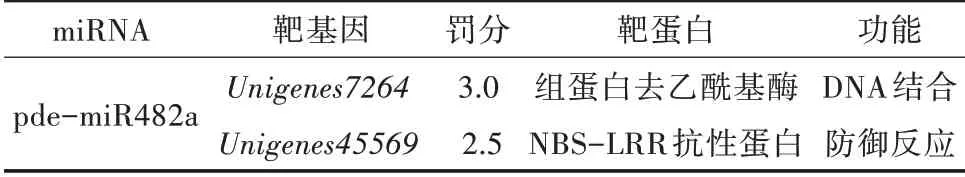
表2 高山松miR482a靶基因及功能预测
2.4 高山松pde-miR482a及其靶基因Unigenes 45569在不同组织中的表达分析
通过qRT-PCR对pde-miR482a及其靶基因Unigenes45569在高山松根、茎和针叶中的表达情况进行分析,发现pde-miR482a和Unigenes45569在高山松不同组织的表达存在显著差异,pde-miR482a在根中的表达量最高,其次在茎中,而靶基因Unige⁃nes45569在根中的表达量最低。靶基因Unige⁃nes45569的表达量与pde-miR482a的表达量呈负相关(图6)。
3 讨论
近年来,高通量测序技术的发展已在多个物种中被证实存在miR482。本研究对鉴定到的miR482前体基因Pre-miR482进行克隆,得到miR482a的前体序列长度为130 bp,可形成稳定的茎环发夹结构,说明miR482a确实在高山松中存在并表达。采用荧光定量PCR技术对高山松pde-miR482a在根、茎和针叶中的表达量进行分析,发现在根、茎和针叶中均有表达,但在根中最高。Li等[8]研究发现miR482在大豆的种子、幼荚、根、茎、叶和花中也均有表达,但在茎中最高。miR482a在番茄的根、茎、叶中均有表达,但在叶中的表达最高[12]。高山松miR482a的靶基因Unigenes45569(NBS-LRR抗性蛋白)在根、茎和针叶中也有一定的表达,但在根中的表达最低,与pde-miR482a的表达模式呈负相关。研究发现大多数miRNA与靶基因之间的表达模式为负相关。过表达和沉默miR482b的番茄植株中,Jiang等[13]发现miR482b和其靶基因表达水平之间存在负相关性。这些研究结果表明,miR482靶向NBS-LRR抗性蛋白(Unigenes45569)可能参与了高山松生长发育的调控。
自从在毛果杨中发现第一个miR482以来[14],研究者已从棉花[15]、马铃薯[6]、番茄[7]和豌豆[8]多个植物中陆续发现了miR482,并且在拟南芥、棉花和烟草等多种植物中证明miR482的靶基因是NBS-LRR基因[15]。而NBS-LRR编码基因是抗病基因中的最大家族,在植物抵御非生物胁迫及病害防御过程中起着非常重要的作用[16]。棉花受黄萎病菌浸染时,miR482的表达下调,但其靶基因NBS-LRR抗性蛋白表达增加[15]。番茄miR482通过靶向NBS-LRR抗性蛋白在番茄病害的防御和发生中起着重要的调控作用[16]。本研究中,利用RLM-5′RACE方法对预测的靶基因Unigenes45569(NBS-LRR抗性蛋白)进行验证。结果显示,高山松miR482介导靶基因Unige⁃nes45569(NBS-LRR抗性蛋白)的mRNA剪切降解,且剪切位点在第10和第11位碱基之间。利用5′RACE方法,Zhu等[15]在棉花中发现NBS-LRR抗性蛋白是miR482的靶基因,切割位点也在第10和11位碱基之间。这些结果表明,miR482通过靶向NBS-LRR抗性蛋白(Unigenes45569),从而调控高山松的生长发育及抗病性。
