基于DNA G-四链体的农兽药残留与重金属离子快速检测研究进展
2021-10-09孙丽萍白琳琳干雅婷陈雪雲张宜明何开雨徐霞红
孙丽萍,白琳琳,干雅婷,陈雪雲,王 柳,张宜明,*,何开雨,*,徐霞红
(1.浙江农林大学 农业与食品科学学院,浙江 杭州 311300; 2.浙江省农业科学院 农产品质量安全与营养研究所,浙江 杭州 310021; 3.福州大学 生物科学与工程学院,福建 福州 350108)
农兽药作为食用农产品生产过程中重要的生产资料,在防治农作物病、虫、草害及畜禽疾病等方面起着十分重要的作用,可显著提高食用农产品产量和质量。然而,农兽药的不合理使用会引发农兽药残留超标、环境污染,以及有害生物的抗药性等问题。此外,工业生产中污染物的排放带来的农田重金属污染,也使食用农产品面临重金属超标风险,影响食用安全。对食用农产品中的农兽药残留及重金属进行分析检测是监控和保证农产品质量安全的有效技术手段。目前,农兽药残留及重金属的检测主要通过大型仪器分析法,农兽药残留检测多使用高效液相色谱法(HPLC)[1-3]、气相色谱法(GC)[4-5]、色谱-质谱联用(GC-MS)[6-8]等,重金属离子的检测除了原子吸收光谱法(AAS)[9]以外,还有原子荧光光度法(AFS)[10]、电感耦合等离子体质谱(ICP-MS)[11]等分析技术。这些方法发展成熟,具有灵敏度高、重现性好等优点,但由于仪器庞大且昂贵,检测试剂耗费大、耗时长,需要专业技术人员操作,只能在实验室内开展,无法实现样品的现场快速检测,尚不能完全满足实际需求。因此,发展快速、准确的检测技术为食用农产品生产和质量安全监控提供技术支撑,仍然非常必要。
随着材料科学与纳米技术的发展,功能核酸传感快速检测法得到了迅速发展。与传统的实验室仪器分析方法相比,功能核酸传感分析速度快、操作简便、成本低廉,尤其可以避免大型仪器所需的实验条件,作为一种定性、定量/半定量的现场快速检测技术可用于大量样品的筛查分析,为农产品中农兽药残留和重金属的快速检测提供了新的途径。DNA G-四链体由富含G碱基的DNA序列形成,是一种非典型的核酸二级结构,具有特殊理化性质,如:与氯高铁血红素(hemin)结合生成具有辣根过氧化物酶活性的核酸模拟酶,可以催化H2O2发生氧化还原反应,或与有机荧光染料(ThT、PPIX、NMM等)结合增强荧光。近年来,国内外研究人员利用功能核酸DNA G-四链体发展了较多针对农兽药残留和重金属离子的快速检测方法。本文对DNA G-四链体在农兽药残留和重金属快速检测传感构建中的应用进行了概述和总结,以期为功能核酸用于食用农产品中风险物质的快速检测研究提供参考。
1 DNA G-四链体的结构和功能
1.1 G-四链体的结构
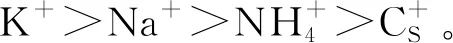
A,G-四分体结构;B,分子内折叠形成G-四链体(反平行结构);C,双分子折叠形成G-四链体(反平行结构);D,四分子折叠形成G-四链体(平行结构)。
根据核苷酸链的走向,G-四链体可分为3类:当4条链的伸展方向相同时,为平行结构;当两条链方向相同,而与剩余两条链方向相反时,为反平行结构;其他情况称为混合平行结构[17-19]。G-四链体的结构可通过紫外吸收光谱和圆二色谱表征[20]。以圆二色谱为例,平行的G四链体核苷键都是反式的,在265 nm处有一个明显的正峰,而在240 nm处出现负峰;反平行G四链体核苷键既有顺式也有反式,在290 nm处出现正峰,在264 nm处出现负峰[20-21]。条件改变时,不同结构的G-四链体可以互相转换,也可以共存。Mohanty等[13]研究发现,22AG人类端粒DNA序列在Tris(三羟甲基氨基甲烷)盐缓冲体系中形成平行G-四链体,而在加入K+后转换成反平行结构。除此之外,G-四链体的结构类型还受温度、离子强度、核酸序列、碱基排布、环区[22]以及与它结合的小分子化合物[13,23]等因素影响。
1.2 G-四链体的功能
1.2.1 G-四链体-hemin过氧化物模拟酶
DNA G-四链体与氯高铁血红素(hemin)结合后形成的复合物(G-四链体-hemin)具有辣根过氧化物酶(horseradish peroxidase)活性,被称为DNA酶或过氧化物模拟酶,能催化H2O2氧化2,2′-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)二铵盐(ABTS)或3,3′,5,5′-四甲基联苯胺(TMB),产生裸眼可见的颜色变化信号[24]。Travascio等[25]筛选得到的PS2.M形成的G-四链体将hemin的催化活性提高了250倍。Guo等[26]筛选得到的G-四链体结构与hemin形成的模拟酶在高温条件下仍能保持很好活性。相比于天然的蛋白质酶,基于G-四链体-hemin的DNA模拟酶具有成本低、稳定性好、易于合成与修饰等优点。目前,提高G-四链体-hemin过氧化物模拟酶活性的方法主要有:(1)通过改变形成G-四链体的核苷酸链序列,从而改变G-四链体拓扑结构以调节过氧化物模拟酶的活性,例如,研究结果表明,平行的G-四链体结构与hemin结合过氧化物酶活性更好[24-25,27-29];(2)通过改变稳定中心金属离子,改变G-四链体的构型从而改变与hemin的结合情况,例如,Ida等[16]发现,与K+稳定的G-四链体-hemin过氧化物模拟酶相比,Tb3+稳定的G-四链体-hemin过氧化物模拟酶具有更高的催化活性;(3)在富G核苷酸链3’末端增加腺嘌呤,通过加速化合物的形成提高活性,增加一个腺嘌呤,就可使其原有活性提高5~20倍[30],但这一增强效应只在平行结构中被观察到,对于反平行结构未观察到增强效应。
1.2.2 G-四链体增强染料分子的荧光
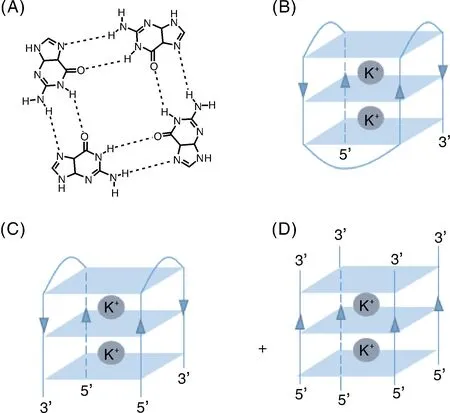
一些有机染料分子(图2)可与G-四链体进行非共价结合,荧光得到极大增强。这些染料通常是核酸嵌入型染料,主要包括碳菁、酞菁、卟啉、咔唑、蒽环类、溴化乙锭和三苯基甲烷的衍生物等。荧光增强的原理为G-四链体与荧光染料分子通过插层、沟槽结合、端部堆积或静电相互作用而结合[31-32],为荧光染料分子提供了一个疏水环境,从而防止荧光分子因相互靠近而导致自淬灭[31]。卟啉(Protoporphyrin IX, PPIX, 图2-A)是血红素前体,已被证明可作为一种G-四链体选择性荧光探针[33],是目前最常用的G-四链体配体,它能结合并稳定不同类型的G-四链体结构。相关研究表明,卟啉与G-四链体结合后,其荧光显著增强[32]。硫磺素T(Thioflavin T, ThT,图2-B)是一种水溶性荧光染料,最近被证明对G-四链体具有高度选择性[34]。在水溶液中,ThT发出非常微弱的荧光信号,但与G-四链体结合后荧光强度可增大2 500倍,在不同的缓冲溶液下,富G序列与ThT会形成不同结构的G-四链体,并产生不同强度的荧光信号[13]。同样地,噻唑橙(Thiazole Orange, TO,图2-C)[35]和N-甲基吗啡啉(N-methylmorpholine, NMM,图2-D)[36]也可与G-四链体结合,荧光获得增强。早期,核酸传感构建中使用的核苷酸链通常经共价键连接荧光/淬灭或者供体/受体。但是,通过共价键将功能基团修饰在核苷酸链上时也存在着一些不足之处,例如,可能会影响核苷酸链的亲和力和选择性,更加耗时,成本也更高[16]。因此,使用G-四链体与荧光染料构建免标记新型功能核酸生物传感器将更有优势。
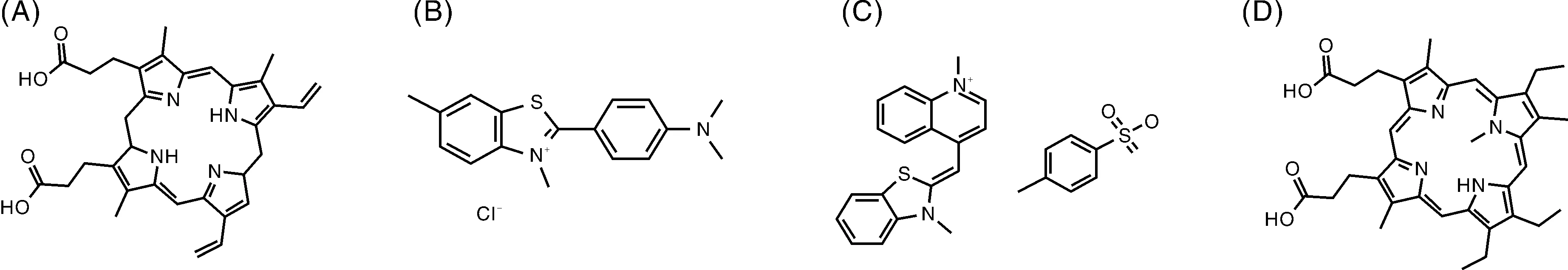
A,卟啉[33];B,硫磺素T[34];C,噻唑橙[35];D,N-甲基吗啡啉[36]。
1.2.3 G-四链体的体内诊断及治疗应用
G-四链体除了具有独特的结构特征外,还具有丰富的生物学功能。通过计算机预测,人类基因组中大约有300 000多个序列可以形成G-四链体,它们位于基因组许多重要的生物学功能区域,如一些重要的原癌基因的启动子区[37],与人类一些疾病具有密切联系。端粒是存在于真核细胞线状染色体末端的一小段DNA-蛋白质复合体,其中DNA是由互补配对的双链DNA,在3′端有一段悬垂的富G序列且在一定条件下能够形成G-四链体。在1990年证实细胞的凋亡是由于染色体末端端粒的缩短[38],在癌细胞中存在一种特殊的端粒酶,可以稳定端粒长度从而使癌细胞永生化,当端粒末端的富G序列形成G-四链体后,能够有效抑制端粒酶的活性,杀死癌细胞。因此,G-四链体可作为癌症诊断的一个潜在检测指标及治疗靶点。
2 利用G-四链体传感快速检测农产品中常见污染物
2.1 基于G-四链体传感快速检测农产品中兽药残留
Chen等[39]通过三螺旋分子开关(triple-helix molecular switch, THMS)和G-四链体开发了无标记荧光平台,发展了一种快速、可视化检测四环素(tetracycline, TC)的新方法(图2-A)。THMS由两条功能核苷酸链通过Watson-Crick氢键和Hoogsteen氢键组装而成,其中一条核苷酸链的中间部分是对四环素具有高度亲和力的适配体序列,其两侧臂端锁定另一条作为信号转导探针(signal transduction probe, STP)的富G碱基核苷酸链。四环素不存在时,THMS保持结构稳定和完整,STP被锁定,无法与ThT结合,荧光信号背景值很低;而当四环素存在时,由于适配体识别并结合四环素,引起THMS的结构被解开,释放出的STP形成G-四链体并与ThT结合,发出强荧光信号,实现了对四环素的荧光响应信号的输出。该方法的检测限低至970.0 pmol·L-1,线性区间为0.2~20 nmol·L-1。Qiu等[40]将稳定的G-四链体修饰在纳米多孔金圆盘上,构建表面增强拉曼光谱(surface-enhanced Raman spectrum, SERS)传感器检测孔雀石绿(malachite green)(图2-B)。G-四链体独特的拓扑结构,可通过π-π堆积和静电吸引选择性地捕获孔雀石绿,从而在纳米多孔金圆盘上产生拉曼光谱信号。该传感器对孔雀石绿的检测限达到了50 pmol·L-1,比欧盟(EU)规定的残留限量值低两个数量级。通过该方法使用便携式光纤探针对实际样品进行检测也表现出良好的性能,为开发无标签SERS传感器提供了一条新的途径。Luan等[41]基于G-四链体的催化活性用于氯霉素检测。Fe3O4磁性颗粒修饰有单链结合蛋白(SSB),用于固定氯霉素DNA适配体链,适配体链另一端共价结合了辣根过氧化物酶(HRP)包被的SiO2颗粒,形成Fe3O4-适配体-HRP复合探针,氯霉素存在时,适配体与其结合,脱离磁性颗粒进入溶液,未结合的适配体可由磁珠分离,溶液中剩余的HRP-适配体-氯霉素复合物催化底物TMB/H2O2体系,产生可见的颜色信号。
2.2 基于G-四链体传感快速检测农产品中农药残留
农药乙醇胺的适配体富含G碱基,可形成G-四链体结构,Bayraç等[42]利用该适配体和ThT构建了无标记传感器对乙醇胺进行检测(图4-A)。当反应体系中无乙醇胺存在时,适配体序列形成G-四链体结构,与ThT结合,产生强荧光信号;而当反应体系中加入乙醇胺后,乙醇胺与ThT竞争,结合到适配体序列并使得G-四链体结构变成适配体的特定结构,ThT的荧光熄灭。该荧光适配体传感器具有良好的灵敏度和特异性,检测限为641 μmol·L-1。将该传感器用于含有5%胎牛血清的水样,添加实验回收率在95.5%~109.6%。该策略避免了对核酸探针进行复杂的标记修饰,为乙醇胺的检测提供了一种简单、快速且经济的解决方案。Li等[43]将高毒农药水胺硫磷(ICP)的适配体序列设计、分裂为两段,并分别在末端区域增加可形成G-四链体的序列,结合多壁碳纳米管(MWCNT)开发出一种新的无酶无标记检测方法,对水胺硫磷进行荧光检测(图4-B)。当反应体系中有水胺硫磷时,分裂的适配体与水胺硫磷结合,形成三明治状三元复合物,因空间位阻增加,不会吸附到MWCNTs上,G-四链体与NMM结合产生的强荧光信号保持。而在没有水胺硫磷的情况下,分裂的适配体保持单链DNA的形式,容易被MWCNTs所吸附,使得G-四链体与NMM结合产生的荧光被MWCNTs淬灭。因此,根据荧光信号的强弱即可对农药浓度进行定量检测。Tang等[44]利用G-四链体和三螺旋分子(TTGQ)开关建立了一种简单、灵敏、免标记荧光法检测啶虫脒(图4-C)。三螺旋分子开关由一条含有啶虫脒适配体序列的DNA链和一条两端为富G碱基序列的DNA链(称为HGS)组装而成。当目标物啶虫脒不存在时,三螺旋分子开关中的两小段富G碱基序列因相距较远,不能形成G-四链体,因而无法与NMM结合产生荧光信号。当目标物啶虫脒存在时,适配体序列会识别并结合啶虫脒,促使三螺旋分子开关打开,富含G碱基的信号链被释放出来,可形成G-四链体并与NMM结合,发出强荧光,产生响应啶虫脒的检测信号。该方法具有很好的灵敏度,可检测浓度低至2.38 nmol·L-1的啶虫脒。通过这些研究工作可看出,利用G-四链体作为信号输出元件,构建免标记荧光快速检测方法检测农药灵敏度高且简单。
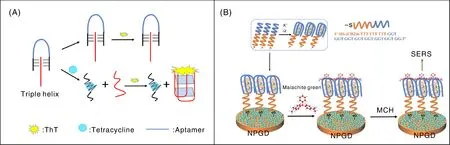
A,基于DNA G-四链体和三螺旋结构快速检测四环素[39];B,利用DNA G-四链体构建SERS传感平台快速检测孔雀石绿[40]。
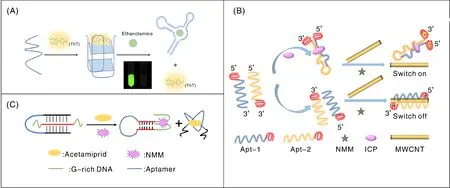
A,利用乙醇胺适配体形成的G-四链体快速检测乙醇胺原理图[42];B,基于DNA 适配体和G-四链体免标记无酶荧光生物传感快速检测水胺硫磷[43];C,基于DNA三螺旋结构分子开关和G-四链体荧光生物传感快速检测啶虫脒[44]。
2.3 基于G-四链体传感快速检测农产品中重金属离子
包括G-四链体在内的功能核酸与金属离子的作用方式多种多样,为利用功能核酸设计重金属离子的生物传感快速检测方法提供了机会。目前检测金属离子的核酸生物传感器主要包括荧光传感器、比色传感器、电化学传感器等。有研究发现,对于含有较多重复T碱基的富G碱基DNA序列,T-Hg-T作用力比ThT-G-四链体作用力更强。因此,Hg2+可以特异性地诱导ThT-DNA G-四链体形成T-Hg-T双链DNA结构,从而释放ThT,导致强荧光熄灭。基于这一发现,王香玉[45]通过将ThT用作DNA G-四链体荧光诱导剂实现了Hg2+的免标记高灵敏检测(图5-A)。Ji等[46]开发了一种新的Pb2+电化学DNA酶传感器,通过将作为催化电化学检测信号标签的G-四链体-hemin过氧化物模拟酶与纳米材料MoS2-AuPt偶联,快速、灵敏检测水中的Pb2+(图5-B)。在Pb2+存在情况下,依赖Pb2+的DNAzyme与Pb2+发生特异性结合,将底物链切断成两个自由片段,使负载了大量G-四链体-hemin过氧化物模拟酶的MoS2-AuPt纳米复合材料可固定于电极表面,在电极表面催化放大电化学检测信号,实现Pb2+的灵敏检测。G-四链体能够极大的提高苯乙烯基喹啉(SQ)染料的荧光强度,利用这个原理,Lu等[47]设计了一种用于Ag+快速检测的高灵敏核酸荧光传感器(图5-C),其检测机理是,自由态的荧光染料SQ其荧光微弱,而与G-四链体结合后荧光大大增强。当加入Ag+后,Ag+与G碱基结合,破坏了G-四链体,导致SQ无G-四链体可结合,从而荧光强度大大减弱。由此,可实现Ag+的快速、灵敏检测。在另一个研究工作中,郭亚辉等[48]首次用G-四链体结合ThT构建了G-四链体荧光核酸生物传感器,用于Zn2+的检测。该方法对Zn2+的检测限为0.91 μmol·L-1,将其用于实际样本河水中锌离子的检测,检出限为2.4 μmol·L-1。
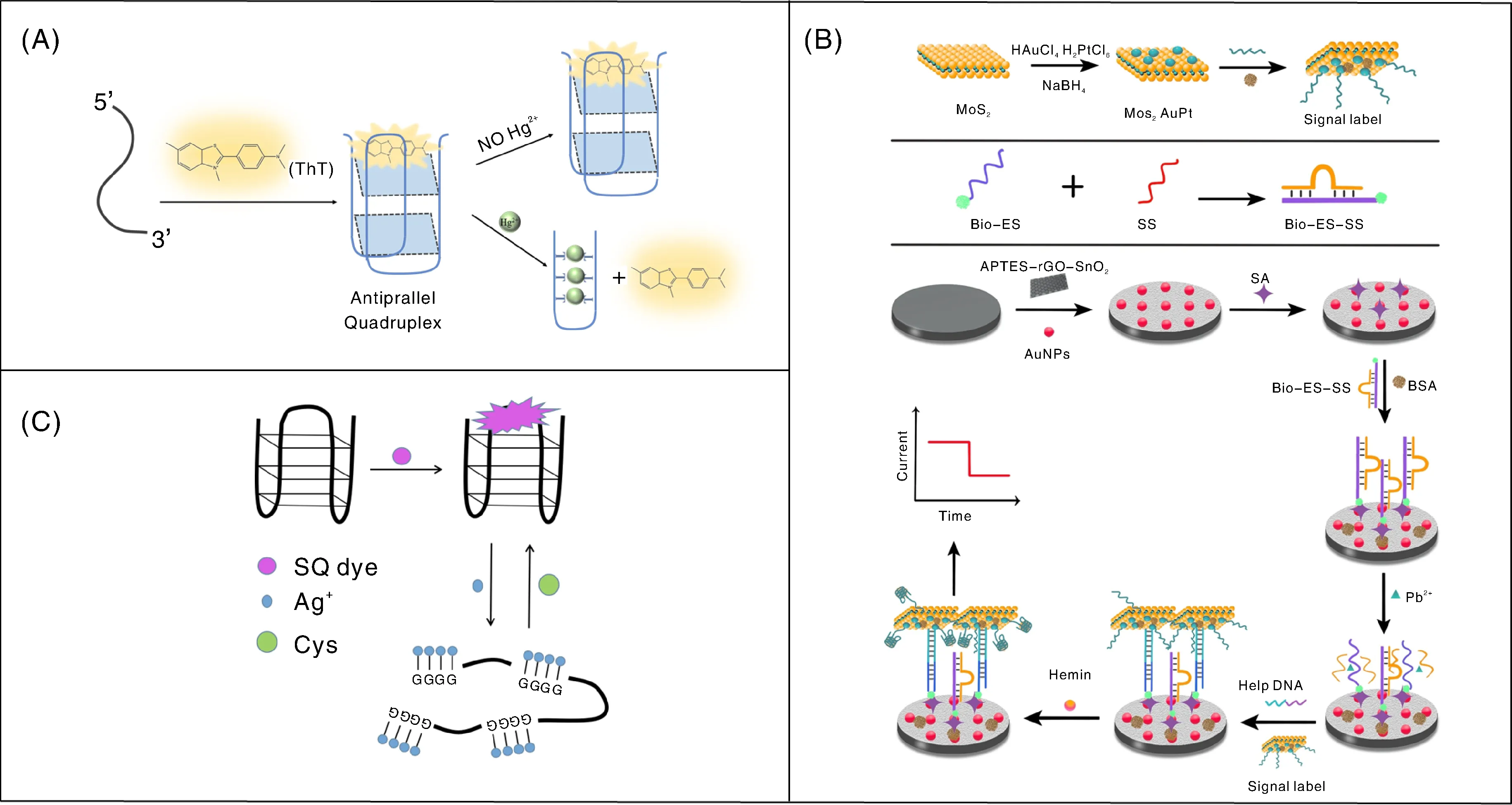
A,基于DNA G-四链体的Hg2+免标记传感器[45];B,G-四链体-hemin催化放大电化学信号灵敏检测Pb2+[46];C,基于G-四链体的Ag+快速检测[47]。
3 总结与展望
富含G碱基的DNA链在K+、Na+、Pb2+等金属离子的稳定下可形成G-四链体,进而与氯高铁血红素结合形成具有辣根过氧化物酶活性的复合物,或与某些染料分子结合增强染料分子的荧光强度,在化学生物传感检测中是构建目标物识别元件和信号输出、放大元件的极好材料。本文对DNA G-四链体的结构和性质做了介绍,在此基础上,以一些典型的研究报道为例,对G-四链体在食用农产品(食品)农药、兽药、重金属离子残留等的快速检测方法构建中的应用进行了总结。近年来国内外研究人员利用DNA G-四链体发展了比色、荧光、电化学等快速检测方法。在比色和电化学等检测方法中,主要利用G-四链体-hemin复合物的辣根过氧化物酶活性催化产生并放大检测信号;在荧光法检测中,则主要是利用G-四链体与荧光染料分子的结合产生检测信号。多数研究利用了DNA序列的可设计与易合成,将形成G-四链体结构的富G序列与DNA适配体序列拼接或融合以组装分子探针与开关。然而,DNA序列的拼接或融合可能会影响G-四链体结构的形成和稳定性以及适配体序列对检测目标物的识别与结合能力,导致这些不利影响的机理目前尚不清楚,也无规避方法可供设计遵循或参考,往往需要通过反复尝试和优化才能获得理想的探针序列。因此,未来研究若能阐明不同功能结构序列拼接、融合的原则与规律,分子探针的设计与组装将会事半功倍,也将有助于扩大待测目标物的种类。
