湖北枫杨水煎液诱导CIA模型大鼠滑膜细胞凋亡机制研究
2021-10-08陈明向阳*
陈 明 向 阳*
1.湖北民族大学医学部,湖北 恩施 445000; 2.风湿病发生与干预湖北省重点实验室(湖北民族大学),湖北 恩施 445000
类风湿关节炎(Rheumatoid arthritis,RA)是一种慢性自身免疫性疾病,以关节滑膜慢性炎症及关节的进行性破坏为主要特征,以对称性多关节炎为主要临床表现,常见关节处疼痛、肿胀,呈持续性、反复性发作[1-4]。若不及时治疗,最终可引起关节畸形,丧失关节功能。RA的发病机制并不十分明确,滑膜细胞增殖与凋亡失衡是目前研究的重要方向。RA滑膜细胞的增殖与炎性细胞浸润、血管翳形成、侵蚀软骨及骨组织损伤为主要病理特征,从而导致关节结构破坏、畸形及功能丧失[5]。有研究[6]发现,RA患者滑膜细胞增生明显,而细胞凋亡率显著减少,却并没有因过度增生出现过多的细胞凋亡,提示滑膜细胞的凋亡障碍可能是导致滑膜增厚的原因之一。有研究[7-8]表明,湖北枫杨(Pterocarya Hupehensis Skan,PHS)通过影响线粒体凋亡途径诱导RA滑膜细胞凋亡,本实验建立CIA模型大鼠,用湖北枫杨水煎液进行干预,进一步探讨枫杨对CIA大鼠膝关节滑膜凋亡的影响。
1 材料与方法
1.1 实验动物 SD大鼠60只(200±20)g,购于武汉剑悦生物科技有限公司,许可证号为SCXK(辽)2015-0001。
1.2 药材与试剂 湖北枫杨树皮,采自湖北省恩施市清江河滩,经袁林副教授鉴定,为胡桃科Juglandaceae枫杨属Pterocary Kunth植物。甲醇、异丙醇、冰醋酸(武汉市中天化工有限责任公司);BCA试剂盒、HRP标记的羊抗兔二抗(武汉科瑞生物技术有限公司);雷公藤多苷片(浙江得恩德制药股份有限公司);牛Ⅱ型胶原、完全弗氏佐剂(美国Sigma公司);大鼠IL-4、IFN-γ、TGF-β、IL-17AELISA试剂盒(酶联生物);β-Actin 抗体、HRP 羊抗兔二抗(武汉博士德生物工程有限公司);Bcl-xl、Caspase-8(abcam公司);TNFRⅡ抗体(美国CST公司);RIPA裂解液、彩色预染蛋白质分子量标准(10-180kD)、SDS-PAGE蛋白上样缓冲液、蛋白酶抑制剂(上海碧云天生物技术研究所)。
1.3 设备和仪器 酶标仪(Thermo公司);电泳仪电源(北京六一生物科技有限公司);包埋机(美国通用电气医疗集团);石蜡切片机(Leica公司);化学发光成像分析仪(美国通用电气医疗集团)。
2 实验方法
2.1 模型建立 60只大鼠适应性喂养1周,随机选取10只作为正常组,其余50只制作CIA模型。
2.2 动物分组 将造模成功的50只大鼠,随机分为5组,分别为模型组、雷公藤多苷组、低剂量组、中剂量组、高剂量组,每组10只,未造模的10只大鼠作为正常组。
2.3 给药方案 雷公藤多苷组大鼠予以 6.25 mg/(kg·d) 的雷公藤多苷混悬液灌服,枫杨低、中、高剂量组分别给予2.0 g/(kg·d)、4.0 g/(kg·d)、8.0 g/(kg·d) 的水煎液灌服,正常组、模型组灌服等体积的生理盐水,每组大鼠每天灌胃1次,连续灌胃28 d。
2.4 取材 灌胃28 d后,禁食禁水12 h,待麻醉成功,打开胸腔,用采血针于心尖搏动处取血,用于ELISA法检测血清TGF-β、IFN-γ、IL-17A及IL-4水平。充分暴露大鼠双膝关节腔,髌骨处可见一层淡黄色光滑组织,即为滑膜组织,利用手术刀及手术镊小心对其进行剥离并分离。
2.5 一般情况 每7天测量一次体重、膝关节直径、并进行关节炎评分,用以评价关节炎症程度。关节炎评分按照以下标准:0分:无红肿;1分:小趾关节红肿;2分:趾关节和足趾肿胀;3分:踝关节以下的足爪肿胀;4分:包括踝关节在内的全部足爪肿胀。
2.6 HE染色 将组织从多聚甲醛固定液中取出,在通风橱内用手术刀将目的部位组织修平整,经酒精脱水、二甲苯透明,明胶浸蜡及石蜡树脂等包埋成含有滑膜组织的石蜡块。蜡凝固后,从包埋框中取出,并进行修整。将修整好的蜡块置于切片机上切片,切片漂浮于摊片机温水上将组织摊平,用载玻片将组织捞起,放入烘箱中烤片。取出切片,置于自动染色机脱蜡染色,再用中性树胶封片。最后镜下观察,并进行病理学评分。关节组织病理学评分标准为:组织无病理学改变,记作0分;轻微炎症浸润记为1分;中度记为2分;重度,但无血管翳生成记3分;严重的炎症浸润,形成血管翳或软骨、骨侵蚀,记4分。
2.7 ELISA法 检测血清细胞因子水平 按照ELISA试剂盒方法检测血清TGF-β、IFN-γ、IL-17A及IL-4水平。
2.8 Western Blot法检测相关蛋白表达 提取滑膜蛋白,用BCA法测定蛋白浓度,然后将各组蛋白煮沸,加入四分之一体积的蛋白上样缓冲液(5×)。取适量的样本,在凝胶中依次加入蛋白上样缓冲液(1×),Maker,各组蛋白样本,蛋白上样缓冲液(1×)进行电泳。再将蛋白转移至PVDF膜上,用3%浓度的BSA封闭1h,加入不同的一抗进行孵育:TNFRⅡ(1∶1000),Caspase-8(1∶1200),Bcl-xl(1∶1000)。过夜之后取出,TBST溶液洗膜3次,每次10 min,放入二抗(1∶12000),孵育2 h,TBST溶液洗膜3次。最后进行显色,ImageJ软件分析条带的灰度值,以内参β-acting作为对照,得到各目的蛋白的相对表达量。实验独立重复3次。

3 结果
3.1 各组大鼠一般情况 正常组大鼠精神状态较好,体重明显增加,皮毛顺亮,饮食正常,足部皮肤无红肿情况,活动自如。模型组大鼠体重增长较正常组缓慢,皮毛较为暗淡枯槁,活动量明显减少,足部皮肤发红肿起,关节活动受限。各治疗组大鼠关节肿胀程度均有所降低,饮食量略有增加,体重逐渐增长,足部皮肤情况也有所改善。
3.2 体重变化 与正常组比较,模型组大鼠体重增长缓慢。用药后,各治疗组大鼠体重均有所增加,枫杨中、高剂量组和雷公藤多苷组体重增长明显(P<0.05),枫杨低剂量组在用药2周后体重明显增加(P<0.05)。如图1所示。

图1 大鼠体重变化情况
3.3 枫杨水煎液对CIA模型大鼠膝关节直径的影响 模型组与正常组相比,关节直径明显增大(P<0.05),治疗1周后,各用药组与模型组比较,关节直径有所减小(P<0.05),到第4周发现,关节直径明显减小(P<0.05)。与雷公藤多苷组相比,枫杨高剂量组对大鼠关节肿胀的改善更为显著(P<0.05)。如图2所示。

图2 大鼠膝关节直径变化情况
3.4 枫杨水煎液对CIA模型大鼠关节炎指数的影响 模型组与正常组比较,有显著性差异(P<0.01),且模型组数据上升,提示造模成功。治疗1周后,雷公藤多苷组和枫杨高剂量组与模型组比较,有显著性差异(P<0.05),治疗2周以后,各治疗组与模型组相比,有显著性差异(P<0.05)。且与雷公藤多苷组相比,枫杨高剂量组对关节炎指数的改善有显著效果(P<0.05)。如图3所示。

图3 大鼠关节炎指数变化
3.5 枫杨水煎液对CIA模型大鼠关节滑膜的影响 与正常组比较,模型组大鼠滑膜病理评分明显升高(P<0.05),与模型组比较,各用药组病理评分明显降低(P<0.05),与雷公藤多苷组相比,枫杨高剂量组改善病理方面更为显著(P<0.05),如图4所示。镜下可见:正常组大鼠滑膜组织中无明显病理变化,模型组出现大量炎性细胞浸润,滑膜细胞增多,且呈现多层,达到5~6层甚至更多。各用药组与模型组相比,滑膜增生,炎性细胞浸润有所缓解,层数也有所减少,而枫杨高剂量组效果最为明显,如图5所示。

图4 滑膜组织病理评分注:模型组与正常组比较,*P<0.05;各用药组与模型组比较,#P<0.05;枫杨高剂量组与雷公藤多苷组比较,☆P<0.05。
3.6 枫杨水煎液对CIA大鼠血清炎性因子水平的影响 与正常组相比,模型组大鼠血清中 TGF-β、IL-4含量明显降低(P<0.05),IFN-γ、IL-17A含量明显升高(P<0.05);与模型组相比,各用药组大鼠TGF-β、IL-4水平明显提高(P<0.05),IFN-γ、IL-17A显著降低(P<0.05);与雷公藤多苷组相比,低剂量组对TGF-β含量的升高和IFN-γ的降低更为明显(P<0.05),高剂量组对IL-17A水平的降低和IL-4的升高更为明显(P<0.05)。如图6所示。

A.正常组;B.模型组;C.雷公藤多苷组;D.低剂量组;E.中剂量组;F.高剂量组图5 CIA 大鼠膝关节滑膜 HE 染色切片(×20)

图6 血清炎性因子含量变化注:与正常组相比较,*P<0.05;与模型组比较,#P<0.05;与雷公藤多苷组比较,☆P<0.05;与低剂量组比较,△P<0.05;与中剂量组比较,▲P<0.05。
3.7 枫杨水煎液对CIA模型大鼠凋亡相关蛋白表达的影响 与正常组相比,CIA大鼠TNFRⅡ、Bcl-xl的蛋白表达显著增加(P<0.05),Caspase-8的表达显著降低(P<0.05)。与模型组比较:雷公藤多苷组和枫杨低剂量组大鼠的TNFRⅡ表达明显降低(P<0.05);枫杨中、高剂量组TNFRⅡ表达反而明显升高(P<0.05);枫杨低、中、高剂量组Caspase-8蛋白表达显著增加(P<0.05),且均显著高于雷公藤多苷组(P<0.05);各用药组Bcl-xl蛋白表达均降低,其中枫杨低剂量组差异有显著性意义(P<0.05);枫杨低剂量组Bcl-xl表达水平显著低于雷公藤多苷组(P<0.05)。如图7所示。
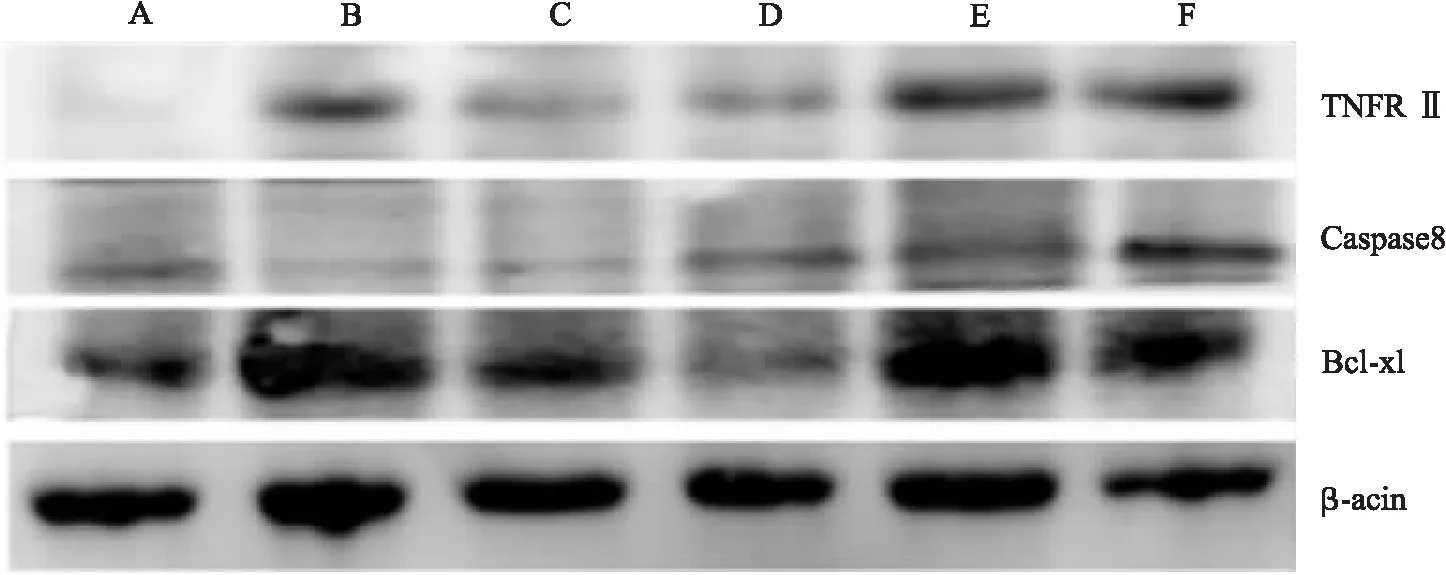
A.正常组;B.模型组;C.雷公藤多苷组;D.低剂量组;E.中剂量组;F.高剂量组

图7 各组大鼠凋亡相关蛋白表达灰度比值注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与雷公藤多苷组比较,☆P<0.05;与低剂量组比较,△P<0.05;与中剂量组比较,▲P<0.05。
4 讨论
细胞凋亡有两个途径:内源性途径和外源性途径[9]。线粒体是发生内源性途径的重要细胞器,而细胞表面死亡受体是介导含半胱氨酸的天冬氨酸水解酶-8(Cysteinyl aspartate specific proteinase-8,caspase-8)激活的外源性途径[10]。外源性途径中,死亡受体激活的起始Caspase是Caspase-8,Caspase-8可通过激活Caspase-3执行凋亡。另外,还能够切割细胞基质中的B细胞淋巴瘤(B-cell lymphoma-2,Bcl-2)蛋白家族成员Bid前体[11],形成截断的Bid(tBid),tBid可进入线粒体中,并促使Bax等蛋白产生寡聚反应,诱导细胞色素C(Cytochrome C,Cyt-C),同时使凋亡诱导因子AIF及其他相关凋亡信号从线粒体释放,进而诱导细胞凋亡[12]。研究发现枫杨水煎液可使大鼠滑膜组织凋亡诱导蛋白Caspase-8表达增加,凋亡抑制蛋白Bcl-xl表达降低。结合前期研究结果,说明枫杨能够通过上调Capase-8并作用于Caspase-3和B细胞淋巴瘤-xl(B-cell lymphoma-xl,Bcl-xl)蛋白,引起Cyt-C和其他凋亡信号的释放增加,从而促进滑膜细胞凋亡。
肿瘤坏死因子受体(Tumor necrosis factor receptor,TNFR)在免疫系统及相关疾病中发挥重要作用,包括Ι型(TNFRΙ)和Ⅱ型(TNFRⅡ)。肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)可分别与TNFRΙ和TNFRⅡ结合,介导不同的生物学活性[13]。在正常生理情况下,TNF-TNFRs系统保持凋亡与增殖两方面功能的平衡,病理条件下,介导两条相反的信号通路,会破坏这种平衡,导致机体免疫环境与功能紊乱,引起滑膜组织增生与炎症,发生疾病。体外分别培养RA患者与正常人的成纤维滑膜细胞[14],发现与健康人相比,RA患者的滑膜细胞增生是通过上调TNFRΙ,下调TNFRⅡ表达,来激活TNFR相关因子,导致核转录因子-κB(Nuclear factor-kappaB,NF-κB)进一步活化,阻碍细胞的正常凋亡,造成滑膜细胞过度增殖,组织增生。Blüml研究[15]发现,TNFRΙ是关节炎发生的主要原因,而同时存在的TNFRⅡ对关节炎有保护作用。TNFRⅡ胞内不存在死亡结构域[16],但是能够募集肿瘤坏死因子受体相关因子2(TNF receeptor associated factor 2,TRAF2),激活丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)和NF-κB信号通路,发挥抗炎作用。
实验结果显示,枫杨干预CIA大鼠后,低剂量组下调TNFRII,与雷公藤多苷作用相似;而中、高剂量则对TNFRⅡ有上调作用,与雷公藤多苷完全相反。枫杨对TNFRII明显的双向调节现象的机制与意义尚不清楚,但值得进一步研究。考虑到TNFRII对关节炎症的保护作用,推测中、高剂量枫杨通过上调TNFRⅡ表达,与TNFRΙ竞争TRAF2,从而促进滑膜细胞凋亡,同时抑制NF-κB信号通路上的炎症因子的释放,参与抗炎通路中的炎症反应过程。这一发现对选择枫杨治疗剂量具有重要参考价值。前期细胞实验结果显示,湖北枫杨可通过调控相关蛋白的表达,影响线粒体凋亡途径,从而诱导MH7A细胞凋亡。本研究对前期实验进行了延伸,在动物水平进行研究,证实在湖北枫杨对CIA大鼠滑膜细胞的凋亡具有促进作用,其机理可能是通过调节凋亡相关蛋白TNFRⅡ、Bcl-xl和Caspase-8的表达实现的。
