基于网络药理学方法预测大黄酸治疗新生儿急性呼吸窘迫综合征的抗炎作用机制
2021-10-08冯俊芳王一彪陈欧高雁翎
冯俊芳,王一彪,陈欧,高雁翎
1.德州市人民医院新生儿科,山东 德州 253000;2.山东大学齐鲁医学院第二医院儿科,山东 济南 250033;3. 山东大学齐鲁医学院护理学院,山东 济南 250012
新生儿急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是不同病因引起的肺部急性炎症疾病,临床表现为呼吸窘迫、低氧血症、肺顺应性下降等症状,是新生儿常见的临床危重症。新生儿ARDS的病因是肺内外多种炎症导致的肺表面活性物质(pulmonary surfactant,PS)继发性缺乏,发病具有炎症性特点[1-2]。大黄酸是大黄等中药的主要活性成分之一,属单蒽醌类1,8-二羟基蒽醌衍生物,有抗炎、抗菌、抗癌、抗氧化等药理活性[3-5]。目前,大黄酸通过抗炎作用治疗急性呼吸窘迫综合征报道较少。
网络药理学(network pharmacology)是一门药理学分支学科,它采用网络构建、数据挖掘、网络分析和实验验证等方法,构建药物、疾病和生物分子相关的网络模型,为辨识药物的靶标、药物开发指导奠定基础[6],它被认为是“下一代药物研究新模式”。“药物-靶点-通路及疾病-基因-靶点-药物”等生物分子网络的构建则是网络药理学的基础[7-8],它既可以从成分-靶点-通路探讨药物疗效,也可以通过已知疗效的药物反向探索疾病发病机制[9-10]。本研究应用网络药理学方法预测大黄酸治疗新生儿急性呼吸窘迫综合征的抗炎作用机制,并通过细胞水平的实验加以验证,为治疗新生儿ARDS提供新的思路和方法。
1 材料与方法
1.1 使用的工具和数据来源采用TCMSP、PubChem、STITCH 查找药物的化学成分及其作用的靶标;通过Genebank、TTD、Drugbank、String查找与疾病相关的基因,基因之间的相互作用及蛋白-蛋白相互作用信息;应用Enrichr、KEGG 查找生物分子参与的信号通路;用Cytoscape构建网络;用Systemsdock进行分子对接。
1.2 大黄酸靶点的预测通过查询TCMSP 及PubChem数据库,得到并导出大黄酸的三维化学结构数据,然后将数据导入Swiss prediction target数据库中进行反向分子对接,靶点集选择“homo sapiens”,得到预测靶点,用于后续研究。
1.3 大黄酸-靶蛋白分子对接通过查询PDB数据库,得到靶点蛋白的PDB-ID,并将其导入Systemsdock进行分子对接,根据Docking Score值来判断大黄酸与靶点的匹配度。Score 取值范围在0~10 之间,值越大,配体与受体结合越稳定[11]。
1.4 大黄酸-靶点网络的构建应用Cytoscape软件,将大黄酸及其潜在靶点导入Cytoscape 软件,构建“药物-靶蛋白”互作信息网络。
1.5 大黄酸-靶蛋白互作网络的构建蛋白质之间的相互作用是人类生命活动的基础,也是探索人体分子机制的重要内容。为了明确药物靶点之间的相互作用,本研究应用STRING 平台筛选靶点之间的相互作用,构建PPI 网络,从系统的角度研究疾病分类,确定机制,发现新的药物靶点。应用STRING 数据库平台,构建大黄酸靶蛋白-靶蛋白之间的相互作用信息网络(PPI network),蛋白种类设置为“Homo sapiens”,阈值设为“medium confidence”,其余参数均保持默认值。
1.6 抗炎相关靶点蛋白信息筛选在Therapeutic Target Database (TTD)数据库中,将关键词设置为“anti-inflammation”,搜索抗炎靶点蛋白相关信息。将选取的抗炎靶点蛋白输入Cytoscape软件中,构建抗炎靶点蛋白-蛋白PPI网络。
1.7 大黄酸抗炎靶点的筛选及抗炎靶点的网络构建将大黄酸靶点蛋白网络与选取的抗炎靶点蛋白网络合并,取其交集,交集中的靶点蛋白即为大黄酸的抗炎靶点蛋白,并将上述靶点蛋白输入String 数据库中,构建筛选后的PPI网络,并设置蛋白相互作用的高置信度依据:打分值>0.7。
1.8 检索新生儿呼吸窘迫综合征相关基因在NCBIGene 数据库(https://www.ncbi.nim.nih.gov)中,新生儿呼吸窘迫综合征相关基因以“Neonatal respiratory distress syndrome”和“homo sapiens”为关键词进行检索,得到新生儿呼吸窘迫综合征相关的基因。
1.9 大黄酸抗炎靶点对抗新生儿呼吸窘迫综合征的体内反应网络在String数据库中输入大黄酸抗炎靶点基因与新生儿呼吸窘迫综合征相关基因,构建大黄酸抗炎靶点对抗新生儿呼吸窘迫综合征的体内反应网络,进一步筛选与新生儿呼吸窘迫综合征发病相关的抗炎靶点。
1.10 KEGG 通路富集分析在Enrichr 数据库中,对大黄酸干预新生儿呼吸窘迫综合征的关键作用靶标进行KEGG (Kyoto Encyclopedia of Genes and Genomes)生物通路富集分析。
1.11 体外实验验证大黄酸抗新生儿ARDS作用的分子机制
1.11.1 细胞培养和药物处理HBE细胞购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。RPMI-1640 培养基和胎牛血清购自Sigma公司。LPS购自Sigma公司。p-P38、P38抗体购自ABclonal 公司。本实验在山东大学第二医院中心实验室完成。将HBE 细胞置于含10% 胎牛血清的RPMI-1640 培养基中,置于37℃、体积分数5% CO2的恒温培养箱中培养,当细胞增殖到约80%时传代继续培养。细胞分为5 组:HBE 对照组、LPS 联合OVA组、大黄酸低剂量组(0.1 μmol/L)、大黄酸中剂量组(0.5 μmol/L)、大黄酸高剂量组(1.0 μmol/L)。
1.11.2 Western blot 检测p-P38 及P38表达收集待测HBE 细胞,用PBS 洗3 次,加入含蛋白酶抑制剂的细胞裂解液,提取细胞总蛋白。等量的蛋白经SDS-PAGE 凝胶(10%)电泳分离后转至PVDF膜。用5%的牛奶(MILK)进行封闭,然后依次孵育一抗(抗p-P38、抗P38抗体)和二抗,最后进行显色。蛋白的相对表达量为目的蛋白条带的灰度值与内参蛋白条带的灰度值的比值。
1.12 统计学方法采用GraphPad Prism 7 进行统计学分析,ImagJ 计算目的蛋白灰度值,ONE-WAY ANOVA检验进行方差分析,检测数据用均数±标准差(±s)表示,柱状图采用GraphPad Prism 7软件绘制;检验水准α=0.05,以P<0.05差异有统计学意义。
2 结果
2.1 大黄酸与预测靶点网络通过查询TCMSP、PubChem、Swiss prediction target 数据库筛选出10 个大黄酸的靶点蛋白,并运用Cytoscape3.7.1软件构建大黄酸-预测靶点网络,见图1。
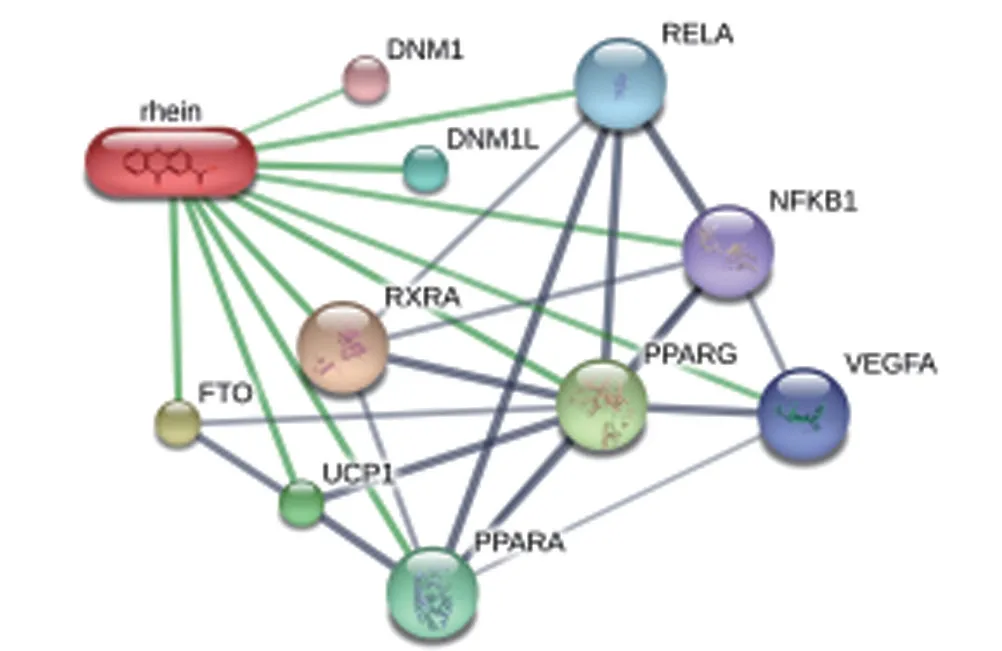
图1 大黄酸-靶点相互作用网络
2.2 大黄酸靶点蛋白相互作用网络选取大黄酸的10 个靶点蛋白,在String 数据库中构建PPI 网络(图2),组成15条相互作用关系,见图2。
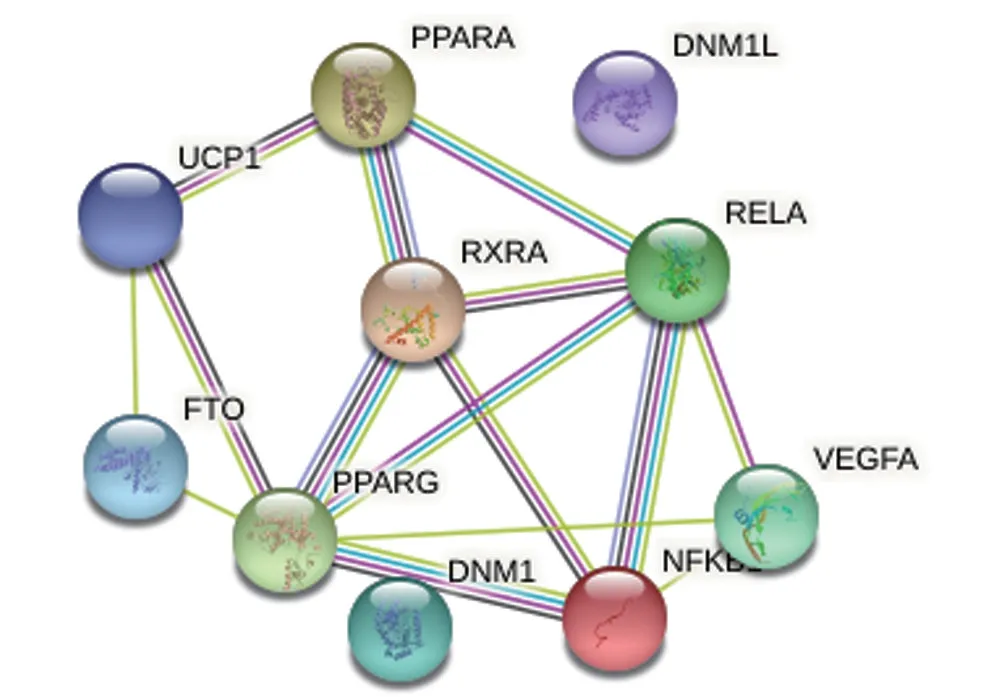
图2 大黄酸靶点蛋白相互作用网络
2.3 大黄酸与相关靶点的反向对接得分为进一步验证预测靶点的准确性,选取大黄酸与12个度数最高的靶蛋白进行分子对接分析。其结果显示,大黄酸与靶蛋白对接的score值均大于5,表明大黄酸与预测靶点具有良好的相互作用,证实了预测靶点的可靠性,见表1。

表1 大黄酸与其靶点的对接得分
2.4 大黄酸-抗炎靶点PPI 网络分析在TTD中检测到70 个与抗炎相关的蛋白,构建PPI 网络,在PPI 网络(图3)中,共有63 个相互作用靶点,组成383条相互作用关系。使用Cytoscape 3.7.1 中的Merge 功能将大黄酸预测靶点蛋白网络与抗炎靶点蛋白网络融合,取其交集部分(图4),取>0.7的高置信度区间,得到大黄酸发挥抗炎作用靶点,包括肿瘤坏死因子受体超家族成员1A (TNFRSF1A)、表皮生长因子受体(EGFR)、受体酪氨酸激酶Erb-B2 (Erb-B2)及丝裂原活化蛋白激酶(MAPK14)。
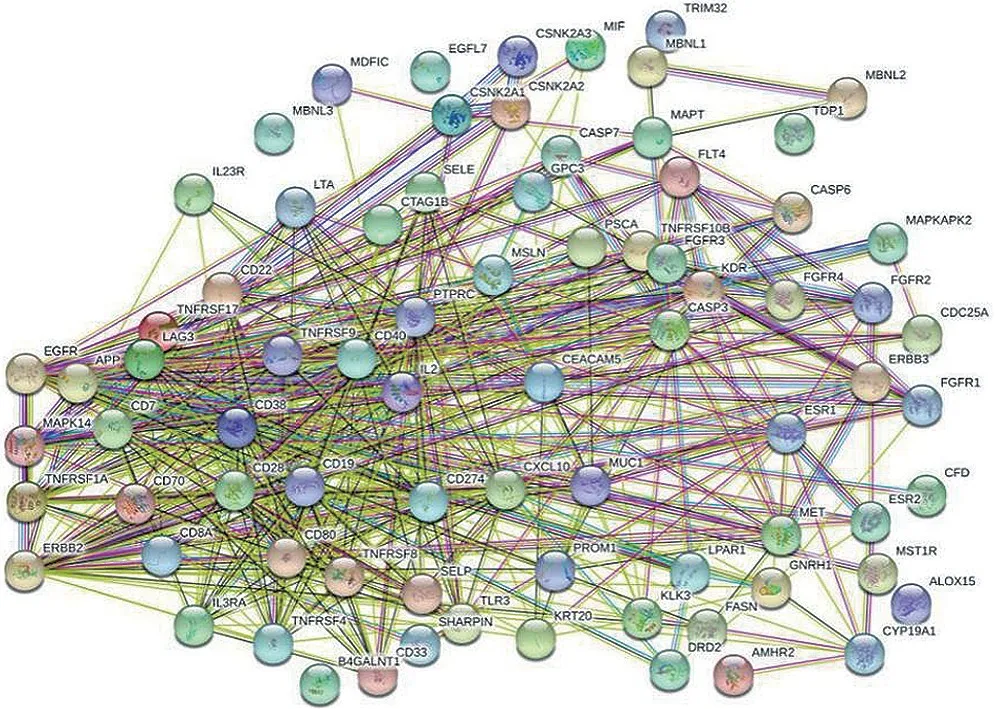
图4 大黄酸预测靶点-抗炎靶点蛋白相互作用网络
2.5 大黄酸抗炎靶点对抗新生儿急性呼吸窘迫综合征的体内反应网络分析结果得到4个与新生儿急性呼吸窘迫综合征相关的大黄酸抗炎靶点:TNFRSF1A 、EGFR、Erb-B2、及MAPK14,见图5。

图5 大黄酸抗炎靶点对抗新生儿急性呼吸窘迫综合征的体内反应网络
2.6 大黄酸治疗新生儿ARDS 的KEGG 通路富集分析通路富集分析结果得出大黄酸治疗新生儿急性呼吸窘迫综合征主要涉及128条信号通路。将Enrichr分析结果按P 排序排名前十的KEGG通路:免疫信号通路MAPK 信号通路、Human cytomaglovirus infection、Proteoglycans in cancer、Bladder cancer、Amyotrophic lateral sclerosis (ALS)、Endometrial cancer、Central carbon metabolism in cancer、Non-small cell lung cancer、Epithelial cell signaling in Helicobacter pylori infection 及Adherence junction,见图6。
2.7 大黄酸对LPS 联合OVA 诱导的HBE 细胞p38MAPK通路表达和炎症反应的影响图7显示,与对照组相比较,LPS联合OVA组HBE细胞中p-P38相对表达量明显升高,差异有统计学意义(P<0.05)。与LPS联合OVA组相比较,大黄酸0.1 μmol/L组、大黄酸0.5 μmol/L 及大黄酸1.0 μmol/L 组中p-P38 相对表达量均降低,差异有统计学意义(P<0.05)。
3 讨论
ARDS 是一种肺部急性炎症性疾病[1],其主要病理改变为肺部炎性细胞浸润、肺泡上皮屏障破坏及肺泡血管内皮渗透性增加等,临床表现为严重低氧血症、呼吸窘迫、肺顺应性下降等症状。近年来,足月儿ARDS发病率逐渐增加,且其具有病情重、进展快和病死率高等特点[12]。目前,新生儿ARDS的治疗原则仍以纠正缺氧、降低肺动脉高压、治疗原发病等综合治疗为主,但尚无特效的治疗手段。因此,寻找新的治疗呼吸窘迫综合征的药物及靶点显得尤为重要。本研究运用网络药理学的相关方法,建立中药成分-靶点-疾病网络,从整体的观点深入探究大黄酸治疗新生儿ARDS的相关作用机制,并通过体外实验进行验证。
文献报道大黄酸具有抗炎作用活性[13-15],徐佑东等[16]从分子机制方面证实了大黄酸的抗炎作用。本研究结果显示了大黄酸的抗炎作用,与上述结论一致。一方面,网络药理学预测得出TNFRSF1A、EGFR、Erb-B2、MAPK14 是大黄酸药物的抗炎靶点;另一方面,TNFRSF1A、EGFR、Erb-B2、MAPK14 与疾病新生儿呼吸窘迫综合征相关。由此推测,这4 个靶点可能是大黄酸治疗新生儿呼吸窘迫综合征的重要抗炎靶点。大黄酸既可以直接作用于这些靶点发挥抗炎作用,也可以间接作用于其他靶点而发挥抗炎作用[17]。
TNFRSF1A 是1 型TNF 受体,属肿瘤坏死因子受体超家族成员,在机体内分布广泛。TNFRSF1A主要通过活化NF-κB、JAK-STAT、MAPK等信号通路[18],诱导细胞因子IL-1、IL-6、TNF-α等的合成及细胞凋亡而介导炎症反应[19-21]。TNFRSF1A也可与MAPK14共同参与肿瘤坏死因子等信号通路发挥作用。
EGFR是表皮生长因子受体,广泛分布于机体上皮组织中,在炎症发生过程中起重要调节作用[22]。体外实验证实,EGFR抑制剂可通过调控NF-κB信号通路,抑制LPS诱导的iNOS表达,抑制细胞因子IL-1β、IL-6和TNF-α等的产生,发挥抗炎作用[23]。小鼠支气管上皮EGFR磷酸化水平与臭氧诱导的小鼠肺组织炎症病理学变化总分呈正相关[24]。补肺益肾方可通过调控EGFR/PI3K/mTOR 通 路,降 低 促 炎 因 子IL-1 β 、IL-6、TNF-α等的水平,减轻COPD气道炎症[25]。在KEGG通路富集前十位信号通路中,其中的9 种信号通路均有EGFR参与,也进一步说明了大黄酸可通过与EGFR及其相关信号通路构建成作用网络,发挥其抗炎作用。
Erb-B2 又名HER2、NEU、CD340,是原癌基因erb-B2编码的185 kDa的细胞膜受体,为EGFR家族成员之一[26]。小鼠细胞因子IL-1、肿瘤坏死因子、IFN-γ等的激活促进了乳腺癌的发生及进展[27]。抑制或敲除Erb-B2 可以通过调控NF-κB 信号通路影响IL-1β、Cyclooxygenase-2 和多种趋化因子的表达,进而减轻紫外线诱导的皮肤炎症反应[28]。由此推测大黄酸通过与Erb-B2 相互作用可能通过调节IL-1β、TNF、IFN-γ的分泌发挥抗炎作用。
MAPK14 是P38MAPKs 之一,p38 MAPK 亚群包括4种亚型,分别为p38α、p38β、p38γ、p38δ,其中p38α和p38β主要参与炎性紊乱[29]。促炎细胞因子或细胞外刺激可引发细胞级联反应,P38MAPKs 在上述所引发的细胞级联反应中起重要作用,在重症胰腺炎、激素抵抗型哮喘等疾病中的表达量明显升高[30-31],并且P38MAPKs 是由肺炎链球菌所引发的肺组织炎症反应的关键信号分子[32],IL-1β、IL-6、TNF-α等炎症因子可以通过激活p38MAPK 信号通路,与ERK 及核因子-κB (NF-κB)等信号通路发生正反馈,级联放大炎症反应[33]。由P38MAPKs调节的转录级联反应会导致TNF-α、IL-1β等促炎因子的产生,进而导致炎症反应相关酶的激活[34],在LPS 诱导的急性肺损伤小鼠中Dapk1 可通过调控p38MAPK/NF-κB 通路降低IL-6、TNF-α、MPO等细胞因子的水平,减轻炎症反应[35]。由此推测,大黄酸可通过减低TNF-α、IL-1β、IL-6等促炎因子的表达,抑制MAPK通路,发挥其抗炎作用。本研究结果显示,在OVA 联合LPS 诱导的HBE 细胞中MAPKP38的磷酸化水平升高,给予大黄酸治疗后可以降低MAPKP38的磷酸化水平,并且与大黄酸浓度成正相关。这说明,大黄酸的抗炎作用可能与调控MAPK通路有关,与上述结论一致。本实验采用基于网络药理学原理的综合数据分析方法,预测了大黄酸抗炎作用的主要靶点及相关的信号通路,发现大黄酸可通过多靶点、多途径干预新生儿急性呼吸窘迫综合征的发生、发展,并且运用体外实验验证了大黄酸抗炎作用的相关分子机制。但网络药理学研究以网络建模、数据库资源开发以及软件应用为基础,网络模型及细胞实验与机体内环境存在一定差异,故大黄酸抗炎作用的研究结果还需通过进一步的体内实验加以证实。
