石莼醇提物基于细胞膜损伤的抑菌作用
2021-10-08陈雨晴马志洲
陈雨晴, 吕 峰, 马志洲
(福建农林大学食品科学学院,福建 福州 350002)
植物多酚具有优异的抑菌活性,但其种类繁多、结构复杂,抑菌效果各不相同[1].如从苦荞麦麸乙酸乙酯提取物中可分离出芦丁、槲皮素、异槲皮素等多种酚类物质,其中,槲皮素的抗痤疮丙酸杆菌和抗表皮葡萄球菌性能分别是异槲皮素的16、8倍,而芦丁仅对表皮葡萄球菌有抑制作用.这可能是槲皮素具有游离的C3-OH结构及高度的亲脂性而表现出更强的抑菌性能[2].由于不同研究中多酚的种类、结构及供试菌种有所差异,使得几乎每种酚类物质都具有其独特的抑菌作用.
石莼(Ulvalactuca)别名海白菜、海莴苣等,主要分布于黄海西区、东海西区、南海北区、南海南区,是我国资源极为丰富的野生藻类之一[3-4].据报道,石莼多酚具有广谱的抑菌性能,对金黄色葡萄球菌、大肠杆菌等细菌及链格孢菌、青霉菌等真菌具有良好的抑制作用;经高效液相色谱(HPLC)分析发现,其主要抑菌作用成分为儿茶酚和表儿茶素等酚类物质[5].基于此,本研究以石莼醇提物为试材,以金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、沙门氏菌为供试菌,着重考察其基于细胞膜损伤的抑菌作用,以期为石莼功能性成分的开发应用提供参考依据.
1 材料与方法
1.1 材料
石莼粉(80目)为福建海兴保健食品有限公司产品;金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillussubtilis)、大肠杆菌(Escherichiacoli)、沙门氏菌(Salmonellatyphimurium)由福建农林大学食品科学学院微生物实验室提供;胰蛋白胨大豆肉汤培养基(tryptone soya broth, TSB)、胰蛋白胨大豆琼脂培养基(tryptone soya agar, TSA)为杭州微生物试剂有限公司产品;碘化丙啶(propidium iodide, PI) 为美国Sigma公司产品;0.1 mol·L-1(pH 7.4)磷酸盐缓冲液(phosphate buffered solution, PBS)为北京索莱宝科技有限公司产品;氯化钠、考马斯亮蓝G250、乙醇、磷酸、戊二醛等均为分析纯,为国药集团化学试剂有限公司产品.
仪器有LDZX-50KBS立式压力蒸汽灭菌锅(上海博讯医疗生物仪器有限公司)、SW-CJ-2FD超净工作台(苏州安泰空气技术有限公司)、MIKRO 220R立式高速冷冻离心机(德国Hettich公司)、SepectraMax i3X酶标仪(美谷分子仪器有限公司)、DDS-11AT电导率仪(上海雷磁仪器厂)、Accuri C6流式细胞仪(美国BD公司)、Nova NanoSEM 230场发射扫描电镜(美国FEI公司)、HITACHI H-7650透射电镜(日本日立高新技术公司).
1.2 方法
1.2.1 石莼醇提物样液的制备 以实验室自制的石莼乙醇粗提物为试材,按文献[6]的方法,采用超声辅助乙醇溶液提取、锌离子螯合法分离纯化制备石莼醇提物.采用福林酚法[7]测定所得样品中多酚含量为251.8 mg·g-1(以没食子酸计).将石莼醇提物用无菌去离子水配制成一定质量浓度的样液,经0.22 μm滤菌器过滤除菌后备用.
1.2.2 供试菌液的制备 分别将冻存于-80 ℃的供试菌(金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、沙门氏菌)采用划线法在TSA平板上活化,挑取单菌落接种于10 mL TSB培养基中,将供试菌于37 ℃培养18 h至对数生长期,于5 000 r·min-1离心10 min收集菌体.菌体用无菌生理盐水洗涤3次,重悬于无菌生理盐水中,制成浓度约为108cfu·mL-1的菌液,均在24 h内使用.
1.2.3 最低抑制浓度(minimal inhibitory concentration, MIC)、最低杀菌浓度(minimum bactericidal concentration, MBC)的测定 参考Wilson et al[8]的方法并稍作修改.按“1.2.1”的方法分别配制质量浓度为200 mg·mL-1的石莼醇提物样液,采用二倍稀释法将其用TSB液体培养基稀释成不同质量浓度的待测样液.另取采用“1.2.2”的方法制备的4种菌液加入TSB液体培养基进行稀释,使其菌液浓度均为106cfu·mL-1.分别取上述各待测样液100 μL加入96孔无菌培养板中,并分别加入上述稀释后的各供试菌液100 μL,使各组培养液中石莼醇提物样液的最终质量浓度分别为100.00、50.00、25.00、12.50、6.25、3.13、1.56、0.78 mg·mL-1,最终的菌液浓度均为5×105cfu·mL-1.混匀后放入37 ℃恒温培养箱中培养24 h,以肉眼未见浑浊的最小质量浓度为MIC.取100 μL未见浑浊的培养液涂布于TSA平板上,并于37 ℃恒温培养箱中培养24 h,以无菌生长的最小质量浓度为MBC.同时以不加菌液的培养液为阴性对照,以生理盐水代替待测样液为阳性对照进行试验,每组处理均重复3次.
1.2.4 生长曲线的绘制 参考Diao et al[9]的方法并稍作修改.将按“1.2.1”的方法配制的石莼醇提物样液添加到TSB液体培养基中,使其终质量浓度为1/2×MIC、1×MIC,以不加石莼醇提物样液的TSB培养液为空白对照.取上述各组培养液20 mL于无菌离心管中,分别加入按“1.2.2”的方法制备的4种菌液100 μL,使菌液浓度均为5×105cfu·mL-1,混匀后置摇床(280 r·min-1、37 ℃)中振荡培养.每隔2 h各取200 μL培养液加入96孔无菌培养板中,测定其在600 nm波长处的光密度(D).以培养时间为横坐标,D600 nm为纵坐标,绘制供试菌的生长曲线,每组处理均重复3次.
1.2.5 供试菌培养液电导率的测定 分别移取按“1.2.2”的方法制备的4种菌液20 mL于无菌离心管中,各加入等体积不同质量浓度的石莼醇提物样液,使其终质量浓度均为0、1×MIC、2×MIC,混匀后置于摇床(280 r·min-1、37 ℃)中振荡,每隔1 h测定其电导率[10].每组处理均重复3次.
1.2.6 菌体核酸、蛋白质泄露量的测定 按“1.2.5”的方法制备4种菌培养液,置摇床(280 r·min-1、37 ℃)中振荡4 h.分别取上述4种菌培养液10 mL,于10 000 r·min-1离心10 min,收集上清液.各取200 μL上清液加入96孔无菌培养板中,测定其D260 nm,考察菌体核酸泄露量;分别再取上清液1 mL,用考马斯亮蓝法[11]测定其D595 nm,考察菌体蛋白质泄露量.每组处理均重复3次.
1.2.7 金黄色葡萄球菌菌体损伤率的测定 参考宁亚维等[12]的方法并稍作修改.取按“1.2.2”的方法培养至对数生长期的金黄色葡萄球菌,用PBS调节菌液浓度约为108cfu·mL-1,分别加入等体积不同质量浓度的石莼醇提物样液,使其终质量浓度为0、1×MIC、2×MIC,于37 ℃恒温培养4 h.向上述各培养液中分别加入PI染液,控制其最终质量浓度为10 μg·mL-1,避光染色20 min后,用PBS洗涤菌体3次,采用流式细胞仪(激发波长488 nm、发射波长650 nm)测定菌体损伤率.
1.2.8 细菌超微结构的观察 按“1.2.7”的方法制备金黄色葡萄球菌培养液,置摇床培养箱(37 ℃)培养4 h.取上述培养液于5 000 r·min-1离心10 min,收集菌体,用PBS洗涤3次,重悬于2.5%戊二醛-PBS溶液中,于4 ℃下固定12 h.按扫描电镜、透射电镜生物样品制备法[13]进行前处理,在电镜下观察菌体超微结构.
1.3 数据处理
采用Excel 2007软件对试验数据进行作图分析;采用DPS 7.05软件以Duncan新复极差法对各单因素的平均值进行显著性检验.
2 结果与分析
2.1 石莼醇提物的抑菌活性
由表1可知,石莼醇提物对4种菌的MIC、MBC均为1.56~6.25 mg·mL-1,尤其对金黄色葡萄球菌的抑制能力最强,其MIC、MBC分别为1.56、3.13 mg·mL-1,而对枯草芽孢杆菌的抑制能力最弱,两指标值均为6.25 mg·mL-1.推测可能是由于菌体细胞结构不同导致敏感性差异[14].金黄色葡萄球菌是革兰氏阳性菌(G+),其细胞壁主要成分为肽聚糖,并结合磷壁酸,而多酚易与二者结合进而破坏细胞壁致菌体死亡.大肠杆菌、沙门氏菌是革兰氏阴性菌(G-),其细胞壁外壁含脂蛋白、脂多糖,内壁肽聚糖含量少,不易与多酚结合.因此,多酚对G+的抑制效果通常优于G-.而枯草芽孢杆菌虽然也是G+,但其能够产生抗逆性很强的芽孢,这可能是石莼醇提物中的多酚对枯草芽孢杆菌抑制效果不佳的原因.
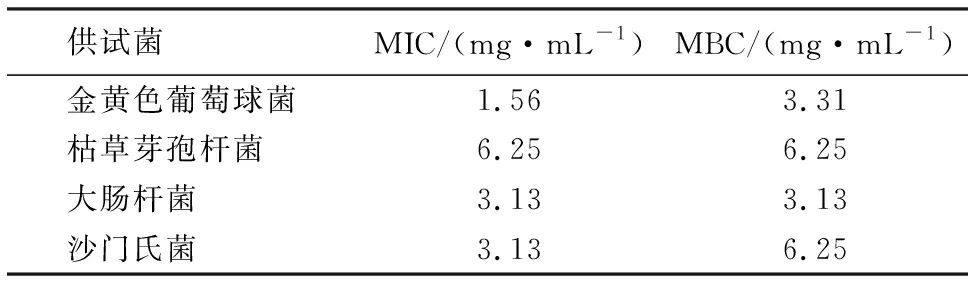
表1 石莼醇提物对4种菌MIC、MBC的影响Table 1 MIC and MBC of U.lactuca ethanol extracts against 4 bacteria
2.2 4种菌的生长曲线
图1显示:4种菌的对照组均具有正常的生长曲线,即有明显的对数生长期,均在18 h后进入稳定期;而加入石莼醇提物后,4种菌的生长曲线均发生明显变化.当石莼醇提物的浓度为1/2×MIC时,枯草芽孢杆菌、沙门氏菌、金黄色葡萄球菌、大肠杆菌分别依次延迟至第6、10、12、14小时才开始缓慢生长,且进入稳定期后菌体数目均分别极显著低于对照组(P<0.01),表明菌体生长受到明显抑制;当石莼醇提物浓度为1×MIC时,4种菌均无生长曲线,即D600 nm无变化,表明无菌体生长现象,证实了石莼醇提物对4种菌均具有优异的抑制作用.同样,董晓敏[15]制备的葡萄籽原花青素也具有高效抑制菌体生长的作用,推测是由于在培养初期加入抑菌液,其分子吸附在细菌表面,形成分子膜,阻碍了营养物质进入细菌体内从而抑制了细菌为增殖期准备的相关产物的合成.
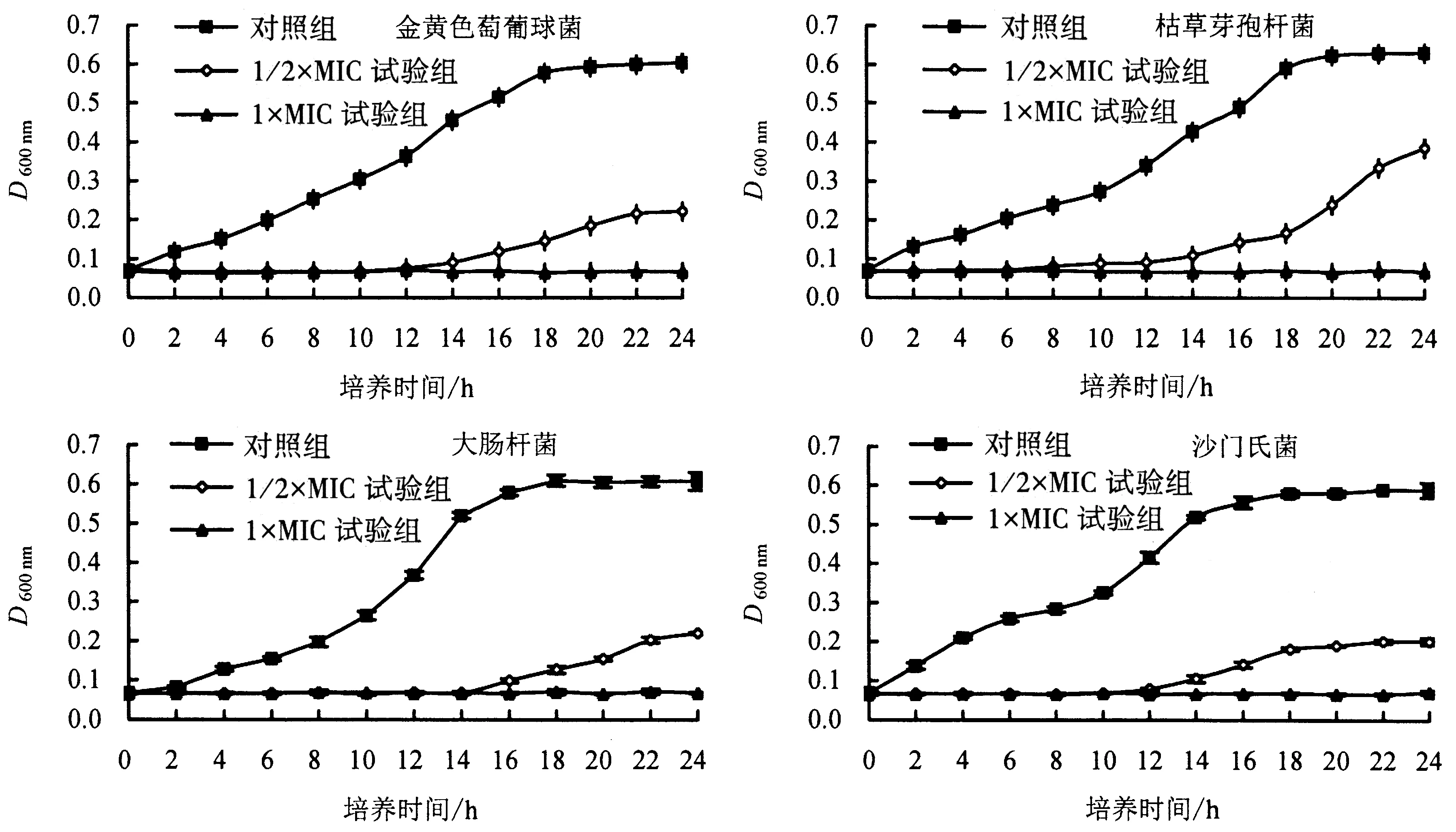
图1 不同处理下4种菌的生长曲线Fig.1 Effects of U.lactuca ethanol extracts on the growth of bacteria
2.3 石莼醇提物对菌体细胞膜完整性的影响
2.3.1 4种菌培养液的电导率 生物细胞膜受损可使其通透性增大,细胞渗透压失衡,胞内电解质外泄,导致其培养液的电导率上升.图2显示:4种菌在石莼醇提物的作用下,其培养液中的电导率均极显著提高(P<0.01),并在3 h后基本趋于稳定;而对照组培养液的电导率仅有略微增加,这可能是由细菌正常死亡所造成的.处理3 h时,1×MIC试验组中金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、沙门氏菌培养液的电导率比对照组分别提高了1.07、0.85、1.10、0.82倍,2×MIC试验组比对照组分别提高了1.95、1.77、1.92、1.73倍.综上,石莼醇提物可极显著提高4种菌细胞膜的通透性(P<0.01),且效果与其质量浓度呈正相关关系.

图2 石莼醇提物对4种菌培养液电导率的影响Fig.2 Effects of U.lactuca ethanol extracts on the conductivity of bacteria
2.3.2 菌体核酸、蛋白质的泄露量 正常菌体的核酸、蛋白质等大分子物质存在于细胞内,而细胞膜受损则造成膜通透性增大,进而导致胞内的生物大分子物质外泄,因此通过测定培养液中核酸、蛋白质的含量可以了解细菌细胞膜结构的损伤情况.表2显示,经石莼醇提物处理4 h后,4种菌的核酸、蛋白质泄露量呈剂量依赖方式极显著上升(P<0.01).1×MIC试验组中金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、沙门氏菌的核酸泄露量分别是对照组的16、13、14、12倍,2×MIC试验组分别是对照组的34、28、32、26倍;1×MIC试验组中金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、沙门氏菌的蛋白质泄露量分别是对照组的27.91、12.97、17.22、11.13倍,2×MIC试验组则分别是对照组的46.26、28.81、28.51、26.25倍.表明石莼醇提物可通过提高细菌细胞膜的通透性,促进胞内生物大分子外泄,起到抑菌的效果.石莼醇提物对金黄色葡萄球菌细胞膜的破坏效果最好,抑制作用最强,对大肠杆菌的抑制效果次之,而对枯草芽孢杆菌、沙门氏菌的抑制效果较弱,这与本研究对菌体培养液电导率的测定结果一致.
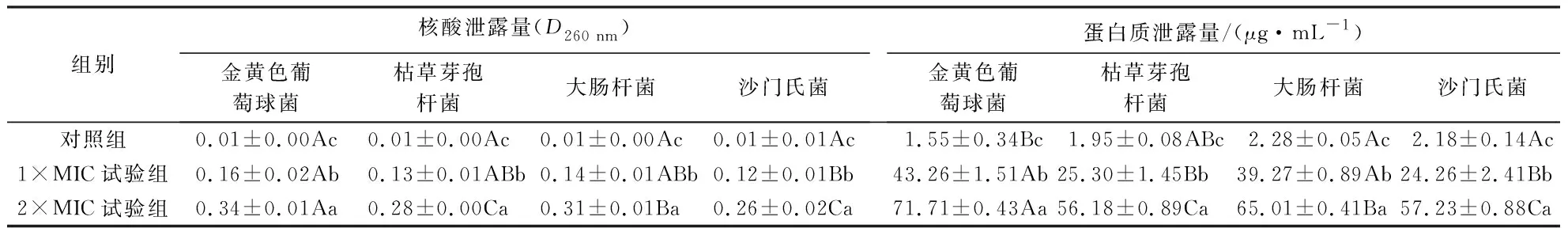
表2 石莼醇提物对4种菌核酸、蛋白质泄露量的影响1)Table 2 Effects of U.lactuca ethanol extracts on nucleic acid and protein leakage of bacteria
2.3.3 菌体损伤率 当菌体细胞膜受损时,荧光探针PI能够穿过受损细胞膜进入细胞内将其核酸染色,利用流式细胞仪可对染色菌体进行定量分析,显示菌体的损伤率.根据4种菌对石莼醇提物的敏感性,选取最具代表性的金黄色葡萄球菌进行进一步研究.从图3可以看出:对照组的金黄色葡萄球菌基本无PI荧光信号(菌体损伤率为0.05%),表明细胞膜结构完整,PI无法进入细胞内;1×MIC试验组的菌体损伤率为24.67%;2×MIC试验组的菌体损伤率则高达96.42%,表明该组菌体细胞膜损伤严重,绝大部分菌体都被PI染色.
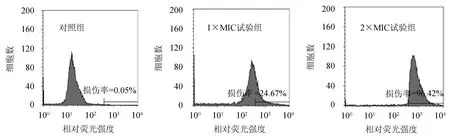
图3 石莼醇提物对金黄色葡萄球菌细胞损伤率的影响Fig.3 Effect of U.lactuca ethanol extracts on cell damage rate of S.aureus
结合“2.3.1”、“2.3.2”结果可知,石莼醇提物呈剂量依赖方式破坏供试菌细胞膜的完整性,导致胞内物质外泄,菌体无法生长繁殖,这与莲子B型寡聚原花青素对大肠杆菌的作用效果[16]类似.据报道,多酚可通过多个侵入性靶点破坏细菌细胞膜的完整性,起到抑菌或杀菌的作用:如能螯合细菌细胞外膜的二价阳离子,释放脂多糖,增大膜通透性;能与细胞膜磷脂双分子层高度结合,降低膜的流动性,并在细胞膜上形成孔道,导致胞内物质渗漏;此外还能与细菌外膜蛋白相互作用,使其沉淀变性,破坏细胞膜物质运输等功能[17-19].
2.4 菌体超微结构
扫描电镜下可观察到金黄色葡萄球菌体细胞表面形态的变化.对照组的菌体呈饱满球状,表面均一光滑,为典型球菌形态(图4a);1×MIC试验组中有部分菌体表面粗糙出现褶皱,胞外附有少量内容物(图4b);而2×MIC试验组的菌体细胞膜严重萎缩,丧失其固有形态,部分菌体出现孔洞,导致大量胞内物质外泄(图4c).

a~c表示与其对应区域A~C的局部放大.图4 金黄色葡萄球菌的扫描电镜图(30 000×)Fig.4 Scanning electron microscope images of S.aureus(30 000×)
透射电镜下可观察到金黄色葡萄球菌体细胞膜及其内部结构的变化.对照组的菌体形态正常,细胞膜完整并与细胞壁界限分明,细胞质分布均匀(图5a);1×MIC试验组的菌体仍保持球菌基本形态,但部分菌体的细胞膜与细胞壁界限开始出现模糊、细胞质分布不均匀、局部细胞质密度下降,呈逐渐透明等现象(图5b);在2×MIC试验组中,菌体严重萎缩,细胞质密度显著下降,部分菌体因细胞膜破裂而崩溃,致使胞内物质大量泄露(图5c).
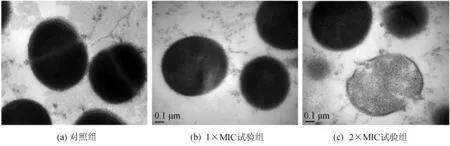
图5 金黄色葡萄球菌的透射电镜图(50 000×)Fig.5 Transmission electron microscope images of S.aureus(50 000×)
结合图4、图5可知,金黄色葡萄球菌在不同质量浓度石莼醇提物的作用下,其菌体内部和外部结构均受到不同程度的破坏,且石莼醇提物与菌体受损程度呈明显的量—效关系,推测石莼醇提物中的多酚可使菌体细胞膜组分溶解与转变,导致离子稳态失衡,致使细胞膜疏松粗糙甚至破裂瓦解,胞内物质大量外泄,菌体细胞失水萎缩,最终丧失生长、繁殖能力.此结果与丁香酚对金黄色葡萄球菌的作用[20]类似,可使菌体细胞膜表面出现孔洞,直接导致细胞膜崩溃瓦解;但与石榴皮鞣质对金黄色葡萄球菌的作用[21]有所差别,石榴皮鞣质仅能改变菌体外膜形态,使其表面塌陷,并未造成细胞膜破裂.
3 结论
细胞膜是细菌细胞的重要组织结构,具有保护菌体内部环境稳定、调节物质进出等功能;当细胞膜遭到破坏时,菌体渗透压失衡、代谢紊乱,最终导致其丧失生长、繁殖的能力.本研究结果表明,石莼醇提物对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、沙门氏菌均有一定的抑制作用,对4种菌的MIC、MBC均为1.56~6.25 mg·mL-1,尤以对金黄色葡萄球菌的抑制效果最好.进一步研究结果显示,2×MIC的石莼醇提物能够破坏绝大部分供试菌体细胞膜的完整性,致使细胞膜上出现孔道,导致核酸、蛋白质大量外泄,胞外电解质浓度增加,电导率显著上升;PI染料进入破损菌体细胞内对核酸染色的结果显示,菌体损伤率高达96.42%;通过扫描电镜、透射电镜直观观察到供试菌体形态变化显著,细胞膜严重皱缩乃至破裂,胞内物质大量泄露.因此,本研究认为细胞膜是石莼醇提物发挥抑菌作用的重要位点.近年来多项研究表明,植物多酚可通过抑制细胞壁、细胞膜及核酸、蛋白质的合成,抑制能量代谢等途径单独或者协同发挥抑菌作用[22].需要说明的是,本研究仅针对细胞膜损伤情况进行探讨,尚未对其他作用性靶点进行研究;此外,在后续研究中可对石莼醇提物的主要成分及结构加以分析、鉴定,以更深入、系统地探讨石莼醇提物的抑菌作用.
