基于转录组学的巨菌草内生链霉菌拮抗玉蜀黍平脐蠕孢的分子机理
2021-10-08黄在兴宋昭昭刘朋虎苏德伟林占熺鲁国东
黄在兴, 宋昭昭, 梅 兰, 李 曼, 刘朋虎, 苏德伟, 林占熺, 鲁国东,2
(1.福建农林大学国家菌草工程技术研究中心;2.福建农林大学植物保护学院,福建 福州 350002)
巨菌草(Pennisetumgiganteumz.x.lin)属于禾本科狼尾草属多年生植物,为典型的碳四植物,其分蘖速度快、根系发达、生物量大、营养丰富、适口性好、内生菌丰富[1-2].因此,巨菌草不仅被广泛应用于栽培食药用菌,制作青贮饲料、微生物菌肥,还被用于发电、崩岗和沙漠生态环境治理、生产沼气和乙醇及造纸等领域[3].
玉蜀黍平脐蠕孢(Bipolarismaydis)是玉米小斑病的致病菌,会对玉米生产造成严重损失[4].近年来,玉米小斑病在我国大部分地区均有发生,轻则降低千粒重,重则导致果穗腐烂、种子发黑、发芽率降低,严重影响玉米的产量和品质[5-6].目前,对玉米小斑病的防治主要采用化学药剂和选育抗病品种等手段,但病原菌容易产生变异,防治效果不理想[4].为了解决粮食生产和环境安全问题,实现农业可持续发展,采用内生菌拮抗玉蜀黍平脐蠕孢成为防治玉米小斑病的一个重要研究方向.内生菌可以作为生防菌,防治多种病害,植物内生真菌的防病作用机制主要包括分泌抗菌物质、与病原物竞争营养和生态位、诱导植物抗性等.
本课题组前期已证实巨菌草内生链霉菌(Streptomycessp.)对玉蜀黍平脐蠕孢有较好的拮抗作用[7],但具体的作用机制尚不明确.因此,本研究采用RNA-seq对玉蜀黍平脐蠕孢在链霉菌发酵液胁迫和无发酵液条件下的转录组进行测序,对表达差异基因进行Gene Ontology(简称GO)功能和KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析,结合表达量和表达倍数的差异以及关键途径,挖掘关键基因,分析巨菌草内生链霉菌拮抗玉蜀黍平脐蠕孢的机制,为今后玉米小斑病的生物防治奠定理论基础,同时为巨菌草内生链霉菌的抗菌机制的研究提供基础数据.
1 材料与方法
1.1 材料
巨菌草内生链霉菌由福建农林大学国家菌草工程技术研究中心从巨菌草健康叶片中分离保存,采用改良高氏一号培养基传代培养,28 ℃培养5 d.
玉蜀黍平脐蠕孢由福建农林大学国家菌草工程技术研究中心分离保存,采用马铃薯葡萄糖琼脂(PDA)培养基传代培养,28 ℃培养3 d.
1.2 方法
1.2.1 内生链霉菌发酵液的制备 将内生链霉菌接种于马铃薯葡萄糖水(PDB)培养基中,28 ℃、180 r·min-1条件下培养5 d.使用旋转蒸发仪浓缩内生链霉菌发酵液,旋转瓶内每次添加发酵液约瓶容积的1/3,压强0.09 MPa,温度55 ℃,将内生链霉菌发酵液300 mL减压蒸馏浓缩至10 mL.用0.22 μm无菌过滤器对发酵液进行过滤消毒,4 ℃冰箱避光保存.
1.2.2 内生链霉菌发酵液胁迫处理 将病原菌接种于100 mL PDB培养基中,每瓶加入2 mL灭菌的链霉菌发酵液(S组).以没加发酵液的培养基为对照(CK组),每组3个重复.28 ℃、180 r·min-1条件下培养3 d.无菌条件下收集菌丝后立刻采用液氮速冻,后保存于-80 ℃冰箱.
1.2.3 RNA提取与反转录 使用Omege soil RNA Kit提取总RNA,分别通过Nanodrop和Agilent 2100检测RNA纯度(D260 nm/D280 nm、D260 nm/D230 nm)及RNA片段长度.RNA样品检测合格后用带有Oligo(dT)的磁珠富集mRNA,随后以mRNA为模板,用六碱基随机引物进行反转录,合成cDNA.
1.2.4 cDNA文库构建 利用AMPure XP beads纯化双链cDNA,然后进行末端修复、加A、加接头.再通过AMPure XP beads选择双链cDNA片段大小,最后进行PCR扩增以构建cDNA文库.每个处理取3个生物学重复的RNA样品进行混合,用于RNA-Seq转录组测序.
1.2.5 测序片段的组装与功能注释 利用Illumina HiSeq 4000高通量测序平台对文库进行转录组测序.下机数据(raw data)一般含有少量低质量的reads,会对后面分析造成影响,所以去除带有测序接头(adapter)、N(不确定碱基)含量≥10%和低质量碱基(Q≤20)含量大于50%的reads.用Tophat2软件比对测序序列和转录组参考序列,随后利用Cufflinks软件组装比对结果[8],对测序结果进行RNA-Seq相关性检查.采用HTSeq软件分析各样品的基因表达水平(以FPKM=1作为判断基因是否表达的阈值,只分析FPKM>1的基因),并使用DESeq分析差异表达基因(差异基因筛选的标准为q<0.05)[9-10].通过GOseq软件对差异表达基因进行GO富集分析,将测序结果与KEGG数据库比对以分析其Pathway显著性,并对差异表达基因进行功能注释和分类[11].
1.2.6 qRT-PCR验证 通过两个样本转录组测定与KEGG通路查找,随机分析氨基酸生物合成、RNA转运等通路中5个差异表达基因的表达情况,利用相对定量qRT-PCR验证结果.用Primer 5软件设计引物(引物见表1).将各RNA样品采用第一链cDNA合成试剂盒反转录为cDNA,以反转录产物为模板、18S rRNA基因为内参基因,采用全式金公司的SYBR Green RT-PCR试剂盒,通过CFX ConnectTMOptics module qPCR系统(美国Bio-Rad公司)对各基因进行荧光定量检测.反应体系为20 μL:正、反引物各0.5 μL,cDNA 1 μL,2×TaqRT-PCRMix 10 μL,ddH2O 8 μL.扩增程序:95 ℃预变性5 min,94 ℃变性15 s,60 ℃退火30 s,72 ℃延伸25 s,40个循环,72 ℃最终延伸5 min.各样品中每个基因重复3次.按2-ΔΔCt定量计算相对表达量[12].
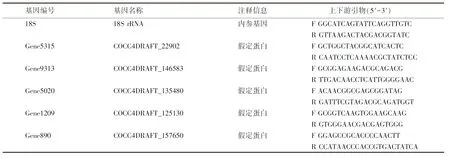
表1 实时荧光定量PCR所用的引物Table 1 Primers used in real-time quantitative PCR
2 结果与分析
2.1 转录组测序数据分析
高通量测序共测得133 060 305个raw read pairs,经过质控,得到128 613 786个clean read pairs.从12个样本中均获得了至少2.8 G容量的原始数据,碱基GC含量都在54%左右,错误率指标Q20和Q30分别在95%和90%以上(表2).这说明转录组测序所获数据的质量较好,可用于后续分析.
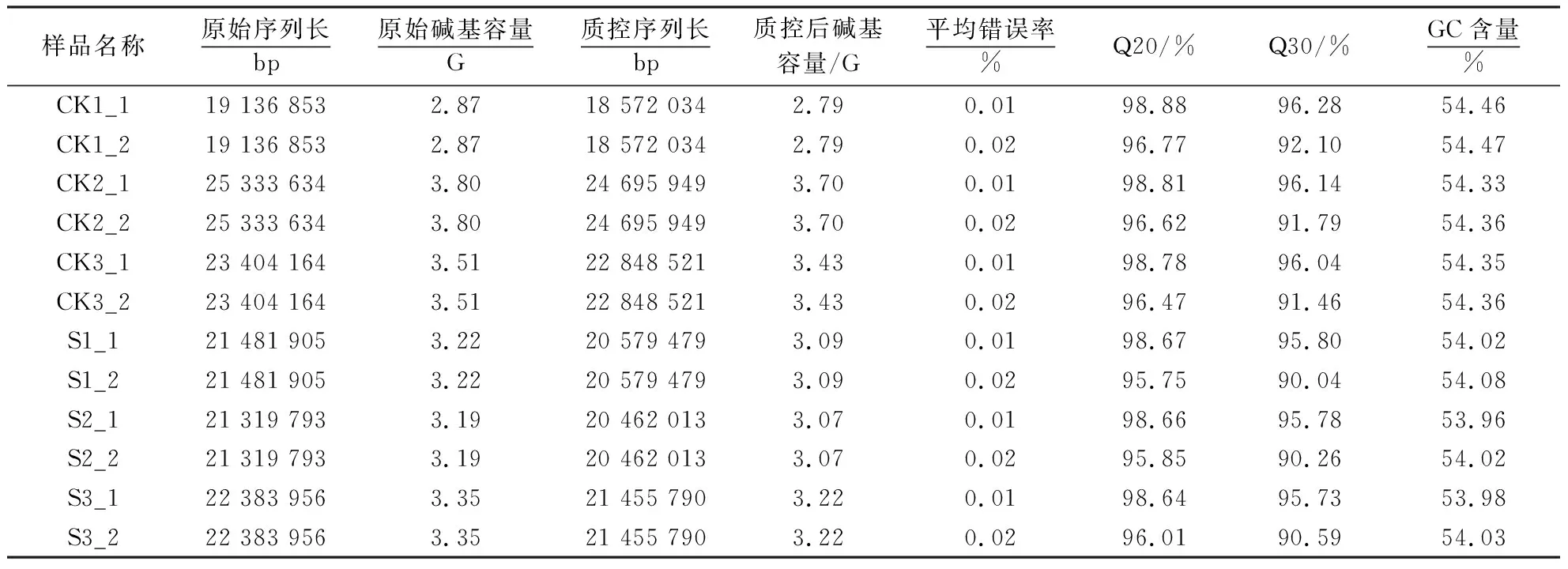
表2 两组样品测序数据及质量检验1)Table 2 Sequencing data and quality test of 2 groups of samples
样品之间表达模式的相似度越高,相关系数(R2)就越接近1.由表3看出,CK与S间的相关系数在0.974左右,说明结果可靠且样本选择合理.
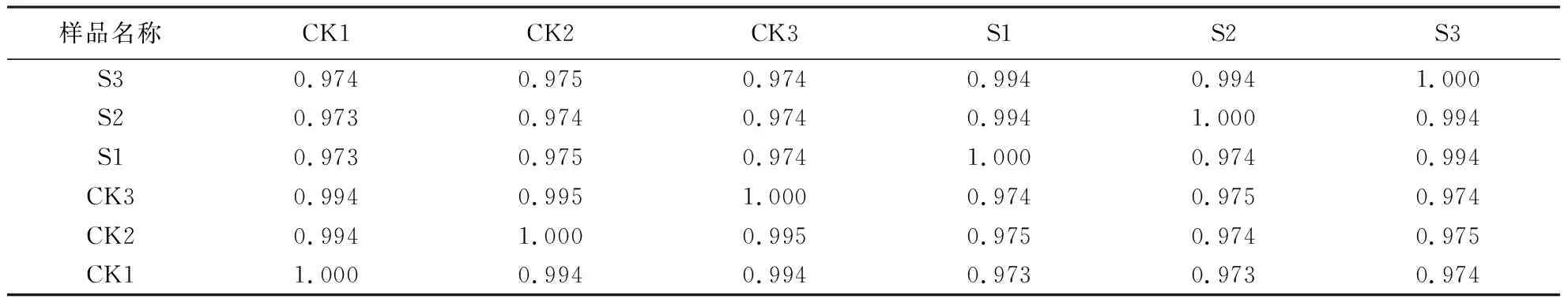
表3 两组样品间的相关系数Table 3 Correlation coefficients between 2 groups of samples
将转录组测序数据与选择的参考基因组进行比对分析,结果如表4所示.两组样品转录组测序获得的序列,能定位到基因组上的序列片段有200 121 858 bp,占比76.81%~78.93%;参考序列上有多个比对位置的序列片段有6 691 576 bp,占比2.39%~2.92%;参考序列上有唯一比对位置的序列片段有193 430 282 bp,占比74.08%~76.53%;比对到基因组上正链和负链的序列片段均有96 715 141 bp,占比均为37.04%~38.27%.能定位到基因组上的序列片段中,分段比对到两个外显子上的序列片段有36 371 164 bp,占比13.90%~14.42%;整段比对到外显子上的序列片段有157 059 118 bp,占比60.08%~62.12%.结果说明所选取的参考基因组合适.
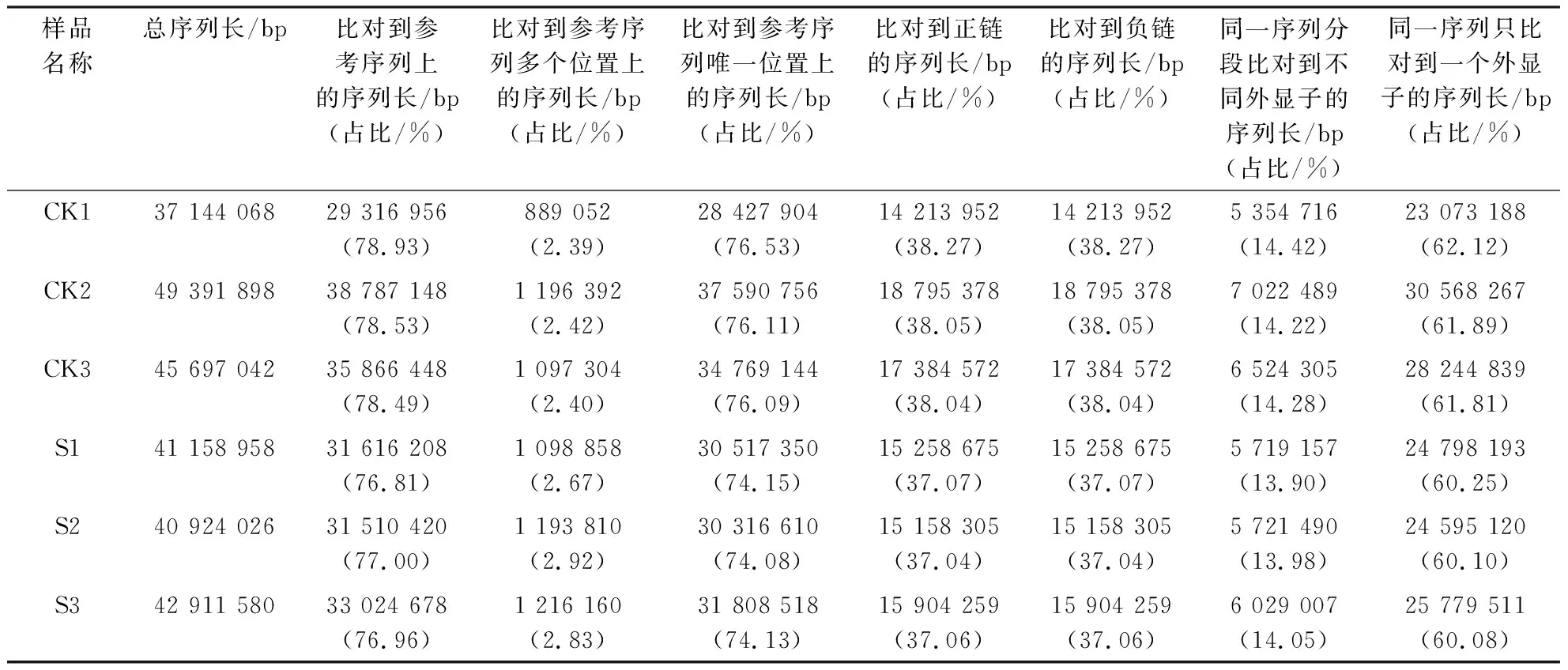
表4 测序数据与参考基因组比对Table 4 Comparison on sequencing data and reference genome
2.2 差异表达基因筛选
S组和CK组比较,共筛选出4 559个差异表达基因.其中,S组相对于CK组上调基因2 276个(图1),占总差异表达基因数的49.9%;下调基因2 283个,占总差异表达基因数的50.1%.上调基因和下调基因数量相当,说明内生链霉菌发酵液对玉蜀黍平脐蠕孢相关基因表达有显著的影响.
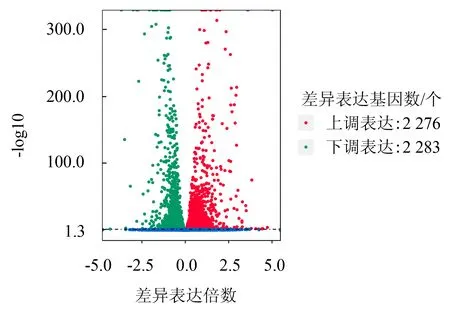
图1 差异表达基因火山图Fig.1 Volcano diagram of differentially expressed genes
2.3 差异表达基因功能注释
2.3.1 GO富集分析 结果显示,共有2 605个差异表达基因被富集到1 976个GO term.对富集最显著的30个GO term作图(图2),可以看出在细胞组分(cellular component)类别中,富集到细胞(cell)、细胞内部分(cell part)、细胞成分组织 (cellular component organization)等的差异表达基因较多;生物过程(biological process)类别中,富集到细胞蛋白代谢(cellular protein metabolic process)、细胞通讯(cell communication)、信号转导(signal transduction)等的差异基因较多;分子功能(molecular function)类别中,富集到核酸结合(nucleic acid binding)、核苷酸结合(nucleotide binding)、基质特异性透膜运输活性(substrate specific transmembrane transporter activity)、底物特异性转运体活性(substrate specific transporter activity)、跨膜转运体活性(transmembrane transporter activity)等的差异基因较多.
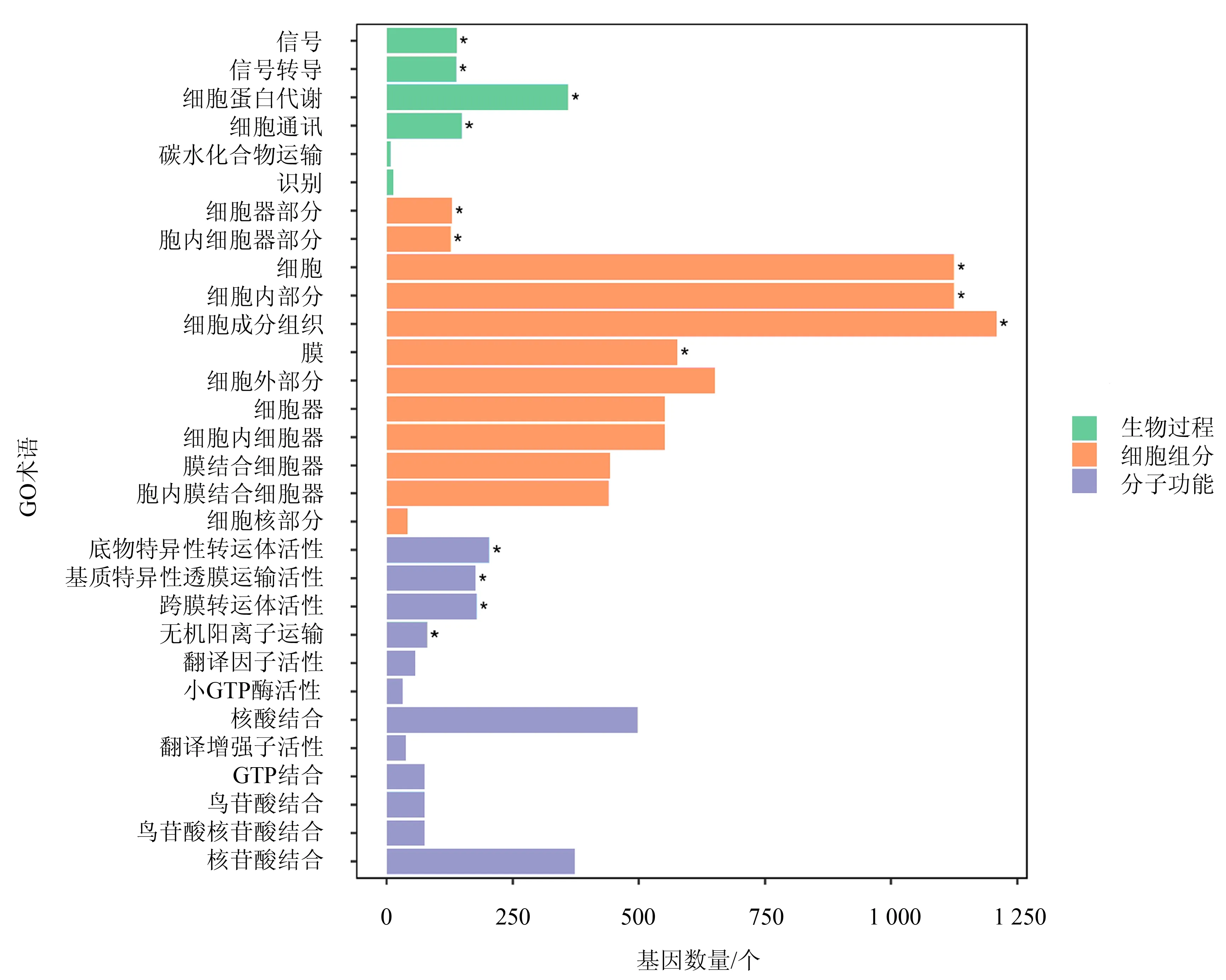
*代表显著富集的GO.图2 差异基因的GO富集柱状图Fig.2 GO functional classification of differentially expressed genes
2.3.2 KEGG富集分析 玉蜀黍平脐蠕孢CK组和S组差异表达基因中共有456个基因被注释到105条KEGG代谢通路中.图3显示了20条富集最显著的通路,主要是次生代谢产物的生物合成(biosynthesis of secondary metabolites),氨基酸的生物合成(biosynthesis of amino acids),酵母促分裂原活化蛋白激酶(MAPK)信号途径(MAPK signaling pathway-yeast),抗生素的生物合成(biosynthesis of antibiotics),嘌呤代谢(purine metabolism),氨酰-tRNA的生物合成(aminoacyl-tRNA biosynthesis),RNA转运(RNA transport),赖氨酸的生物合成(lysine biosynthesis),缬氨酸、亮氨酸和异亮氨酸的生物合成(valine, leucine and isoleucine biosynthesis),内吞作用(endocytosis),维生素B6代谢(vitamin B6 metabolism)等.这些通路大多与玉蜀黍平脐蠕孢生长代谢及其对环境的应激适应相关.
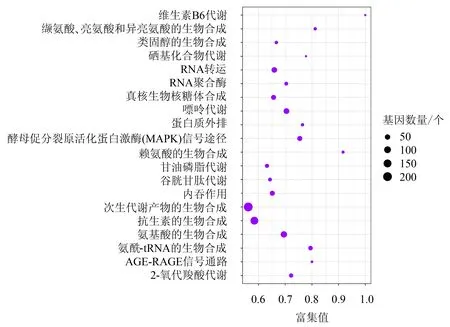
图3 差异表达基因的KEGG功能归类Fig.3 KEGG functional classification of differentially expressed genes
2.4 关键基因的确定及其功能描述
在差异表达基因中,选择表达量高且表达倍数差异显著的基因(read count>20,至少在一个样品中FPKM≥50),结合代谢通路,确定了22个拟关键基因(表5),绝大部分为假定蛋白,主要涉及多个氨基酸的生物合成和代谢.8个涉及氨基酸的合成和降解(其中仅有1个基因表达下调),6个涉及抗生素的合成;gene9313和gene5020涉及RNA运输,gene1147则与氨酰-tRNA的合成有关;下调表达的关键基因主要编码糖苷水解酶与糖基转移酶.此外,本研究还发现一个未被注释到的新基因,编号为Novel00002,其read count在S组中达20 981个,为对照组的8.55倍,推测其在玉蜀黍平脐蠕孢响应内生链霉菌发酵液中具有重要的作用,值得更深入的研究.
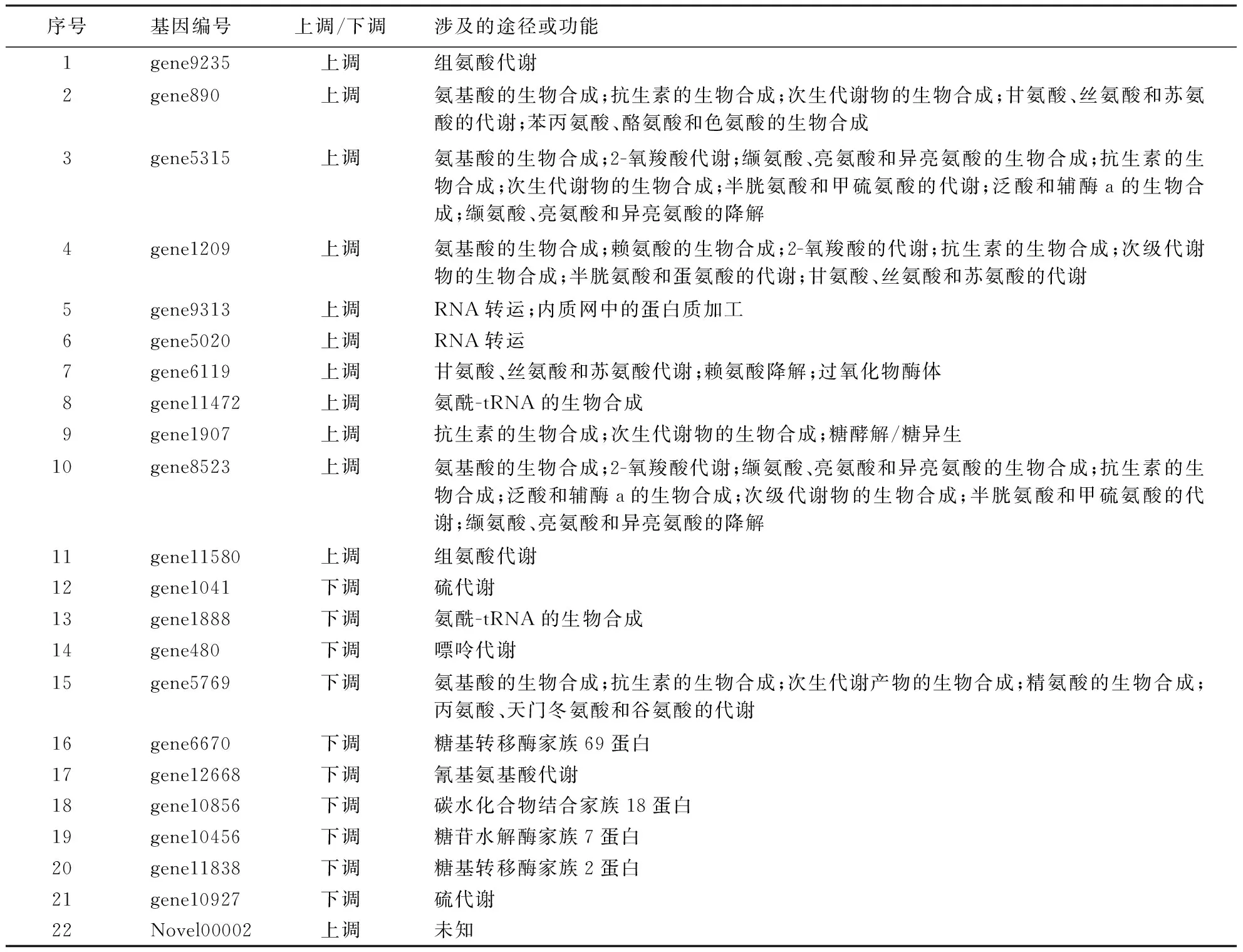
表5 关键基因功能归类Table 5 Function classification of key genes
2.5 差异表达基因的qRCR验证
由图4可以看出,5个基因的表达趋势尽管有些差异,但qPCR检测结果与转录组统计结果基本一致,说明转录组测序数据较为可靠.
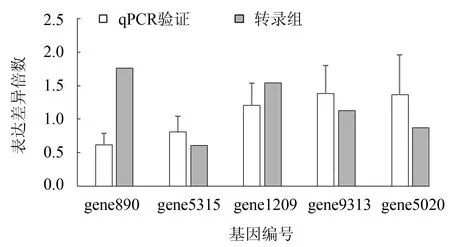
图4 5个差异表达基因的qPCR验证Fig.4 qPCR verification of 5 differentially expressed genes
3 讨论
链霉菌属能够产生淀粉酶、蛋白酶和脂肪酶等,抑制植物多种病原真菌,在植物病害的生物防治中发挥着积极的作用[13-14].本研究对玉米小斑病病原菌玉蜀黍平脐蠕孢在巨菌草内生链霉菌发酵液胁迫和无发酵液条件下的转录组进行测序分析,发现4 559个差异表达的基因,其中试验组相对于对照组上调基因2 276个,下调基因2 283个,差异表达基因大部分涉及氨基酸生物合成、酵母MAPK信号通路、嘌呤代谢等通路,与信号转导、细胞蛋白质代谢过程、细胞交流等生物过程相关.在GO富集中,富集到细胞组分的差异基因数量明显多于富集到生物过程和分子功能的数量,这表明巨菌草内生链霉菌发酵液对玉蜀黍平脐蠕孢细胞相关基因的影响较大.有研究发现,青霉TS67菌株的发酵液和苍白杆菌属细菌YB01的培养液通过影响细胞壁、浓缩原生质体和细胞质抑制玉蜀黍平脐蠕孢菌的生长[15-16];链霉菌属StreptomycesphilanthiRM-1-13产生的挥发性物质能够通过破坏立枯丝核菌(Rhizoctoniasolani)PTRRC-9的细胞壁达到抑菌效果[17].本试验中,巨菌草内生链霉菌菌株也可能存在相似的作用机理.
蛋白质是组成生命体的重要成分,是维持机体生长和发育的关键物质基础,而氨基酸是大分子蛋白质的基本组成单位,又是许多重要代谢途径的重要中间体,机体对蛋白质的需求本质上是对氨基酸的需求[18-19].链霉菌属是产抗生素的最大一类属[20],Svidritskiy et al[21]从产色链霉菌(S.griseochromogenes)培养液中提取的抗生素能够作用于稻瘟菌的核糖体,干扰核糖体肽键的形成,使稻瘟菌的蛋白质合成受阻,从而抑制稻瘟菌的孢子萌发和菌丝生长.本研究中,在氨基酸生物合成通路中82个基因对发酵液胁迫具有响应,占比69.5%,其中78个基因上调表达,仅4个下调表达;挑选出的22个拟关键基因中,上调表达的关键基因主要涉及多种氨基酸的生物合成与代谢,而下调表达的关键基因主要编码糖苷水解酶蛋白家族和糖基转移酶蛋白家族.糖基转移酶的主要功能是催化生物体内的活性糖与不同受体连接,以形成各种生物学功能的糖基化产物[22].由此推测玉蜀黍平脐蠕孢可能通过激活氨基酸生物合成途径相关基因和减少糖苷分解的方式来响应内生链霉菌发酵液的胁迫,同时,内生链霉菌发酵液可能通过干扰玉蜀黍平脐蠕孢的氨基酸合成而实现抑制作用.有学者认为,低浓度抗真菌活性物质会引起病原真菌的代偿性应激反应,通过激活相关信号通路基因缓解外源物对自身的毒害[23].本研究结果显示,氨基酸相关通路的基因绝大部分表达上调,说明玉蜀黍平脐蠕孢也存在代偿性应激反应.
MAPK信号通路中有43个基因对发酵液胁迫具有响应,占比75.4%,其中37个下调表达,仅6个上调表达,这说明内生链霉菌发酵液对玉蜀黍平脐蠕孢MAPK信号通路的影响较大.MAPK级联途径是真核生物中普遍存在的信号转导模式,可参与调控真菌的菌丝生长和致病性等多种生命过程,并在不同的过程中均发挥着至关重要的作用[24].本课题组前期证实巨菌草内生链霉菌菌株的发酵液能够有效抑制玉蜀黍平脐蠕孢的菌丝生长[7],因此,推测内生链霉菌发酵液通过调控MAPK信号通路相关基因的表达而抑制菌丝生长.
从研究结果来看,玉蜀黍平脐蠕孢众多基因对内生链霉菌发酵液的胁迫有不同程度的响应,说明不同基因对胁迫响应的调节方式不同,但关键基因涉及的途径或功能相对集中.今后可从发酵产物的分离鉴定,发酵液胁迫对病原菌形态、细胞结构的影响,关键基因全长克隆和功能验证等方面进行更深入的研究.
