鸡大肠杆菌噬菌体生物特性的研究及临床应用
2021-10-07许方方李凤华王玉霞李梁梁
许方方,李凤华,王玉霞,李梁梁
(山东迅达康兽药有限公司,山东济南250316)
耐药性的加剧,无抗养殖的实施,噬菌体作为细菌的“天敌”发挥着不可替代的作用。噬菌体(bacteriophage,phage)是能够侵染细菌的病毒,但对非靶向的细菌是无毒的,针对目标菌株,可以渗透或者破坏生物膜[1]。生物圈中普遍存在着噬菌体,既可以特异性的靶向裂解细菌,也可以通过基因突变的技术拓展噬菌体的宿主谱。噬菌体分为毒性噬菌体和温和型噬菌体。能与对应的宿主细胞在短时间内完成吸附、侵入、合成、成熟和释放复制周期的噬菌体,称为烈性噬菌体;温和噬菌体能感染宿主菌,但并不能增殖,不引起细胞的裂解,但其基因整合于细菌染色体从而复制给子代[2]。大量研究表明,肠道内的噬菌体与细菌存在微生物菌群动态平衡的关系,毒性噬菌体能够保护宿主抵抗外来病原菌的入侵,维持肠道健康[3-6]。
噬菌体可以侵染细菌,治疗很多细菌性疾病。研究表明,噬菌体可以治疗是由产肠毒素大肠杆菌感染引起的仔猪腹泻,并且取得了显著的疗效[7-8]。Tanji等[9]用3株广谱噬菌体做成混合制剂,成功裂解了E.coliO157∶H7菌;同样混合制剂治疗被E.coliO157∶H7感染的小鼠,小鼠肠道的感染菌完全裂解。此外,使用噬菌体和生理盐水分组治疗经大肠杆菌感染的小鼠,结果显示,噬菌体治疗组全部存活,而生理盐水组全部死亡[10]。本实验室前期从养鸡场采集粪便,分离的大肠杆菌噬菌体已对噬菌谱进行研究,发现对大肠杆菌血清型O1和O2有裂解能力。为进一步验证噬菌体治疗禽大肠杆菌发挥的作用,本试验选取分离的噬菌体对其生物特性和临床治疗进行研究,为噬菌体临床治疗禽大肠杆菌病提供参考。
1 材料与方法
1.1 试验材料
1.1.1 宿主菌和噬菌体
实验室使用的大肠杆菌血清型O1购自中国兽医微生物菌种保藏管理中心(保藏号:CVCC1343);所用噬菌体为鸡场粪便分离纯化的噬菌体。
1.1.2 培养基
LB液体培养基(1 L):Tryptone 10 g、Yeast E tract 5 g、NaCl 10 g。
LB半固体和LB固体(1 L)培养基在LB液体培养基基础上再分别加Agar 7.5 g和15 g、生理盐水、HCl试液、1 mol/L NaOH溶液和过氧乙酸等。
1.1.3 仪器设备
YXQ-75S11自动蒸汽灭菌锅(上海博迅实业有限公司医疗设备厂)、SW-CJ-1F超净操作台(苏州安泰空气技术有限公司)、GHP-9160恒温培养箱(上海一恒科学仪器有限公司)、HZQ-X300C恒温摇床(上海一恒科学仪器有限公司)、H1750R离心机(长沙高新技术产业开发区湘仪离心机仪器有限公司)、微量移液器、培养皿、一次性0.45μm和0.22μm微孔针式过滤器、灌胃针、鸡笼等。
1.1.4 试验动物与日粮
1日龄白羽肉鸡购自山东泰安孵化场;日粮购自新希望六和禹城分公司。
1.2 试验方法
1.2.1 生物学特征
利用双层琼脂平板法研究噬菌体的pH值、热稳定性、生长曲线和最佳感染复数的生物学特征。下层板:灭菌的LB固体培养基冷却至55℃,使用10 mL注射器吸取10 mL LB至平板中冷却凝固。上层板:100μL稀释的噬菌体、500μL宿主菌于试管(二者37℃水浴5 min混合后)中再加入45°C的5 mL LB半固体培养基,三者混合后,到入铺有培养基的平板内,凝固,倒置放37℃恒温培养箱中培养18~24 h。
噬菌体pH值稳定性:取灭菌后的20 mL LB液体培养基9瓶,用HCl试液和1 mol/L NaOH溶调pH值分别为3、4、5、6、7、8、9、10、11。从每瓶中分别取0.9 mL至无菌的EP管中,放入37°C恒温水浴锅中8 min,在加入0.1 mL噬菌体(109PFU/mL),再放37°C水浴锅恒温作用45 min。再从各EP管中取0.1 mL做10倍梯度稀释,用双层板法测定噬菌体效价。
噬菌体热稳定性:各取噬菌体原液1 mL分装于无菌EP管中,分别置于15、25、30、40、50、60℃恒温水浴锅中,保温静置90 min,分别在30、60、90 min时间点取0.1 mL,液体冷却至室温后,做10倍梯度稀释,用双层板法检测噬菌体效价。
噬菌体感染复数:分别取宿主菌O1培养至OD值为0.6菌悬液0.5 mL,再取稀释不同倍数的噬菌体裂解液各0.5 mL,使其感染复数(MOI)分别为0.001、0.01、0.1、1、10和100,混合均匀,从各混合液中取0.5 mL加入50 mL LB培养液中,37℃、150 r/min振荡培养6 h,4°C、8 000 r/min离心20 min,经0.22μm微孔滤膜过滤,得到噬菌体裂解液利用双层板法测其效价。
噬菌体一步生长曲线:指定量记载噬菌体生长规律所绘制的曲线,从曲线中清晰地看出噬菌体的潜伏期、裂解期和平稳期。加入MOI为0.1的噬菌体液和O1宿主菌至LB液体培养基中,37℃恒温水浴15 min,10 000 r/min离心5 min,取沉淀使用37℃LB液体培养基洗涤2次,取离心的沉淀加入37℃LB液体培养基10 mL,混匀,37℃恒温摇床150 r/min培养,从0 min开始每隔15 min采集液体测效价,直到135 min。以感染时间为横坐标,效价为纵坐标绘制噬菌体的一步生长曲线。
攻毒菌液的制备:取25%甘油保存的大肠杆菌血清型O1 0.5 mL加入灭菌后的50 mL LB液体培养基中,37℃恒温摇床150 r/min培养12 h。采用平板计数法测定菌液的浓度。根据菌液的浓度,使用生理盐水将菌悬液稀释为4个梯度,分别为5.0×107、1.0×108、3.0×108、5.0×108PFU/mL。
攻毒方式:参考文献[11]选择腹腔注射的方式进行攻毒。选取50只健康、7日龄817肉鸡,平均分为Gl、G2、G3、G4和对照组,每组8只。每只肉鸡分别注射0.3 mL/只制备好的菌液,对照组注射0.3 mL生理盐水。攻毒前,禁食、禁水12 h。攻读期间,正常饲喂,周期为7 d。7 d后统计鸡的状态[12](疾病评分标准:0=正常,1=蹲卧、精神不振、采食下降等,2=死亡)。
1.2.3 噬菌体的治疗试验
噬菌体的安全性检测:取制备好的噬菌体裂解液0.1 mL用涂布棒均匀涂在LB固体培养基上,37°C倒置培养18~24 h,检测有无细菌生长。
噬菌体的毒性检测:选取20只雏鸡,分成A和B两组,每组10只,A组每只雏鸡口服1 mL噬菌体(l×1010PFU/mL),B组为空白对照。观察雏鸡是否发病,试验持续至雏鸡10日龄。
噬菌体的防治作用:选取160只7日龄雏鸡随机分为8组,每组20只。攻毒之前,禁食、禁水12 h。试验期间正常饲喂和饮水,定时通风换气、更换垫料。攻毒腹腔注射0.3 mL菌液(菌浓度为2×l08PFU/mL),给药采用攻毒后立即饮水灌喂法0.5 mL和注射法0.2 mL,7 d后记录每组雏鸡发病、治死亡情况及得分。试验设计见表1。

表1 试验设计Tab.1 Experimental design
2 结果与分析
2.1 噬菌体生物活性2.1.1 噬菌体pH值稳定性结果(见图1)
由图1可知,噬菌体在pH值4~9时,均保持较高的活性,效价结果变动不大。
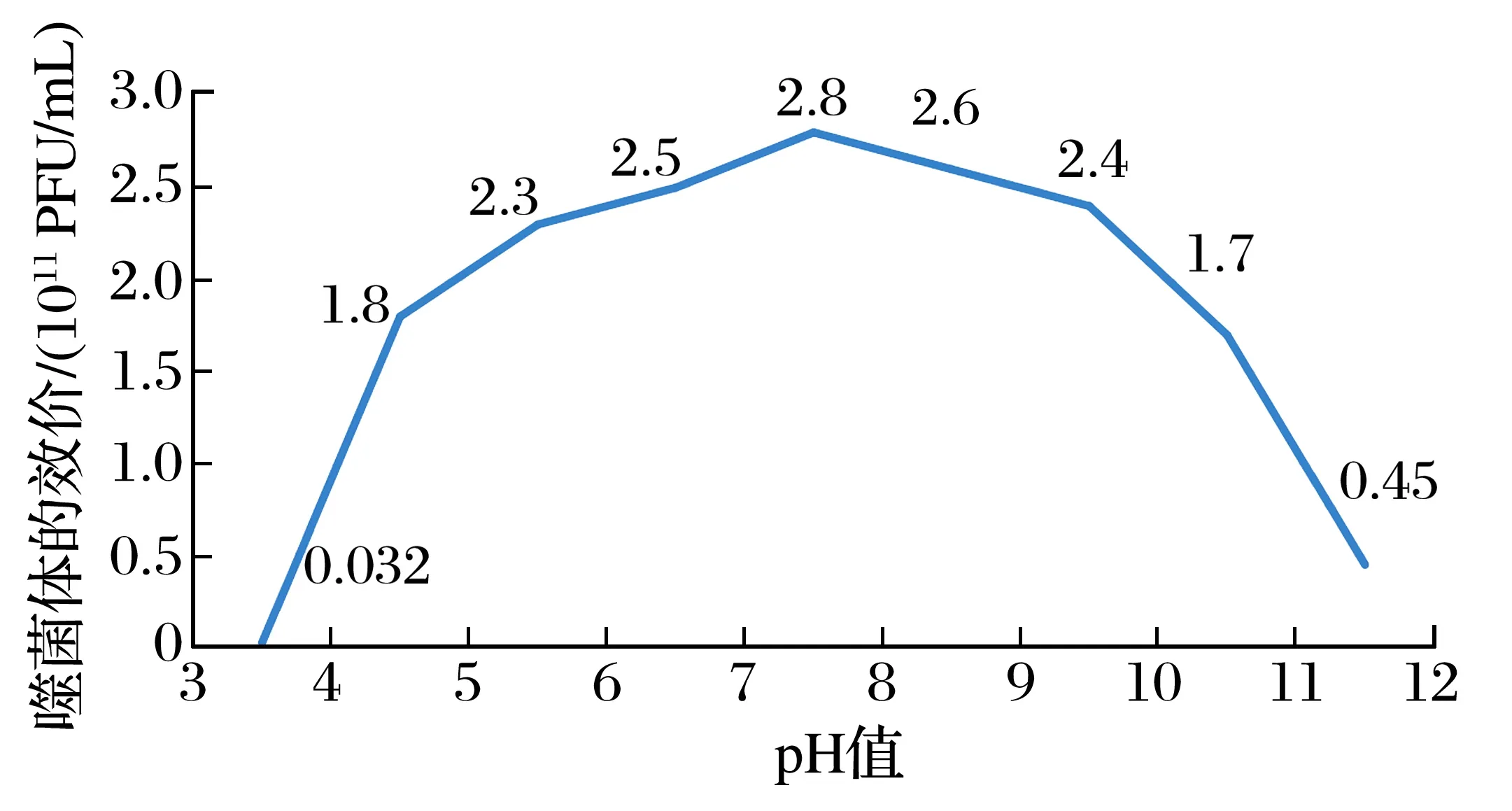
图1 噬菌体pH值稳定性结果Fig.1 Results of pH stability of phage
2.1.2 噬菌体热稳定性结果(见表2)
野外采样在设计点位的引导下实地根据地形和GPS结合的方法进行定点,采用化探采样航迹监控系统对主点、副点、副副点进行监控[17],确保采样到位率。
由表2可知,噬菌体在37℃以下生物活性基本保持不变。但在50℃作用60 min后,原有的活性下降明显,特别是在60℃作用90 min后,只能看到个别噬菌斑,说明噬菌体不易在高温下储存。
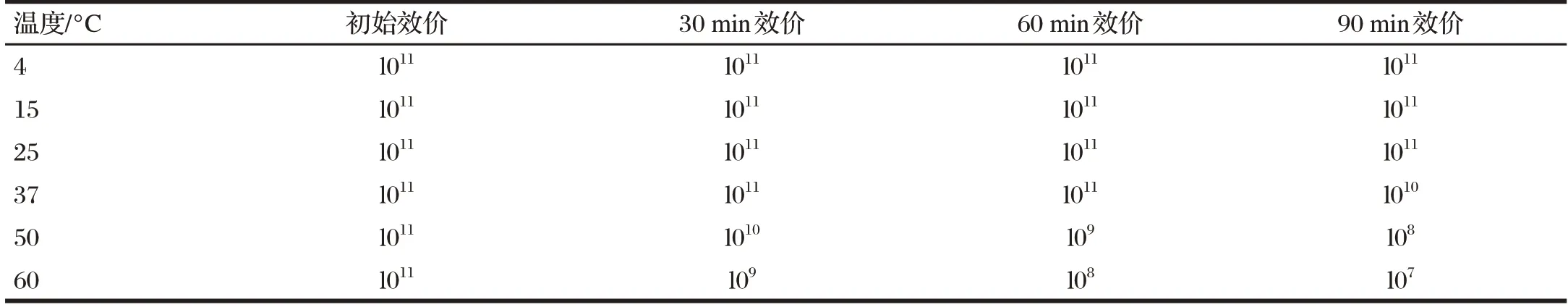
表2 噬菌体热稳定性结果Tab.2 Stability of phage under different temperature 单位:PFU/mL
2.1.3 噬菌体感染复数结果(见图2)
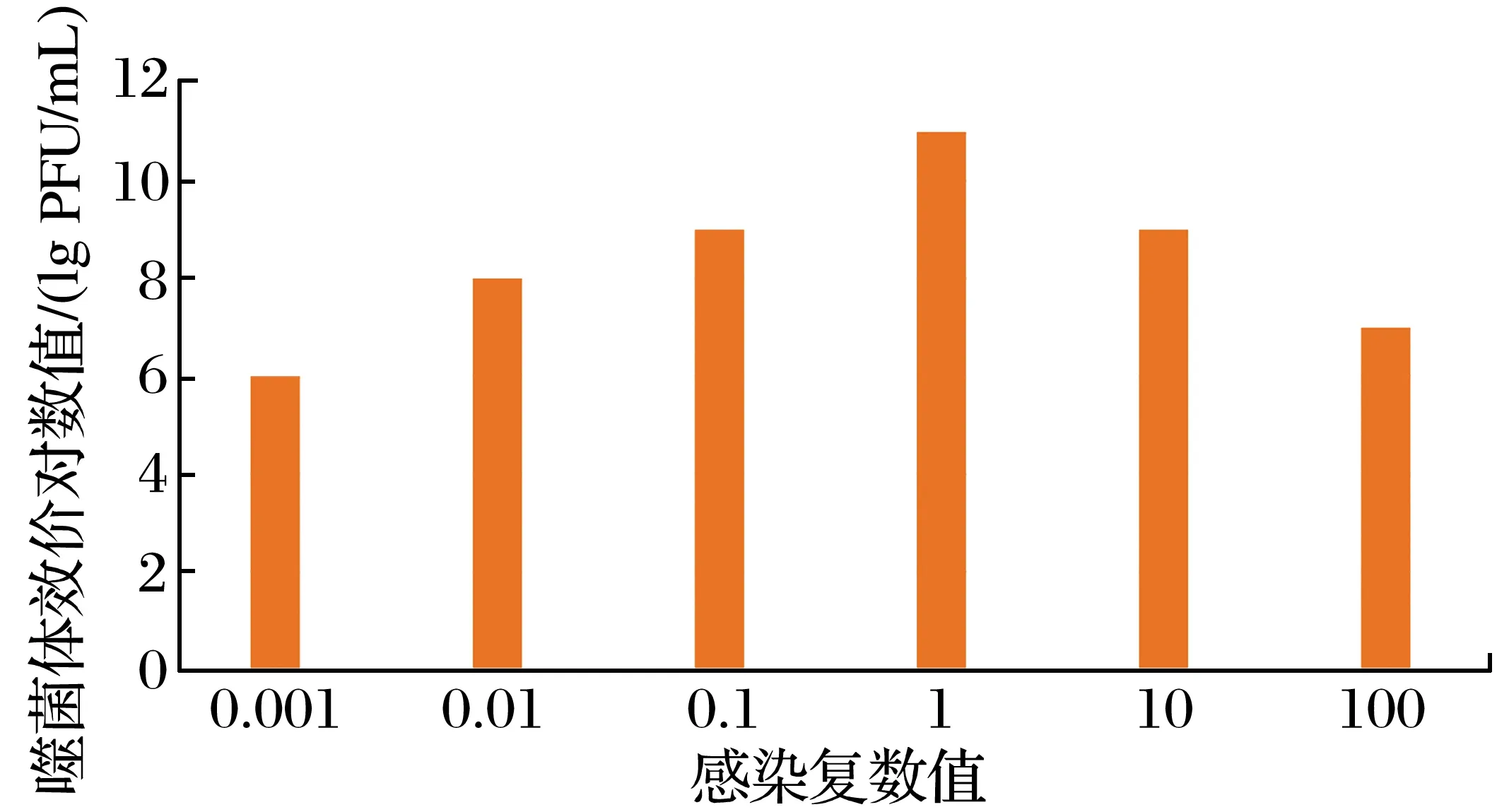
图2 噬菌体感染复数结果Fig.2 Results of phage multiplicity of infection
由图2可知,通过双层板琼脂平板法测定大肠杆菌噬菌体的MOI是1,测得滴度是3.0×1011PFU/mL。
2.1.4 噬菌体一步生长曲线结果(见图3)
由图3可知,在0~15 min内噬菌体数量无增长,在15~75 min内噬菌体的滴度达到2.7×1011PFU/mL处于裂解期,在75~150 min噬菌体的数量几乎未发生改变。由此可知,噬菌体的潜伏期很短,为0~15 min,裂解期很长,为15~75 min。根据这一生物特性能更好地被临床实践所利用。
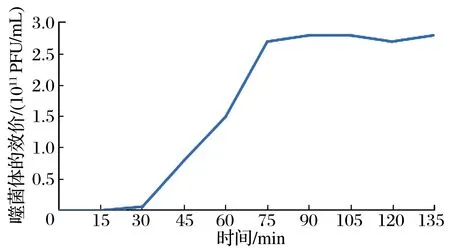
图3 噬菌体一步生长曲线Fig 3 One-step growth curve phage
2.2 攻毒预试验结果(见表3)
由表3可知,7 d后G3组死亡率50%,统计分数9分,G4组死亡率高,且其他鸡精神不振,统计得分11分,综合判断选G3组为攻毒的剂量。

表3 预试验结果Tab.3 Pretest result
2.3 大肠杆菌噬菌体的防治结果
2.3.1 噬菌体的安全性结果
噬菌体安全性检测是用噬菌体裂解液涂在LB平板上,培养3 d无菌落,平板呈透明状。
2.3.2 噬菌体的毒性试验结果
口服噬菌体1 mL的雏鸡1 w内未出现患大肠杆菌病的任何不适症状,且雏鸡存活率是100%。因此,噬菌体裂解液安全可靠,可以用于大肠杆菌病防治试验。
2.3.3 噬菌体的防治试验结果(见表4)
由表4可知,预防组口服噬菌体对鸡感染大肠杆菌病预防效果不明显。原因可能是噬菌体的特异性决定的,提前进入机体的噬菌体在体内无特定的目标菌株可以裂解,不能大量增殖而凋亡,达不到防控的效果[11-12]。口服组对鸡感染大肠杆菌的有一定的治疗效果。口服组随着滴度增加,治疗效果越好,C组、D组和E组的治疗率分别为60%、75%和80%。原因可能是大肠杆菌在鸡体内存留,噬菌体侵入后可以快速繁殖,进而将宿主菌裂解,保护机体免受大肠杆菌的进一步侵害。注射组噬菌体优于口服组治疗,同滴度噬菌体注射组和口服组的治疗率分别是85%和75%。原因可能是攻毒和治疗都采用注射方式,机体吸收的快,二者繁殖过程中相互作用,一定程度上阻止了鸡大肠杆菌病的发生。抗生素组的治疗效果不如口服组和注射组,原因可能是攻毒的大肠杆菌本身携带的耐药性有关。

表4 噬菌体防治试验结果Table 4 Test results of phage prevention and treatment
3 讨论
目前,噬菌体的开发和应用得到业界的肯定,并且在治疗方面取得显著的疗效。本试验首先对噬菌体的生物特性进行研究,生物学特性试验是对噬菌体进行应用性研究的基础,通过对其温度稳定性、pH值稳定性、最佳感染复数以及一步生长曲线的测定,掌握生长特性,在后期的噬菌体治疗鸡感染大肠杆菌病的临床试验中起关键性作用。在噬菌体的防治试验中,通过预防、口服和注射3种途径对鸡大肠杆菌病进行防治试验,发现噬菌体预防对鸡大肠杆菌病所起的效果不大,口服和注射治疗鸡感染大肠杆菌病有很好的治疗效果,明显降低了死亡率,并且注射治疗优于口服治疗。另外,在口服治疗试验中,设置不同的滴度进行治疗,发现随着滴度的升高,降低死亡率的效果越显著,临床试验结论与其他研究人员得出的结论相符[13-14]。临床试验结果显示,大肠杆菌噬菌体的防治效果与给药时间、给药方式和给药剂量有关。虽然噬菌体的治疗效果显著,但是具体治疗机制还需继续研究,而且噬菌体作为一种病毒和生物性治疗剂,可能导致某些毒性基因与耐药基因的扩散等问题[15]。
4 结论
大肠杆菌噬菌体对禽病大肠杆菌预防作用不大,口服和注射对禽病大肠杆菌治疗效果显著,并且注射治疗效果优于口服效果,口服高剂量组比低剂量组治疗效果好。
