睡眠剥夺联合氟西汀对抑郁模型大鼠行为及血清促肾上腺皮质激素、皮质酮的影响
2021-09-30菊轩时雯雯陈松胡希文董介正朱春燕
菊轩 时雯雯 陈松 胡希文 董介正 朱春燕
[關键词] 睡眠剥夺;氟西汀;抑郁;促肾上腺皮质激素;皮质酮
[中图分类号] R852.5 [文献标识码] A [文章编号] 1673-9701(2021)16-0043-05
Effects of sleep deprivation combined with fluoxetine on behavior and serum adrenocorticotropic hormone and corticosterone in depression model rats
JU Xuan1 SHI Wenwen2 CHEN Song1 HU Xiwen1 DONG Jiezheng1 ZHU Chunyan1
1.The Sixth Department of Psychiatry, Hangzhou Seventh People′s Hospital, Hangzhou 310013, China; 2.Department of Science and Education, Hangzhou Seventh People′s Hospital, Hangzhou 310013, China
[Abstract] Objective To investigate the effect of sleep deprivation combined with fluoxetine on behavior, serum adrenocorticotropic hormone(ACTH) and corticosterone(CORT) in depression model rats and its possible mechanism. Methods Sixty adult SD male rats were divided into the normal control group (10 rats) and the stress model group (50 rats).The stress model group underwent 21 days of chronic mild unpredictable stress(CMUS), forced swimming test and sucrose water consumption test. Afterwards, the rats were randomly divided into the depression group, the fluoxetine group, the normal saline group, the sleep deprivation group, and the sleep deprivation + fluoxetine group. They were given single cage, fluoxetine for gavage, normal saline for gavage, 72-hour REM sleep deprivation,72-hour REM sleep deprivation combined with fluoxetine gavage, respectively. 28 days later,forced swimming test and sucrose water consumption test were performed again, and the concentrations of ACTH and CORT in rat serum were determined by ELISA. Results After stress, the immobility time of rats was significantly longer in the stress model group than that in the normal control group,with statistically significant difference(P<0.05), and the sucrose water consumption and sucrose water preference of rats were significantly lower in the stress model group than those in the normal control group, with statistically significant differences(P<0.05). The forced swimming immobility time of rats was significantly lower in the sleep deprivation combined with fluoxetine group than that before treatment, and the difference was statistically significant(P<0.05). Sucrose water consumption and sucrose water preference were significantly higher in the sleep deprivation combined with fluoxetine group than before, and the differences were statistically significant(P<0.05). After 28 days of treatment,the levels of ACTH and CORT were significantly lower in the fluoxetine group, the sleep deprivation group and the sleep deprivation+fluoxetine group than those in the depression group, and the differences were statistically significant(P<0.05). Conclusion Sleep deprivation combined with fluoxetine can improve depressive behavior of depression model rats, and its mechanism may be related to the reduction of ACTH, CORT levels and HPA axis activity.
[Key words] Sleep deprivation; Fluoxetine; Depression; Adrenocorticotropic hormone; Corticosterone
抑郁症是一个全球性严峻的临床和社会问题,是最常见的精神障碍之一,是以持续情绪低落、愉快感缺失、兴趣丧失、思维及认知迟缓等症状为临床表现的疾病。抑郁症的自杀死亡率约是普通人群的20倍[1],WHO已将其列为医疗负担最重的疾病[2]。在我国30个省市进行的最新精神疾病流行病学调查显示,抑郁障碍的年患病率为6.8%,且患病率较前增加明显[3]。虽然新型抗抑郁药物得以广泛地使用,但仍有20%~30%的患者对于药物治疗没有良好的应答,或出现难以耐受的不良反应[4],且伴随严重的自伤、自杀风险。目前的抑郁症治疗手段中,睡眠剥夺可以在24 h内即可观察到较为显著的效果,安全性佳,且没有明显的禁忌证和副反应[5];整夜睡眠剥夺及睡眠时相提前可明显改善难治性抑郁患者的药物疗效[6]。但是睡眠剥夺的快速抗抑郁机制仍不明确。随着生物技术的发展,越来越多的研究表明下丘腦-垂体-肾上腺(Hypothalamic-pituitary-adrenal,HPA)轴的过度活跃是抑郁症重要的病理生理学表现[7]。HPA轴的负反馈调节受大脑、腺垂体激素的共同影响。下丘脑室旁核释放促肾上腺皮质激素释放激素(Corticotropin releasing hormone,CRH),经过垂体门脉系统到达并刺激垂体,后者分泌促肾上腺皮质激素(Adrenocorticotrophic hormone,ACTH),ACTH经血液循环达到肾上腺皮质,分泌大量糖皮质激素(Glucocorticoid,GC),在人体主要是皮质醇,在啮齿类动物主要是皮质酮(Corticosterone,CORT);同时GC作用于下丘脑和垂体,减少ACTH的释放并阻断其兴奋性,形成HPA轴的负反馈调节[8]。本实验旨在通过快眼动睡眠剥夺(Rapid eye movement sleep deprivation,REMSD)联合SSRI类抗抑郁药物氟西汀作用于抑郁模型大鼠,观察大鼠的行为及血清ACTH、CORT浓度的变化,探讨睡眠剥夺联合抗抑郁药物对抑郁模型大鼠的抗抑郁疗效和作用机制。
1 材料与方法
1.1 实验动物
SPF级成年健康SD大鼠60只,雄性,体重230~260 g,上海吉辉实验动物饲养有限公司提供,动物合格证号:SCXK(沪)2017-0012。实验前在实验室环境下适应性合笼饲养1周。
1.2 主要试剂与仪器
盐酸氟西汀片(Fluoxetine hydrochloride tablets,礼来苏州制药有限公司,国药准字J20160029,规格:20 mg×28片),血清ACTH、CORT的ELISA试剂盒(南京建成生物工程研究所),酶标仪(Bio-rad imark),动物运动轨迹跟踪系统(EthoVision XT 13),高速离心机(Thermo X1R),大鼠睡眠剥夺箱。
1.3 动物分组及实验流程
实验大鼠随机分为正常对照组(10只)和应激模型组(50只),对每只大鼠进行第一次强迫游泳实验和蔗糖水消耗实验。正常对照组予以单笼孤养,不进行任何刺激。应激模型组行21 d慢性轻度不可预见性应激(Chronic mild unpredictable stress,CMUS),并进行第2次强迫游泳实验和蔗糖水消耗实验,采用随机分组的方法把应激模型组大鼠分为五组并继续行CMUS,抑郁组、氟西汀组、生理盐水组、睡眠剥夺组、睡眠剥夺+氟西汀组每组10只。抑郁组予以单笼孤养。氟西汀组予以氟西汀灌胃剂灌胃给药,根据人体和大鼠体表面积换算的等效剂量,氟西汀灌胃剂为4 mg/kg(相当于60 kg体重的成年人40 mg/d剂量摄入),1次/d,持续28 d。生理盐水组予以生理盐水灌胃每只大鼠1.5 mL,1次/d,持续28 d。睡眠剥夺组在第1、8、15、22天进行72 h REMSD。睡眠剥夺+氟西汀组在第1、8、15、22天进行72 h REMSD同时持续28 d氟西汀灌胃剂灌胃给药,1次/d(剂量换算方法同前)。第28天对应激模型组行第三次强迫游泳实验和蔗糖水消耗实验,并对全部六组大鼠分别进行断头,留取血液标本。
1.4 方法
1.4.1 慢性轻度不可预见性应激模型 大鼠在连续21 d内每天随机采取以下一种方式进行刺激。包括:①禁食24 h;②冰水游泳(4℃、5 min);③45°倾斜鼠笼;④昼夜颠倒;⑤夹尾1 min;⑥禁水24 h;⑦高温震荡(40℃、50 Hz);⑧行为限制2 h;⑨湿笼10 h。在整个过程中每种刺激平均出现2~3次,同种刺激不连续出现,使大鼠不能预料刺激的发生。
1.4.2 强迫游泳实验 将大鼠放入透明有机玻璃缸中(高50 cm,直径25 cm)进行强迫游泳实验,水温保持在25℃左右,时间固定在每天3:00~5:00 pm,室内保持安静、自然光线,实验时间5 min。使用动物运动轨迹跟踪系统录像并分析大鼠5 min内的不动时间。不动时间定义:呈现不挣扎、漂浮状态,或仅有肢体的细小运动以保持头部浮于水面的时间。
1.4.3 蔗糖水消耗实验 实验开始前训练所有大鼠选择和适应蔗糖水,第1天同时给予大鼠2瓶1%蔗糖水让大鼠饮用;第2天则1只水瓶装1%蔗糖水另1个瓶装纯水。正式实验时先使大鼠禁食禁水21 h,每只大鼠接受提前称好的2瓶水,1瓶为1%蔗糖溶液,1瓶为纯水,3 h后分别称重2瓶水,计算蔗糖水和纯水的消耗量。蔗糖水偏好=蔗糖水消耗总量/[糖水消耗总量+纯水消耗总量]×100%。
1.4.4 快眼动睡眠剥夺模型 选用塑料水桶(尺寸38 cm×36 cm×40 cm),中央部固定安置高8 cm、直径6 cm的圆形平台,加水至台下1 cm。大鼠站在平台上能够进食、进水,当进入快速动眼睡眠期,由于全身肌肉张力降低而节律性触水或落水,由于对水环境的恐惧,大鼠会迅速爬上平台,使其始终不能进入REM睡眠期,从而完成了大鼠的快速动眼睡眠剥夺。睡眠剥夺期间予以持续灯光照射,水糟中的水每天更换,室温保持在22℃左右。
1.4.5 促肾上腺皮质激素、皮质酮浓度的测定 实验结束后大鼠断头取血,高速离心机离心5 min(3000 r/min),吸取上层血清,-80℃冰箱保存。血清ACTH、CORT采用ELISA法检测,试剂盒由南京建成生物工程研究所提供。按照ELISA试剂盒说明操作,用酶标仪检测波长450 nm处吸光度值(OD值),根据标准品的浓度及对应的OD值计算出标准曲线的直线回归方程,计算出各组大鼠血清相应的ACTH、CORT浓度。
1.5 统计学方法
采用SPSS 22.0统计学软件进行处理分析。计量资料以均数±标准差(x±s)的形式表示,两组之间比较采用独立样本t检验,自身前后比较采用配对样本t检验,多组比较采用单因素方差分析(one way ANOVA)对各指标数据进行组间均数比较,多组数据组内两两比较时采用LSD检验(通过方差齐性检验)和Dunnett T3检验(未通过方差齐性检验),P<0.05为差异有统计学意义。
2 结果
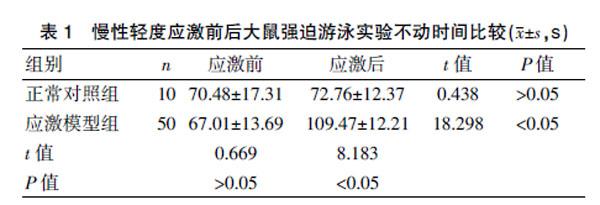
2.1 慢性轻度应激前后大鼠强迫游泳实验不动时间比较
应激刺激前,正常对照组与应激模型组强迫游泳漂浮不动时间比较,差异无统计学意义(P>0.05)。21 d应激刺激后,应激模型组漂浮不动时间比应激前显著延长,差异有统计学意义(P<0.05)。21 d应激刺激后,应激模型组漂浮不动时间显著长于正常对照组,差异有统计学意义(P<0.05)。见表1。
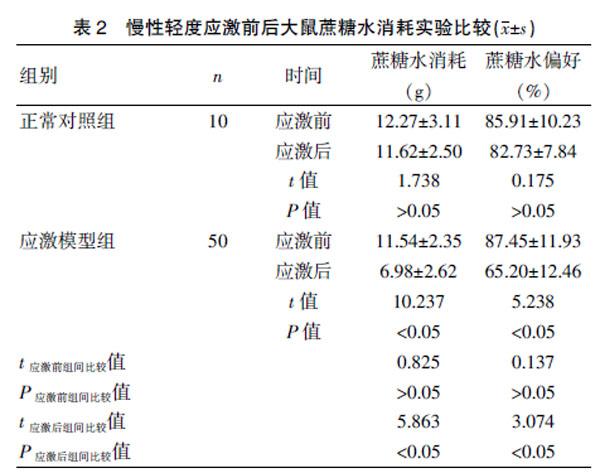
2.2 慢性轻度应激前后蔗糖水消耗实验结果比较
应激刺激前,正常对照组与应激模型组蔗糖水消耗量、蔗糖水偏好比较,差异无统计学意义(P>0.05),21 d应激刺激后,应激模型组蔗糖水消耗量、蔗糖水偏好相比应激前明显降低,差异有统计学意义(P<0.05)。21 d应激刺激后,应激模型组相比正常对照组蔗糖水消耗量、蔗糖水偏好明显降低,差异有统计学意义(P<0.05)。见表2。
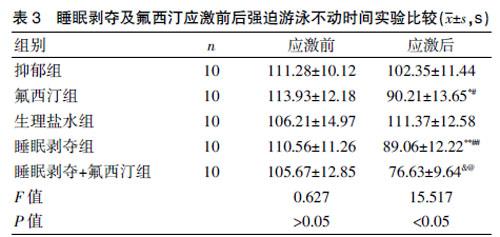
2.3 睡眠剝夺及氟西汀应激前后强迫游泳实验结果比较
应激前,各组大鼠强迫游泳漂浮不动时间比较,差异无统计学意义(P>0.05);应激后各组大鼠强迫游泳漂浮不动时间比较,差异有统计学意义(P<0.05)。氟西汀应激后大鼠强迫游泳不动时间较应激前显著缩短,差异有统计学意义(P<0.05);相比抑郁组,氟西汀组强迫游泳不动时间明显缩短,差异有统计学意义(P<0.05)。睡眠剥夺组相比抑郁组强迫游泳不动时间较前显著缩短,差异有统计学意义(P<0.05);睡眠剥夺组行睡眠剥夺后强迫游泳不动时间显著低于应激前,差异有统计学意义(P<0.05)。睡眠剥夺+氟西汀组强迫游泳不动时间降低,差异有统计学意义(P<0.05);睡眠剥夺+氟西汀组强迫游泳不动时间较应激前明显降低,差异有统计学意义(P<0.05)。见表3。
2.4 睡眠剥夺及氟西汀应激前后蔗糖水消耗实验结果比较
应激前,各组大鼠蔗糖水消耗量、蔗糖水偏好比较,差异无统计学意义(P>0.05);应激后各组大鼠蔗糖水消耗量、蔗糖水偏好比较,差异有统计学意义(P<0.05)。应激后28 d,氟西汀组蔗糖水消耗量、蔗糖水偏好较前显著升高(P<0.05);氟西汀组蔗糖水消耗量、蔗糖水偏好比抑郁组显著升高(P<0.05)。睡眠剥夺组蔗糖水消耗量、蔗糖水偏好较应激前显著升高(P<0.05);睡眠剥夺组大鼠蔗糖水消耗量、蔗糖水偏好比抑郁组显著升高(P<0.05)。睡眠剥夺+氟西汀组大鼠蔗糖水消耗量、蔗糖水偏好显著高于应激前(P<0.05);睡眠剥夺+氟西汀组大鼠蔗糖水消耗量、蔗糖水偏好相比抑郁组显著升高(P<0.05)。见表4。
2.5 应激后各组血清ACTH、CORT水平比较
造模后抑郁组ACTH、CORT水平显著高于正常对照组,差异有统计学意义(t=4.714、7.583,P<0.05)。应激后28 d,氟西汀组ACTH、CORT水平显著低于抑郁组,差异有统计学意义(t=7.932、8.073,P<0.05);睡眠剥夺组ACTH、CORT水平显著低于抑郁组,差异有统计学意义(t=5.347、6.416,P<0.05);睡眠剥夺+氟西汀组ACTH、CORT水平显著低于抑郁组,差异有统计学意义(t=4.951、9.506,P<0.05);睡眠剥夺+氟西汀组ACTH、CORT水平显著低于氟西汀组,差异有统计学意义(t=4.697、9.077,P<0.05);睡眠剥夺+氟西汀组ACTH、CORT水平显著低于睡眠剥夺组,差异有统计学意义(t=3.540、6.487,P<0.05)。见表5。
3 讨论
抑郁症反复发作给患者及其家庭、社会带来极大影响,并造成极大的经济负担。对于抑郁症最普遍的治疗手段仍然是抗抑郁药物,但其临床疗效仍需要数周时间才能充分体现[9]。抗抑郁药物的副作用如焦虑、紧张不安、食欲下降、恶心呕吐、疲劳及性功能紊乱等严重影响治疗的依从性。早期的临床疗效对于远期的治疗结果也起到重要的作用,故对于睡眠剥夺快速抗抑郁机制的研究尤为重要。
CMUS联合孤养模式建立的抑郁症动物模型是目前比较常用的动物模型。该模型将不同强弱的应激刺激安排在不同的时间,模拟抑郁症患者遭遇的各种不同应激事件及产生的绝望无助感,目前已被广泛运用于抑郁症机制的研究[10]。强迫游泳实验是使大鼠在有限空间里游泳而无法逃脱,其不动时间反映了大鼠的绝望无助感;蔗糖水消耗实验则反映了大鼠的快感缺失水平[11]。本实验结果显示,经过8 d CMUS后,应激模型组大鼠强迫游泳不动时间显著长于正常对照组,蔗糖水消耗量、蔗糖水偏好显著低于正常对照组,提示本实验抑郁造模成功。
睡眠剝夺对于40%~60%的抑郁症患者能够发挥快速抗抑郁作用,但是这种作用并不持久[12];目前很多方法都在探讨如何避免睡眠恢复后病情的复发[13]。本实验在大鼠造模成功后继续行慢性应激刺激,在应激28 d内的第1天、第8天、第15天、第22天进行72 h REMSD。本实验中,强迫游泳及蔗糖水实验结果提示睡眠剥夺组大鼠比抑郁模型组大鼠抑郁样行为有明显的改善,可见短期内增加睡眠剥夺的次数可以明显提高睡眠剥夺抗抑郁的效应,这与部分实验结果一致[14]。
本研究发现睡眠剥夺治疗后,大鼠的抑郁样行为的改善与单独使用氟西汀治疗效果相当,睡眠剥夺联合氟西汀治疗对大鼠行为学改善更为显著。这种协同作用可能是由于睡眠剥夺能够增加所有抗抑郁药物作用的靶系统递质水平,如五羟色胺(5-HT)、去甲肾上腺素(NE)、多巴胺(DA)[15];另外研究发现睡眠剥夺还可以增加去甲肾上腺素的突触表达、酪氨酸羟化酶以及蓝斑核的NE转运蛋白的水平[16],进而产生抗抑郁作用。
在持续的应激状态下可导致机体HPA轴的过度亢进,产生过多的ACTH和CORT[17]。海马是调节情绪重要的脑区并且富含糖皮质激素受体(Glucocorticoid receptor,GR),过多糖皮质激素与海马部位GR结合后导致海马的损伤;而这一效应使海马对HPA轴的抑制作用减弱,进而产生更多的GC[18]。在本实验中抑郁组大鼠ACTH和CORT水平显著高于正常对照组,这与部分实验结果[19]一致,经氟西汀药物治疗后水平明显下降。
本实验中,睡眠剥夺组ACTH和CORT水平较抑郁组明显降低,当与氟西汀联合使用后二者的水平进一步下降,并且大鼠抑郁样行为有所改善;在其他实验中整夜睡眠剥夺可产生明显的抗抑郁效用的同时也伴随血清GC水平明显降低[20-21],这提示快眼动睡眠剥夺联合SSRI类抗抑郁药物使用后对HPA轴有明显的抑制作用,而且这与睡眠障碍的HPA轴轻度唤醒是不同的。然而有文献提示睡眠剥夺可导致HPA轴短暂激活[22],这可能与夜间视交叉上核(SCN)活动产生的皮质醇觉醒反应有关[20]。
综上所述,睡眠剥夺联合氟西汀可以促进抑郁模型大鼠抑郁样行为的改善,可能主要通过降低ACTH和CORT水平,抑制HPA轴的活性发挥其作用;同时在研究睡眠剥夺抗抑郁机制时需要更多关注生物稳态和糖皮质激素水平的变化。
[参考文献]
[1] Chesney E,Goodwin GM,Fazel S,et al.Risks of all-cause and suicide mortality in mental disorders:A meta-review[J].World Psychiatry,2014,13(2):153-160.
[2] Kessler RC,Barber C,Birnbaum HG,et al. Depression in the workplace:Effects on short-term disability[J].Health Affairs,2017,18(5):163-171.
[3] Huang YQ,Wang Y,Wang H,et al.Prevalence of mental disorders in China:A cross-sectional epidemiological study[J]. Lancet Psychiatry,2019(6):211-224.
[4] Mclntyre RS,Filteau MJ,Martin L,et al. Treatment-resistant depression:Definition,review of the evidence,and algorithmic approach[J]. Affective Disorder,2014,156:1-7.
[5] Baghai TC,Moller HJ,Rupprecht R. Recent Progress in pharmacological and non-pharmacological treatment options of major depression[J]. Current Pharmaceutical Design,2016,12(4):503-515.
[6] Ewa Kurczewska,Ewa Ferensztajn-Rochowiak,Anna Jasińska-Miko?覥ajczyk,et al. Augmentation of pharmacotherapy by sleep deprivation with sleep phase advance in treatment-resistant depression[J].Pharmacopsychiatry,2019,52(4):186-192.
[7] Wang S,Wang CH,YU ZX,et al. Agarwood essential oil ameliorates restrain stress-induced anxiety and depression by inhibiting HPA axis hyperactivity[J].Int J Mol Sci,2018,19(11):3468-3482.
[8] Naughton M,Dinan TG,Scott LV.Corticotropin-releasing hormone and the hypothalamic pituitary adrenal axis in psychiatric disease[J]. Handb Clin Neurol,2014,124:69-91.
[9] Steven C Marcus,Mark Olfson. National trends in the treatment for depression from 1998 to 2007[J].Archives of General Psychiatry,2010,67(12):1265-1273.
[10] Valvassori SS,Resende WR,Budni J,et al.Sodium butyrate ahis tone deacetylase inhibitor reverses behavioral and mitochondrial alterations in animal models of depression induced by earlyor late 1ife stress[J].Curr Neurovasc Res,2015,12(4):312-320.
[11] 賈立娜,于鲁璐,李云鹏.丹参多酚酸对慢性应激大鼠抑郁相关行为改善的研究[J].中华精神科杂志,2016, 49(5):322-327.
[12] Fifel K,Meijer JH,Deboer T. Long-term effects of sleep deprivation on neuronal activity in four hypothalamic areas[J].Neurobiol Dis,2017,109:54-63.
[13] Elaine M Boland,Hengyi Rao,David F Dinges,et al.Meta-analysis of the antidepressant effects of acute sleep deprivation[J].The Journal of Clinical Psychiatry,2017, 78(8):e1020-e1034.
[14] Elias Wolf,Marion Kuhn,Claus Normann,et al.Synaptic plasticity model of therapeutic sleep deprivation in major depression[J].Sleep Medicine Reviews,2016,12(30):53-62.
[15] Kavcic P,Rojc B,Dolenc-Groselj L,et al. The impact of sleep deprivation and nighttime light exposure on clock gene expression in humans[J].Croat Med,2011,52:594–603.
[16] Sara Dallaspezia,Francesco Benedetti.Sleep deprivation therapy for depression[J].Current Topics in Behavioral Neurosciences,2015,25:483-502.
[17] Silva MCC,Sousa CNSD,Gomes PXL,et al.Evidence for protective effect of lipoic acid and desvenlafaxine on oxidative stress in a model depression in mice[J].Neuro-Psychopharmacology & Biological Psychiatry 2016,64:142-148.
[18] Supawadee Daodee,Orawan Monthakantirat, Kanlaya Ruengwinitwong,et al.Effects of the ethanol extract of dipterocarpus alatus leaf on the unpredictable chronic mild stress-induced depression in ICR mice and its possible mechanism of action[J].Molecules,2019,24(18):3396.
[19] 许腾,赵映,霞高耀,等.柴归颗粒对抑郁模型大鼠行为学及HPA轴的影响[J].中国药理学与毒理学杂志,2019,33(10):873.
[20] Sikkens D,Riemersma-Van RF,Der LekY,Meesters,et al.Combined sleep deprivation and light therapy:Clinical treatment outcomes in patients with complex unipolar and bipolar depression[J].Journal of Affective Disorders,2019,246:727-730.
[21] Ewa Kurczewska,Ewa Ferensztajn-Rochowiak,Filip Rybakowski,et al.Treatment-resistant depression_ Neurobiological correlates and the effect of sleep deprivation with sleep phase advance for the augmentation of pharmacotherapy[J].The World Journal of Biological Psychiatry,2020(6):1-12.
[22] Pereira JC,Andersen ML. The role of thyroid hormone in sleep deprivation[J].Med Hypotheses,2014,82(3):350-355.
(收稿日期:2020-11-18)
