核酸外切酶III辅助的荧光适体传感器免标记检测卡那霉素*
2021-09-30卿太平蒋子欣
卿太平, 许 锦, 蒋子欣, 张 鹏, 冯 波
(湘潭大学 环境与资源学院,湖南 湘潭 411105)
0 引言
卡那霉素是一种氨基糖苷类抗生素,从卡那霉素链霉菌中纯化出来,主要分为盐酸卡那霉素和硫酸卡那霉素.通过干扰蛋白质合成而广泛用于治疗由革兰氏阴性和革兰氏阳性细菌引起的严重感染[1-2].因卡那霉素的治疗指标狭窄,在动物源性食品中过量使用该药物可能对人造成耳毒性、肾毒性和抗生素耐药性[3].卡那霉素的传统分析检测方法包括高效液相色谱(HPLC)[4-5]、毛细管电泳(CE)[6]、微生物法[7]、表面等离子体共振[8]、免疫分析法[9-10]等.这些检测方法技术成熟且检测结果准确,但存在耗时长、烦琐、设备昂贵等不足,在实际应用中具有局限性.因此,寻求一种简便、灵敏的卡那霉素检测技术是非常必要的.
信号放大技术是检测分析中用来提高灵敏度的常用方法,其主要是基于靶标与不同信号探针的循环相互作用,在相同浓度靶标作用下扩增输出信号[11-12].核酸酶能够识别和切割特定的碱基序列或官能团,催化水解核苷酸之间的磷酸二酯键[13].如脱氧核糖核酸酶Ⅰ(DNaseⅠ)、核糖核酸酶H(RNase H)、核酸内切酶IV、核酸外切酶III(Exo III)等常被作为切割酶以促进靶标循环[14].其中Exo III具有高效的酶催化活性,可作用于dsDNA,沿3′→5′方向逐步将dsDNA酶解成寡核苷酸.利用其特性,已经开展了许多研究.如Taghdisi等[15]研究设计了一种基于外切酶III、SYBR Gold和适配体互补链的荧光适配体,对链霉素进行选择性、灵敏性分析探究,检出限低至54.5 nmol/L.通过检测加标牛奶和血清中的链霉素,不受样品基质的干扰,成功地评估了该策略的有效性和适用性.
在本论文中,以dsDNA为底物、核酸染料SYBR Gold(SG)为信号输出单元,构建一种核酸外切酶III辅助信号放大的荧光适体传感器免标记检测卡那霉素,并考察其在实际废水中的检测能力,从而为抗生素污染控制提供一种技术参考.
1 实验部分
1.1 试剂与仪器
实验中所使用的寡核苷酸序列均由生物工程(上海)股份有限公司合成,并通过高效液相色谱(HPLC)进行纯化,其序列如表1所示.核酸染料SYBR Gold(SG)购自美国Invitrogen公司.氯霉素、阿莫西林、青霉胺、阿奇霉素、卡那霉素购自上海阿拉丁生化科技股份有限公司.废水取自湘潭市污水处理厂,其他未提及的常用试剂皆为分析纯且购买于上海阿拉丁生化科技股份有限公司,无须进一步处理即可使用.

表1 寡核苷酸序列
1.2 缓冲溶液中卡那霉素检测
将1 μL dsDNA溶液和2 μL 适量浓度卡那霉素溶液混合,在37 ℃下孵育60 min.随后,加入2 μL Exo III,充分混合后继续孵育30 min,再用PBS缓冲液和1 μL 核酸染料SG稀释至200 μL.最后于495 nm处测量样品的荧光强度(F-7000),确定收集范围为500~650 nm.其中激发和发射狭缝均设置为5 nm,电压700 V PMT,扫描速度为1200 nm/min,响应时间0.01 s.选择Log[Kana]作为横坐标,信倍比((F0-F)/F0)作为纵坐标,其中F0是不存在Kana时检测系统的荧光强度,F是Kana存在时的荧光强度.上述所有操作过程均尽量在避光条件下进行.
1.3 特异性研究
为探究该方案是否具有对Kana检测的特异性,本研究选取了氯霉素(Chloramphenicol)和阿莫西林(Amoxicillin)、青霉胺(Penicillamine)和阿奇霉素(Azithromycin),抗生素的浓度均为200 μg/mL,采用与卡那霉素检测相同的方法和条件进行测定.
1.4 复杂样品中的检测
为验证该方法在实际应用中的可行性,选取了废水作为实际样品进行加标回收实验.废水样品是从废水处理厂(中国湘潭)收集.首先,将废水离心3次(8 000 r/min,10 min)并过滤(0.22 μm膜滤器)以除去大颗粒,减少其他物质的干扰.然后,加标卡那霉素标准溶液以制备不同的卡那霉素浓度(0.1 ng/mL、1 ng/mL和10 ng/mL)用于分析测定.废水样品的检测步骤与荧光测定相同.
2 结果与讨论
2.1 实验原理
核酸外切酶III(Exo III)可以催化从钝或凹陷的3末端至5末端方向,使DNA双链体中的单核苷酸被逐步去除,而无法催化从3末端突出的单链DNA,这一原理已广泛用于生化分析中[16-17].基于此,设计了一种免标记荧光适体传感器,利用Exo III酶解dsDNA的特性降低背景信号,相对增大检测信号.如图1所示,核酸染料SG能嵌入DNA链中,在495 nm激发波长下有强烈的荧光信号.当靶标Kana不存在时,Exo III会把双链DNA酶解为寡核苷酸,因此不能与SG形成复合产物,在495 nm激发波长下产生较弱荧光信号.当靶标Kana存在时,靶标会与适体链结合形成靶标-适体复合物,并释放出互补链,核酸染料SG均能嵌入其中,产生强烈荧光信号.以此通过检测体系荧光强度的变化来分析卡那霉素的浓度.

图1 基于核酸外切酶III构建的荧光适体传感器免标记检测卡那霉素Fig.1 Fluorescent aptamer sensor for label-free detection of kanamycin
2.2 可行性分析
为验证引入Exo III可降低背景信号和提高信倍比,检测了空白组样品加入Exo III前后的荧光信号.如图2所示,单独的核酸染料SG几乎无荧光信号(黑线),在紫外透射仪照射下无亮度(①号离心管).当核酸染料SG充分嵌入dsDNA中,产生强烈荧光信号(红线),在紫外透射仪照射下亮度明显(②号离心管).相比之下,引入Exo III后,样品的荧光强度减弱了97.5%(蓝线),且发出微弱亮度(③号离心管).进一步加入卡那霉素后,样品的荧光信号增强(粉线),信号变化率(F-F0)/F0=11.58,且④号离心管的亮度明显变亮.该荧光光谱结果分析表明,基于Exo III构建的荧光适体传感器免标记检测卡那霉素是可行的.

图2 卡那霉素检测的可行性验证Fig.2 Feasibility evaluation of Kana detection
2.3 实验条件优化
为了提高适体传感器的检测性能,对实验条件进行优化.分别考察了dsDNA浓度、缓冲液类型、SG浓度、Exo III浓度、靶标孵育时间、酶切时间等因素对检测体系的影响.如图3(a)所示,随着 dsDNA浓度的增加,背景信号和输出信号荧光强度均逐渐增强.通过信号变化率((F-F0)/F0)可得到dsDNA的最佳浓度为50 nmol/L.适体传感器在各缓冲溶液中均能顺利检测出 Kana并产生较强的荧光信号,其中PBS缓冲溶液的背景荧光强度相对最弱(图3(b)),得到的信倍比最大,故选择PBS缓冲液作为最佳检测缓冲液.如图3(c)所示,随着SG浓度的增加,荧光强度增加缓慢.其信倍比随着染料浓度先增大后减小,在SG浓度为0.5×时出现峰值.Exo III作用于dsDNA,将其酶解成碎小的片段,它的浓度关乎着背景信号强弱.选择了5组浓度分别为2、4、6、8、10 U/mL进行优化.如图3(d)所示,当Exo III为6 U/mL时,酶切效果最好,信倍比最大.最后优化了靶标孵育时间和酶切时间.图4(a)显示,随着靶标孵育时间增加,空白组荧光强度基本不变,实验组前20 min先增加后保持不变,说明20 min后靶标与互补链竞争基本结束并形成稳定的靶标-适体复合物.从图4(b)可知,随着酶切时间的增加,Exo III与dsDNA发生酶解反应,空白组荧光强度不断降低.当时间达到30 min时,反应基本完成,荧光强度和信倍比保持不变.综上所述,得到的最佳实验条件为:dsDNA:50 nmol/L、PBS:10 mmol/L(pH 7.4);SG:0.5×;Exo III:6 U/mL;靶标孵育时间:20 min;酶切时间:30 min.
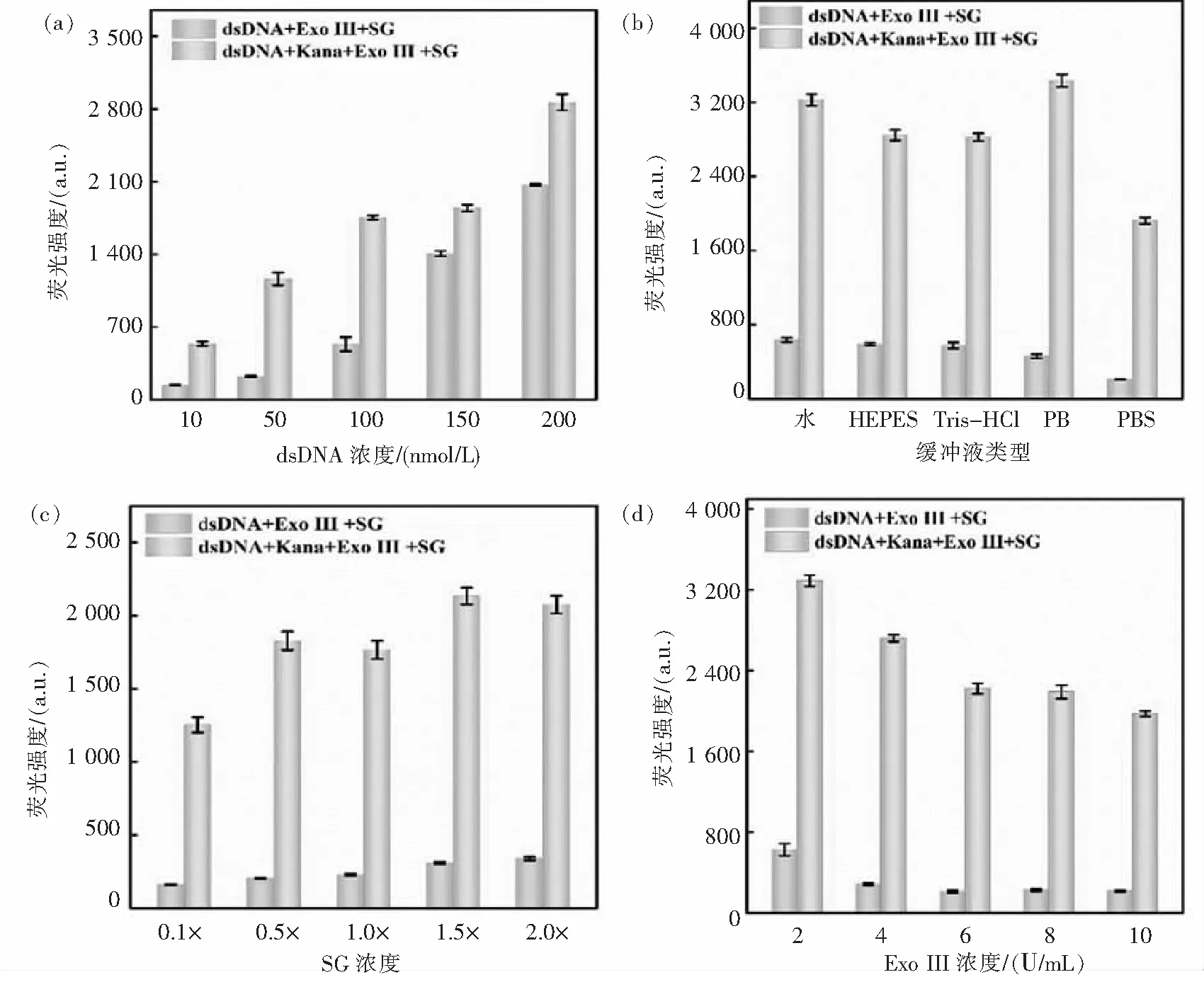
图3 实验条件优化,(a)dsDNA浓度、(b)缓冲液类型、(c)SG浓度、(d)Exo III浓度对检测系统荧光强度的影响Fig.3 Optimization of experimental conditions. Effect of dsDNA concentration (a), reaction buffer (b), SG (c) and Exo III (d) concentration on the fluorescent intensity of detection system
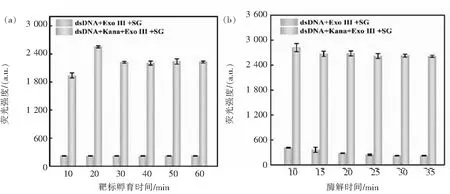
图4 反应时间优化,(a)靶标孵育时间、(b)酶解时间对检测系统荧光强度的影响Fig.4 Optimization of reaction time. Effect of incubation time (a) and hydrolysis time (b) on the fluorescent intensity of detection system
2.4 缓冲液中卡那霉素的检测
在考察实验中各项因素的影响并确定检测的最优条件后,分析了该检测体系对Kana检测的灵敏度.如图5(a)所示,当卡那霉素浓度从0增加至1×106ng/mL时,溶液的荧光信号逐渐增强并达到饱和.同时,在0.01~50 ng/mL的卡那霉素浓度范围内,信倍比与卡那霉素浓度的对数保持良好的线性关系(图5(b)).线性方程表示为y=0.83849x+2.01069(R2=0.993),其中y表示信倍比(F-F0)/F0,x表示Log[ Kana浓度],检测限LOD= 8.12×10-3ng/mL(3σ).此外,该传感器实现了比其他卡那霉素检测策略更低的检测限[18-22].
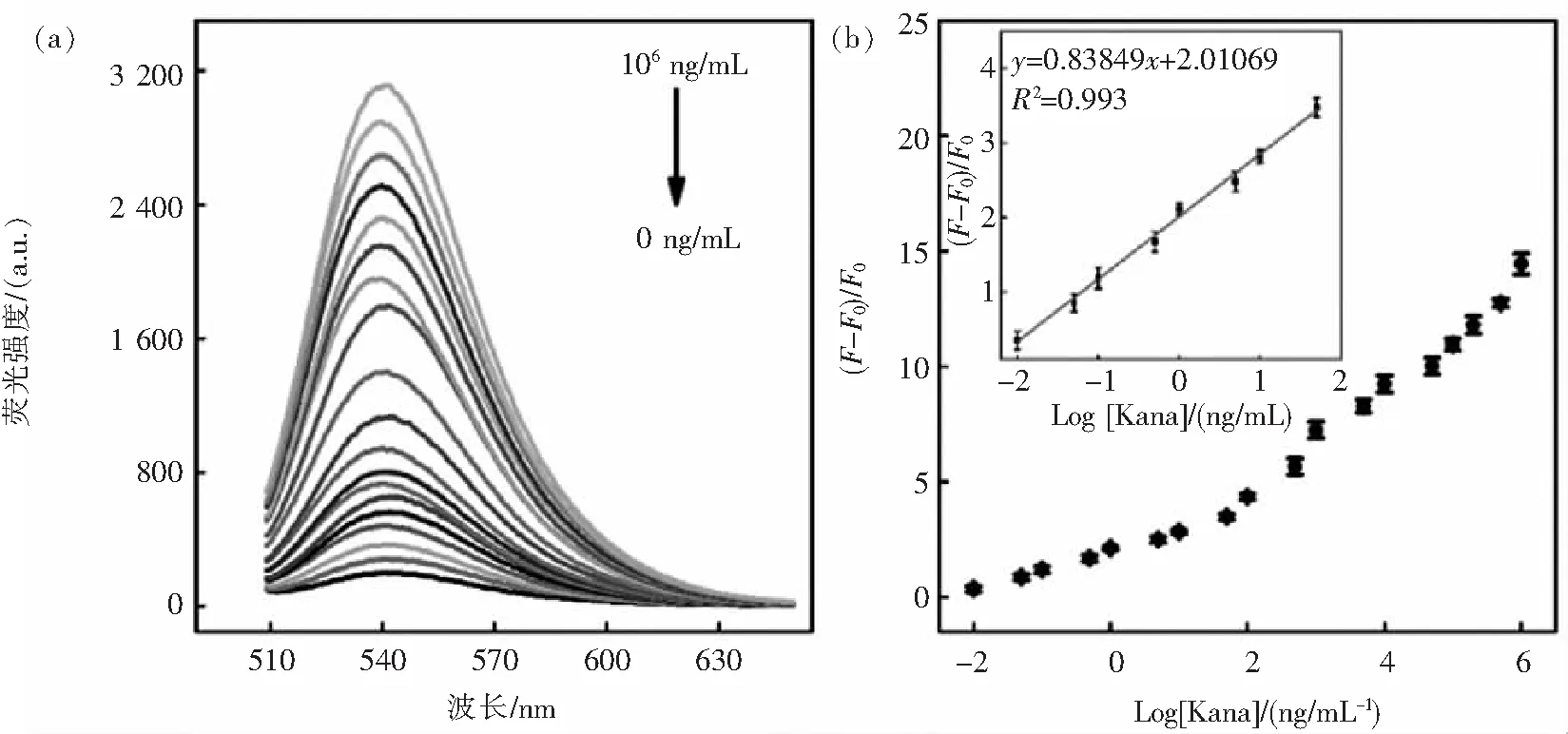
图5 缓冲溶液中卡那霉素的检测.(a)该检测系统在不同浓度卡那霉素下的荧光发射光谱; (b) 信倍比(F0-F)/F0与Kana浓度的关系曲线Fig.5 Detection of Kana in the buffer. Fluorescence spectra of the aptasensor at various Kana concentrations (a); The linear calibration of (F-F0)/F0) versus the Kana concentration (b)
2.5 特异性分析
为了评估该策略的特异性,考察了该适体传感器对卡那霉素(Kanamycin)及其他4种抗生素氯霉素(Chloramphenicol)、阿莫西林(Amoxicillin)、青霉胺(Penicillamine)、阿奇霉素(Azithromycin)的荧光响应.如图6(a)所示,只有在卡那霉素存在的情况下,荧光强度才会得到明显的提高,而其他抗生素存在的溶液荧光强度均很弱.另外,在紫外透射仪下可明显观察到卡那霉素溶液的离心管荧光最亮(如图6(b)所示).因此,其他抗生素对卡那霉素的检测没有干扰,体现了良好的选择性.

图6 卡那霉素的特异性测定.(a) 氯霉素、阿莫西林、青霉胺、阿奇霉素、卡那霉素存在时的荧光光谱图; (b)其他抗生素存在时的信倍比和紫外透射仪下照片Fig.6 Selectivity of this strategy for Kana detection. (a) Fluorescence spectra of the detection system in the absence and presence of antibiotics; (b) The signal change ratio (F-F0)/F0 of solutions that contain Kana or other interfering substances. The illustration shows the associated fluorescence emission under UV light.
2.6 复杂样品中卡那霉素的检测
结合该适体传感器具有良好的灵敏性和高特异性的特点,对该检测方法在实际样品中的应用进行了评估.在废水样品中加标不同浓度的卡那霉素溶液使其终浓度分别为0.1 ng/mL、1 ng/mL和10 ng/mL用于分析测定,并计算回收率.如表2所示,平均回收率介于96.05%至105.04%之间,相对标准偏差(RSD)为0.83%~9.87%.结果说明该检测方案对实际样品中的卡那霉素呈现出较好的检测性能,能有效用于实际应用.
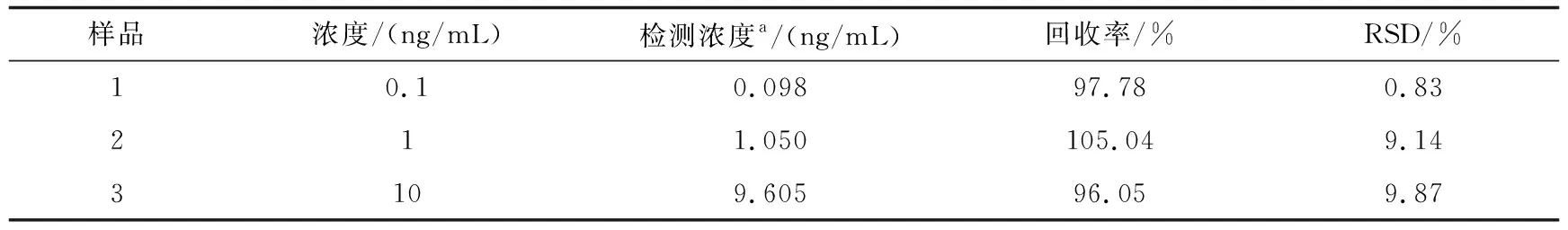
表2 实际样品中卡那霉素的测定
3 小结
基于核酸外切酶III对dsDNA的特异性切割能力和核酸染料嵌入DNA后的荧光增强作用,构建了一种免标记适体传感器用于卡那霉素检测.完全互补的双链结构能够被核酸外切酶III水解成寡核苷酸,SYBR Gold无法嵌入,从而表现出低的背景信号.为获得传感器最佳的检测性能,优化了包括dsDNA浓度、缓冲溶液类型、SYBR Gold浓度、Exo III浓度、靶标孵育时间、酶切时间等多项实验条件.在最佳实验条件下,卡那霉素浓度在0.01~50 ng/mL范围内呈线性相关,其检测限为8.12×10-3ng/mL,废水样品中的加标回收率为96.05%~105.04%.与其他卡那霉素检测方法相比,该策略适体链不需要复杂的设计,无须修饰昂贵的荧光基团,能有效降低检测成本;同时,该方法操作简便,响应快,成本低,具有良好的特异性、稳定性、重复性.在废水样品中也能检测成功表明该策略可用于环境中卡那霉素检测的实际应用.
