影像融合技术引导经颈静脉肝内门体分流术中穿刺门静脉的可行性
2021-09-30李自恒胡继红易根发潘文秋
李自恒,赵 卫,胡继红,易根发,潘文秋,万 程,王 滔
(昆明医科大学第一附属医院影像中心,云南 昆明 650032)
肝硬化失代偿期常合并门静脉高压(portal hypertension, PH),约40%的PH患者并发食管胃底静脉曲张(esophageal and gastric varices, EGV);而食管胃底静脉曲张破裂出血(esophageal and gastric variceal bleeding, EGVB)是导致肝硬化患者死亡的主要原因[1-2]。经颈静脉肝内门体分流(transjugular intrahepatic portosystemic shunt,TIPS)是治疗EGVB和顽固性腹腔积液的常用方法[3-4],穿刺门静脉是其关键步骤,与手术成功率及并发症发生率密切相关;分流道不佳易导致肝性脑病及肝衰竭,增加术后支架失功率[5-6];门静脉穿刺脱靶则可能导致腹腔出血以及动-静脉瘘等严重并发症[7]。常规门静脉造影,包括直接门静脉造影和间接门静脉造影图像用于引导穿刺的价值相对较低[8]。近年来,影像融合技术逐渐用于引导介入手术。本研究观察影像融合技术引导TIPS术中穿刺门静脉的可行性。
1 资料与方法
1.1 一般资料 回顾性分析2020年9月—2021年3月41例于昆明医科大学第一附属医院确诊并接受TIPS治疗的肝硬化合并EGVB患者,其中18例术中采用影像融合技术引导穿刺门静脉(融合组),23例以常规DSA引导穿刺(常规组)。融合组男14例、女4例,年龄14~73岁,平均(51.0±13.8)岁,其中10例有乙肝病史;常规组男14例、女9例,年龄35~64岁,平均(49.2±6.6)岁,11例有乙肝病史。纳入标准:①经影像学及实验室检查明确诊断肝硬化合并PH;②消化道内镜证实EGVB;③顽固性腹腔积液。排除标准:①门静脉血栓或癌栓;②门静脉海绵样变性。
1.2 仪器与方法 采用Philips FD20 DSA机作为介入引导设备,对比剂为碘佛醇(320 mgI/ml)。
常规组:嘱患者仰卧,头偏向左侧,充分暴露右颈部。颈部常规消毒、铺巾,局麻下经右侧颈内静脉入路,在0.035inch超滑导丝及0.035inch加硬导丝引导下送入RUPS-100穿刺套件,行直接或间接门静脉造影作为引导,以TIPS穿刺针经肝静脉穿刺门静脉左支;穿刺成功后交换导丝,以5F端侧孔导管于门静脉主干远端进行造影,测量门静脉主干内压力;以适当球囊导管扩张肝内分流道,见“腰征”消失后引入输送器,于透视下缓慢释放血管裸支架,而后于其内植入血管覆膜支架,使之覆盖分流道两侧;再次以球囊导管扩张分流道,并观察支架位置及贴壁情况。于门静脉主干远端进行造影,确定分流道通畅后测量门静脉主干内压力。术毕退管拔鞘,压迫穿刺点10 min后包扎,将患者送返病房。
融合组:术前自图像存储与传输系统(picture archiving and communication systems, PACS)工作站调取薄层增强CT门静脉图像,传输至DSA后处理工作站备用。颈部消毒、铺巾及引入RUPS-100穿刺套件同前。采用Philips FD20 DSA设备的Xper-CT程序进行腹部扫描,随后在DSA工作站对术前正侧位和轴位增强CT门静脉图像与腹部Xper-CT图像进行自动和手动调整,利用骨性标志(T12)进行配准,重建3D门静脉图像作为3D路径图,以之实时引导穿刺门静脉,见图1、2。其他方法均同对照组。
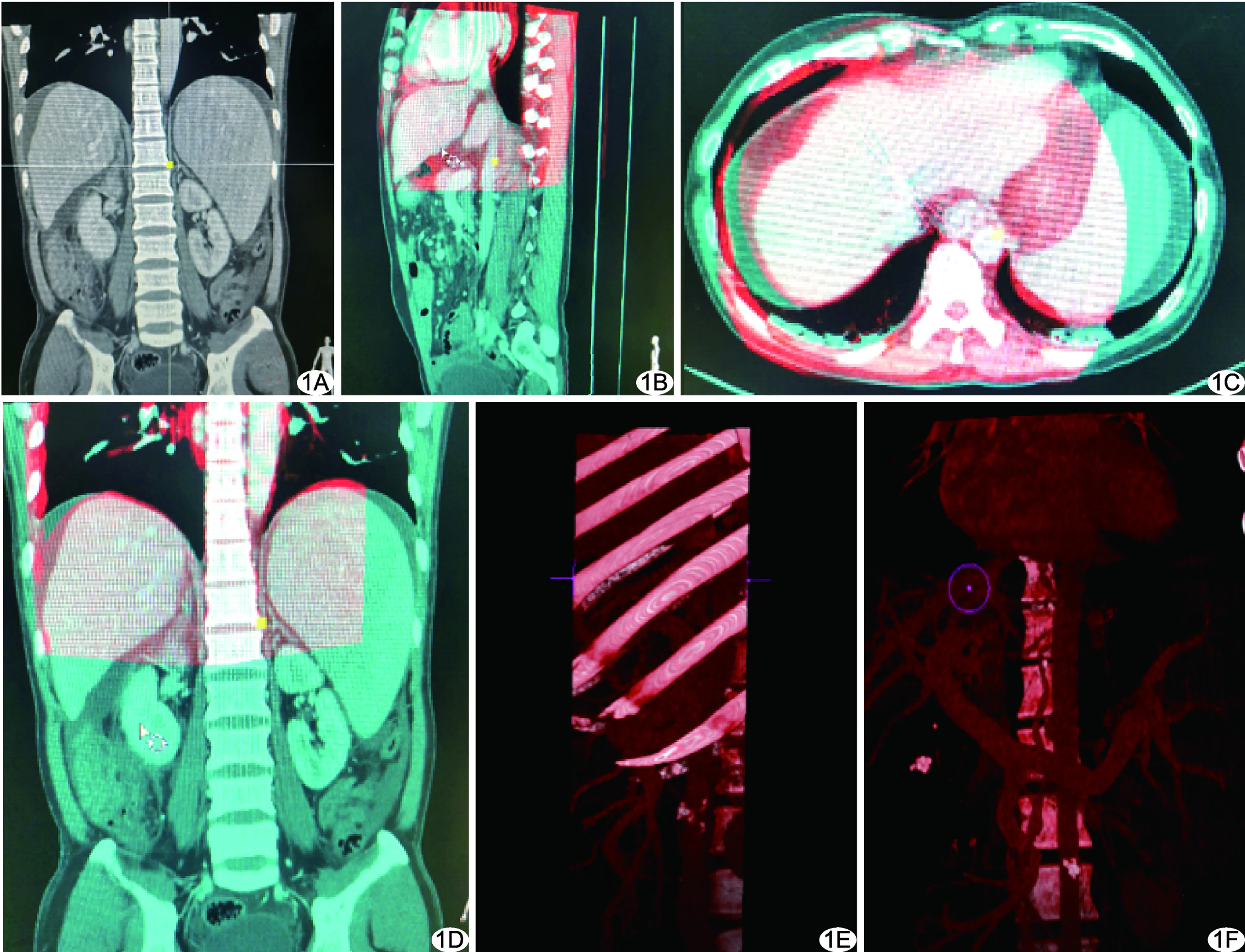
图1 影像融合流程示意图 A.以T12为骨性标志进行图像配准; B~D.初步配准完毕后,分别于矢状位(B)、冠状位(C)及轴位(D)对图像进行再次校准; E.选取门静脉3D重建图像范围; F.融合后的3D路径图
1.3 相关指标观察 分别记录2组穿刺次数、穿刺时间、辐射剂量及对比剂用量。穿刺次数指自肝静脉尝试刺入门静脉左支的次数;穿刺时间指手术开始到刺入门静脉的时间;辐射剂量指穿刺时间中的累计辐射剂量;对比剂用量为自手术开始至手术结束所用碘佛醇总量。
于Philips Interventional Workspot R1.3.2工作站测量融合3D路径图与直接门静脉造影图像所示门静脉主干的纵向及横向误差,即两种图像间左、右及上、下位移距离。判定标准[9]:位移<2 mm为误差小,2~5 mm为误差中等,>5 mm为误差大。
1.4 统计学分析 采用SPSS 25.0统计分析软件。以±s表示符合正态分布的计量资料,组间比较采用独立样本t检;以四格表资料χ2检验比较计数资料。P<0.05为差异有统计学意义。

图2 3D路径图实时引导TIPS术中穿刺门静脉 A.在3D路径图引导下,经肝中静脉一次穿刺门静脉左支成功; B.门静脉走行与重建3D路径图吻合; C.直接门静脉造影与融合图像所示门静脉匹配良好; D.于融合图像引导下栓塞胃冠状静脉
2 结果
2组均由肝静脉成功穿刺入门静脉左支并成功实施TIPS,术中及术后均未见严重并发症。
2.1 组间相关资料比较 组间患者年龄(t=0.546,P=0.588)、性别(χ2=1.333,P=0.248)及乙肝病史(χ2=0.241,P=0.623)差异均无统计学意义。融合组穿刺次数、穿刺时间、辐射剂量及对比剂用量均低于常规组(P均<0.01),见表1。
表1 2组间TIPS术中穿刺门静脉次数、穿刺时间、辐射剂量及对比剂用量比较(±s)

表1 2组间TIPS术中穿刺门静脉次数、穿刺时间、辐射剂量及对比剂用量比较(±s)
组别穿刺次数穿刺时间(min)辐射剂量(mGy)对比剂用量(ml)融合组(n=18)2.17±1.207.43±1.70207.83±71.08110.22±12.16常规组(n=23)4.26±2.6811.32±5.12517.96±209.07135.00±18.87t值-3.34-3.41-6.64-5.09P值<0.01<0.01<0.01<0.01
2.2 门静脉图像误差 3D路径图与直接门静脉造影图像之间的门静脉纵向误差为0~9 mm,中位误差2.35 mm;横向误差0~9 mm,中位误差1.50 mm。融合组18例中,10例(10/18,55.56%)纵向误差小,5例(5/18,27.78%)纵向误差中等,3例(3/18,16.67%)纵向误差大;13例(13/18,72.22%)横向误差小,4例(4/18,22.22%)横向误差中等,1例(1/18,5.56%)横向误差大。
3 讨论
穿刺门静脉肝内分支是TIPS的关键步骤。术中间接门静脉造影虽可观察门静脉与肝静脉的关系,但图像质量不高,影响穿刺效果。经皮超声引导下直接门静脉造影需要穿刺脾静脉,增加操作难度,创伤大[9-11],且所获为2D图像,显示3D结构效果不佳。
影像融合技术目前已用于引导介入治疗神经及胸腹部大血管病变(如胸、腹主动脉瘤等),效果肯定[12],但对其在TIPS中的应用研究较少[13]。影像融合引导TIPS在融合了CT图像和Xper-CT图像的3D路径图引导下进行操作[14-15],其优势在于引导手术操作的并非2D门静脉图像,而是显示解剖结构效果较好的3D图像,有利于术者从不同角度观察穿刺针位置及其与门静脉分支的关系,准确判断穿刺线路并选择最佳分流道位置,提高穿刺及手术成功率。荆剑等[16]报道,TIPS术中采用图像融合引导穿刺门静脉可明显减少穿刺次数和总透视时间。既往研究[7]发现,穿刺门静脉失误所致腹腔大出血为TIPS最严重并发症,发生率为0.6%~4.2%。本研究结果显示,融合术前CT门静脉图像和术中Xper-CT图像后的3D路径图引导穿刺门静脉成功率高,穿刺次数、穿刺时间、辐射剂量及对比剂用量均较常规DSA引导穿刺显著减少,且术中及术后均无严重并发症发生。
融合后的3D路径图为静止图像,而呼吸运动等可能导致肝脏移位,导致3D路径图中门静脉位置与其实际位置有所不同而产生误差。本研究分析3D路径图与直接门静脉造影图像间的门静脉纵向、横向误差,发现误差大者占比较低,多数情况下误差小,提示融合影像引导TIPS可行。但本研究未分析门静脉直径、肝硬化程度等对于穿刺难度的影响,且未观察治疗效果等指标,有待完善。
综上,影像融合技术可用于引导TIPS术中穿刺门静脉。
