高位直肠癌的不同定义在Ⅱ/Ⅲ期直肠癌患者放疗决策中的指导价值研究*
2021-09-30郑楠薪高显华张卫刘连杰
郑楠薪,高显华△,张卫,刘连杰
1 海军军医大学附属长海医院肛肠外科 上海 200433
2 海军军医大学附属长海医院遗传性结直肠癌筛查防治中心和遗传性肿瘤家庭阻断中心 上海 200433
术前放化疗(chemoradiotherapy,CRT)已成为Ⅱ/Ⅲ期直肠癌综合治疗的重要组成部分。术前CRT可以提高直肠癌患者的保肛率,降低局部复发率,但对总生存时间(overall survival,OS)和无病生存时间(disease free survival,DFS)无显著影响[1-3]。然而,放疗是否能使高位直肠癌(upper rectal can⁃cer,URC)患者获益尚不明确。荷兰TME试验[4]和瑞典直肠癌试验[5]表明,虽然术前放疗显著降低了中下段直肠癌的局部复发率,但未发现能显著降低URC患者的局部复发率。在广泛使用全直肠系膜切除术(total mesorectal excision,TME)之前,术后辅助放疗被认为是手术根治性不彻底的重要补救措施[6]。随着全身化疗和手术切除质量的提高,尤其是TME的广泛使用,直肠癌的局部复发率在过去三十年中显著下降[6-7]。此外,考虑到放疗有显著的长期副作用,而且放疗对URC患者的获益尚不明确,大部分现行指南不建议URC患者术前或术后行放疗[2,3,8-10]。然而,在目前的诊疗指南中,对URC的定义差别很大。在2020年NCCN(NCCN Clinical Prac⁃tice Guidelines in Oncology)指南中,URC被定义为MRI显示肿瘤下缘位于前方腹膜返折(anterior peri⁃toneal reflection,APR)上方、骶骨岬下方的直肠癌[1]。在2019年德国GGPO(German Guideline Pro⁃gram in Oncology)指南中,URC被定义为硬式直肠镜下肿瘤下缘距肛缘12~16 cm的直肠肿瘤[9]。在2018年的中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)指南中,URC被定义为MRI显示肿瘤下缘距离肛缘10 cm以上的直肠癌[10]。根据2017年欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)指南,URC被定义为硬式乙状结肠镜下肿瘤下缘距肛缘10~15 cm的直肠癌[2]。
尽管这些以肿瘤下缘距肛缘距离(肿瘤高度)来定义URC的方法具有可重复性,但在评估时忽略了患者性别及身体特征对肿瘤位置的影响,例如:高个子患者的直肠较长[3]。因此,仅仅根据肿瘤下缘距肛缘距离的数值来决定直肠癌患者是否需行放疗存在解剖学层面的缺陷。现有研究报道,APR距肛缘的距离为3.5~16 cm[11~14],与患者的身高、性别和年龄有关。距离肛缘3.5~16 cm处的直肠癌既可能位于腹膜外(extraperitoneal),也可能位于腹膜内(intraperitoneal),而腹膜内的直肠癌通常无法选择准确的放疗靶点。因此,一些外科医师提出APR可能是一个用于筛选需行放疗的直肠癌患者的更合适解剖标志[15]。此外,2020年NCCN指南还建议将APR以上的直肠癌定义为URC[1]。腹膜内和腹膜外直肠癌5年局部复发率分别为4.2%和13.3%[15],越来越多的证据表明,放疗可能对腹膜内的直肠癌没有益处[16-18]。更重要的是,血源性转移或播散在腹膜内直肠癌中占优势,而局部复发在腹膜外直肠癌中更常见。有证据表明,APR上方的直肠与APR下方的直肠在胚胎学、形态学、功能和淋巴引流方面均有很大的不同[11]。APR是一个独特的解剖标志,很容易通过术中检查和术前MRI准确判断[17,19]。基于这些原因,我们将APR以上的直肠癌定义为URC是评估Ⅱ/Ⅲ期直肠癌患者是否需要行放疗的最佳定义[11]。
在本研究中,URC的5个不同定义如下:(1)MRI显示肿瘤下缘距肛缘>10 cm;(2)MRI显示肿瘤下缘距肛缘>12 cm;(3)结肠镜下肿瘤下缘距肛缘>10 cm;(4)结肠镜下肿瘤下缘距肛缘>12 cm;(5)术中判定肿瘤下缘位于APR以上[1]。在本研究中,我们旨在比较URC的5种不同定义对Ⅱ/Ⅲ期直肠癌患者OS、DFS和局部无复发生存时间(local recur⁃rence free survival,LRFS)、放疗疗效和指导放疗决策方面的差异。
1 资料与方法
1.1 病例资料
本研究回顾性分析2017年7月至2018年10月在长海医院接受根治性切除术的956例直肠癌患者的临床资料,包括围手术期的临床病理参数、影像学资料、肿瘤高度、肿瘤与APR的位置关系和放疗情况等,数据保存于科室患者数据库中。
1.2 纳入与排除标准
纳入标准:(1)病理证实为直肠腺癌的成年患者(年龄>18岁);(2)结肠镜检查示肿瘤下缘距肛缘<15 cm;(3)病理分期为Ⅱ/Ⅲ期的直肠癌;(4)接受直肠癌根治性切除术;(5)术前未行CRT。排除标准:(1)接受姑息性切除术;(2)切缘(包括环周、近端和远端切缘)阳性;(3)同时或异时性多原发性结直肠癌;(4)遗传性结直肠癌综合征;(5)既往盆腔放疗史;(6)术前并发肠梗阻或穿孔。
1.3 手术和组织病理学评估
所有纳入病例的手术由7位主刀医师分别进行,每位主刀医师每年至少有100例结直肠癌手术经验,遵循标准化手术方案(包括标准TME和肠系膜下动静脉血管高位结扎)。如果在距离手术切缘1 mm范围内发现肿瘤细胞,则手术切缘(包括环周、近端和远端切缘)判定为阳性。
1.4 术后CRT
对于中低位直肠癌,所有Ⅱ/Ⅲ期患者术前均推荐行CRT,但部分患者拒绝,本研究中已排除术前CRT的患者。对于URC,术前不建议对Ⅱ/Ⅲ期(T4b除外)患者行CRT。所有术前未接受CRT治疗的Ⅱ/Ⅲ期患者均建议术后接受CRT治疗,部分患者拒绝接受术后CRT治疗或单独化疗。接受辅助CRT的患者,于术后第4周开始,持续6个月。同步CRT方案:术后辅助放疗单次剂量为1.8~2.0 Gy,时长5~6周,共23~28次,总剂量为46.0~50.4 Gy,采用三区域或四区域技术对原肿瘤所在区域、直肠系膜、骶前区及髂内淋巴结进行辅助放疗,放疗期间同步口服卡培他滨1 000 mg/m2,每日2次。非同步CRT方案:辅助化疗患者采用CapeOX或mFOLFOX6方案,在放疗结束后3周进行,持续4~6个月。
1.5 随访
临床随访包括患者体格检查、直肠指诊(digi⁃tal rectal examination,DRE)、胸部CT平扫、肝脏MRI增强扫描、直肠MRI增强扫描及血清CEA、CA19-9测定,术后2年内每3个月检查一次,第3~5年每6个月检查一次,每年进行一次结肠镜检查,共随访5年。局部复发和远处转移可在适当的时候通过活检或根据病灶大小的变化或新病灶的出现来确定。
1.6 参数的定义
直肠癌定义为肿瘤下缘距肛缘15 cm以内的大肠肿瘤。局部复发定义为根治性切除术后骨盆内存在疾病复发的证据,包括吻合口、盆腔和会阴切口的复发。LRFS定义为从原发性直肠癌的手术日期至确诊局部复发或因任何原因死亡日期之间的时间间隔。DFS定义为原发性直肠癌的手术日期至确诊局部复发、远处转移或因任何原因死亡日期之间的时间间隔。OS定义为原发性直肠癌的手术日期与因任何原因死亡或末次随访日期之间的时间间隔。
1.7 肿瘤高度的测量方法、肿瘤与APR的位置关系的判定
术前行DRE、结肠镜和MRI测量肿瘤下缘距肛缘距离,基于术前MRI判定肿瘤与APR的位置关系。DRE和结肠镜检查均由经验丰富的结直肠外科医师完成。MRI由有经验的放射科医师阅片,辨别APR时所取图像为矢状位、横轴位T2加权图像。在正中矢状位,APR为一条从膀胱(男性)或子宫(女性)上方延伸至直肠前壁的低信号细线(图1A)。在矢状位图像上,肿瘤高度定义为从肛缘到肿瘤下缘的距离(图1B)。在某些情况下,有必要将两条或多条成角的线段相互连接起来,有时需要在两个或多个相邻的矢状面上测量,长度相加即为肿瘤距肛缘的距离[13]。APR距肛缘距离(APR高度)的测量方法与肿瘤高度的测量方法相同。在横轴位图像中,APR表现为一个“V”形低信号结构附着于直肠前壁(图1C)。术前基于MRI判定肿瘤与APR的位置关系,术中通过触诊和直视下检查判定肿瘤与APR的位置关系(图2)。所有患者均在术中评估肿瘤与APR的位置关系。根据术中评估结果,患者被分为APR以上组、骑跨APR或APR以下组。
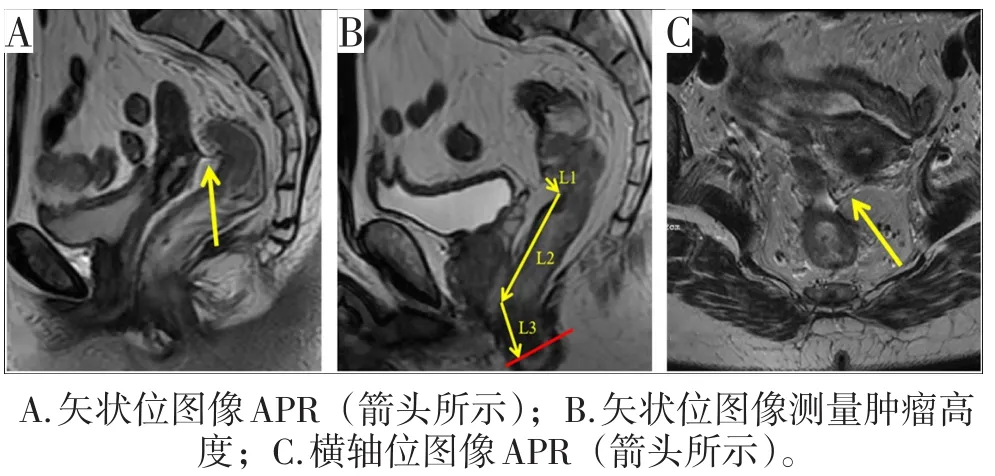
图1 APR在MRI图像上的表现以及肿瘤高度的测量方法

图2 术前及术中肿瘤与APR的位置关系
1.8 统计学方法
采用SPSS 22.0进行统计分析。符合正态分布的计量资料用(±s)表示,采用t检验进行比较;偏态分布的计量资料用M(最小值~最大值)表示,采用非参数检验进行比较分析。计数资料采用(n)或[n(%)]表示,采用χ2检验、校正χ2检验或Fisher确切概率法进行比较。用Pearson相关系数描述DRE、结肠镜和MRI测量结果的一致性。使用Bland-Alt⁃man图比较每对测量值之间的一致性。采用Kaplan-Meier分析和Log-rank检验比较两组的生存率差异。采用Cox比例风险回归模型分析影响OS、DFS和LRFS的因素,多因素Cox比例风险回归模型分析采用逐步法(正向似然比),进入标准P<0.05,剔除标准P>0.10。对于所有分析结果,当P<0.05(双侧)认为差异具有统计学意义。
2 结果
2.1 患者特征
本研究共纳入576例直肠癌患者,其中APR以上组222例,骑跨APR/APR以下组354例。研究对象选择流程图如图3所示。纳入病例的人口统计学、临床病理资料和治疗情况见表1。
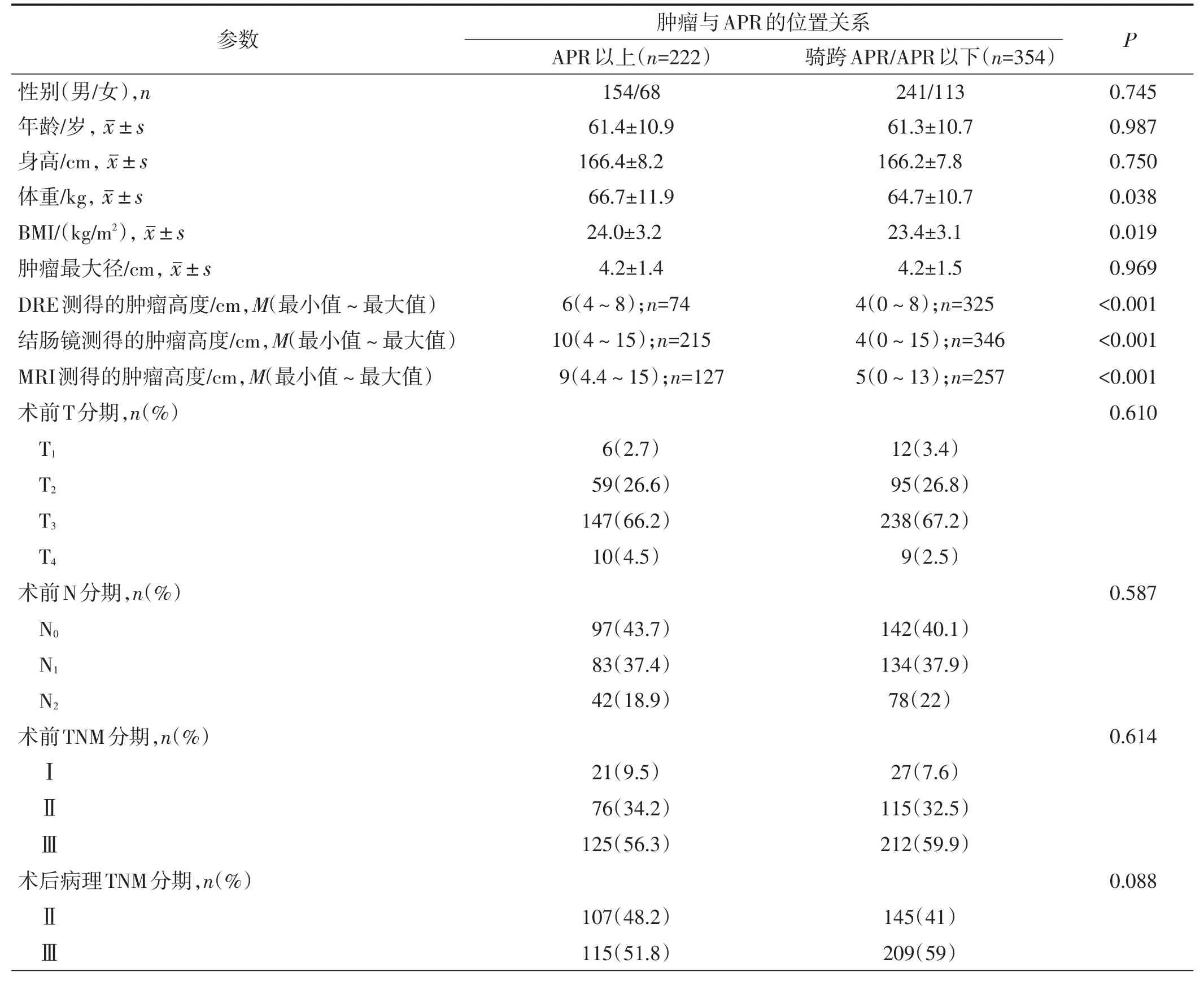
表1 纳入病例的人口统计学、临床病理资料和治疗情况

表1(续)

图3 研究对象选择流程图
在576例直肠癌患者中,384例进行了术前直肠MRI检查,102例仅进行了术前直肠CT检查,90例患者在其他医院进行术前评估。MRI可显示APR的有330例(85.9%)。APR高度的中位距离为8.7(4.5~14.3)cm。男性APR高度大于女性 【8.9(5.3~14.3) cm vs.8.4 (4.5~12.9) cm,P=0.001】。APR高度与患者身高呈正相关(r=0.862,P<0.001),计算公式为:APR高度(cm)=[0.1×身高(cm)]-8.0。以术中判定结果为金标准进行对比,术前MRI判断肿瘤与APR的位置关系的准确率为92.1%。为更好地反映MRI对三个不同部位直肠癌定位的准确性,本研究按照肿瘤位置分成三组分别统计,结果显示MRI对APR以上、骑跨APR和APR以下肿瘤的定位准确率分别为89.1%、95.3%和93.1%。术前MRI和术中判定肿瘤与APR的位置关系的一致性分析Kappa值为0.881(P<0.001),见表2。

表2 术前MRI与术中判定肿瘤与APR的位置关系一致性比较
2.2 肿瘤与APR的位置关系、术后放疗和生存相关参数(OOSS、DDFFSS和LLRRFFSS)的关系
随访截止时间为2020年12月,中位随访期为22个月(12~33个月)。随访期间共有39例死亡,其中因直肠癌死亡32例(82.1%),因心血管疾病死亡5例(12.8%),死因不明2例(5.1%)。总体局部复发率为1.4%(8/576),其中,APR以上直肠癌的局部复发率为0.5%(1/222),骑跨APR/APR以下直肠癌的局部复发率为2.0%(7/354)。术后2年OS、DFS和LRFS率分别为95.0%、86.8%和91.5%。
APR以上组的LRFS显著优于骑跨APR/APR以下组(P=0.042,图4A),两组的OS和DFS比较差异均无统计学意义。放疗组和非放疗组的LRFS(图4B)、OS和DFS比较差异均无统计学意义。亚组分析显示,在APR以上组中,放疗组和非放疗组的LRFS比较差异无统计学意义(图4C);在骑跨APR/APR以下组中,放疗组的LRFS明显优于未放疗组(图4D)。
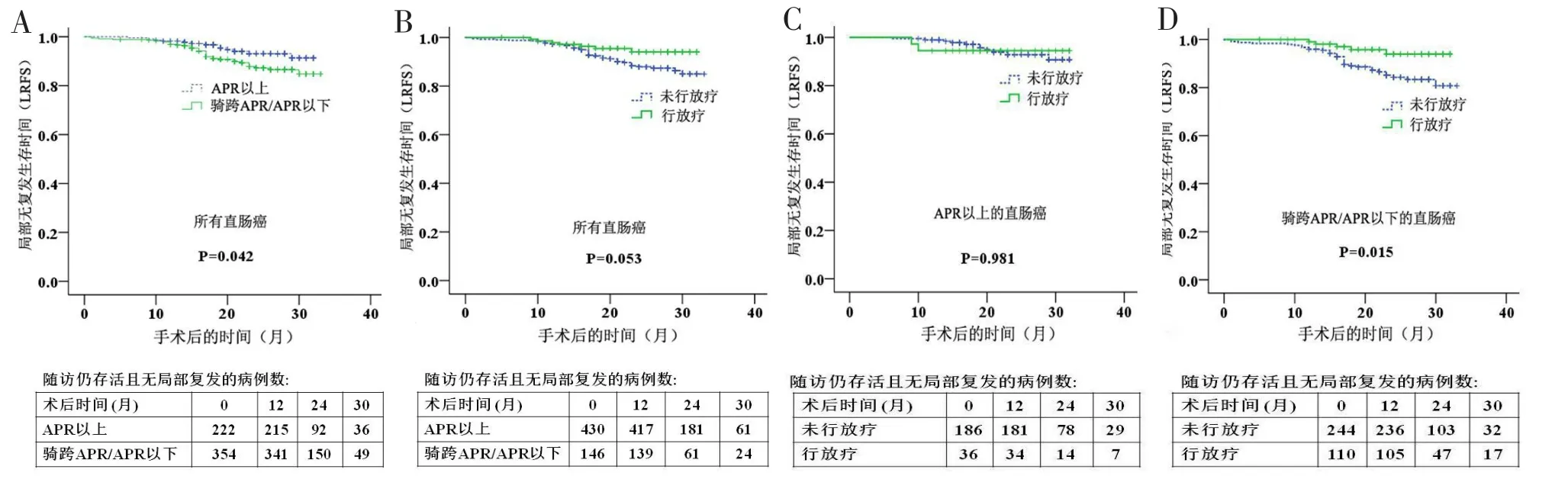
图4 患者生存情况分析
2.3 OOSS、DFS和LRFS影响因素的Cox比例风险回归模型分析
结果表明,肿瘤分化程度、癌结节、淋巴血管侵犯和神经周围侵犯是影响OS的独立影响因素(均P<0.05);术后病理TNM分期、癌结节和淋巴血管侵犯是影响DFS的独立影响因素(均P<0.05)。术后病理TNM分期、分化程度、癌结节、神经周围侵犯、肿瘤出芽、术后放疗、术后化疗和肿瘤与APR的位置关系是LRFS的独立影响因素,见表3。

表3 LRFS影响因素的单因素和多因素Cox比例风险回归模型分析结果(n=576)

表3(续)
2.4 DRE、MRI和结肠镜测得肿瘤高度的结果分析
所有患者均行DRE检查,其中399例手指可触及肿瘤下缘。此外,576例患者接受结肠镜检查,384例患者术前接受了直肠MRI检查。290例患者同时采用DRE和MRI测量了肿瘤高度,两种方法的测量结果呈正相关(r=0.723)。394例患者同时采用DRE和结肠镜测量了肿瘤高度,两种方法的测量结果呈正相关(r=0.785)。377例患者同时采用结肠镜和MRI测量了肿瘤高度,两种方法的测量结果呈正相关(r=0.822)。
我们采用Bland-Altman图分析每个个体测量结果的差异程度(见图5)。DRE和MRI之间的平均差值为-1.1 cm(95%CI:-4.2~2.1)。DRE和结肠镜检查之间的平均差值为-0.2 cm(95%CI:-3.7~3.3),结肠镜检查和MRI之间的平均差值为-0.7 cm(95%CI:-4.8~3.4)。
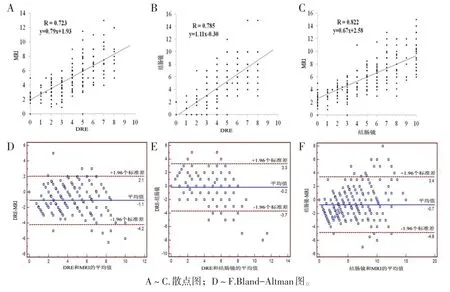
图5 DRE、MRI和结肠镜测得的肿瘤高度的结果分析
2.5 基于5种不同的URC定义的患者生存情况分析
Kaplan-Meier分析发现,按固定肿瘤高度划分的两组的OS、DFS和LRFS比较差异均无统计学意义【结肠镜(>10 cm vs.≤10 cm,>12 cm vs.≤12 cm),MRI(>10 cm vs.≤10 cm,>12 cm vs.≤12 cm)】。APR以上组LRFS明显优于骑跨APR/APR以下组(P=0.042),但两组的OS和DFS比较差异均无统计学意义。见表4。
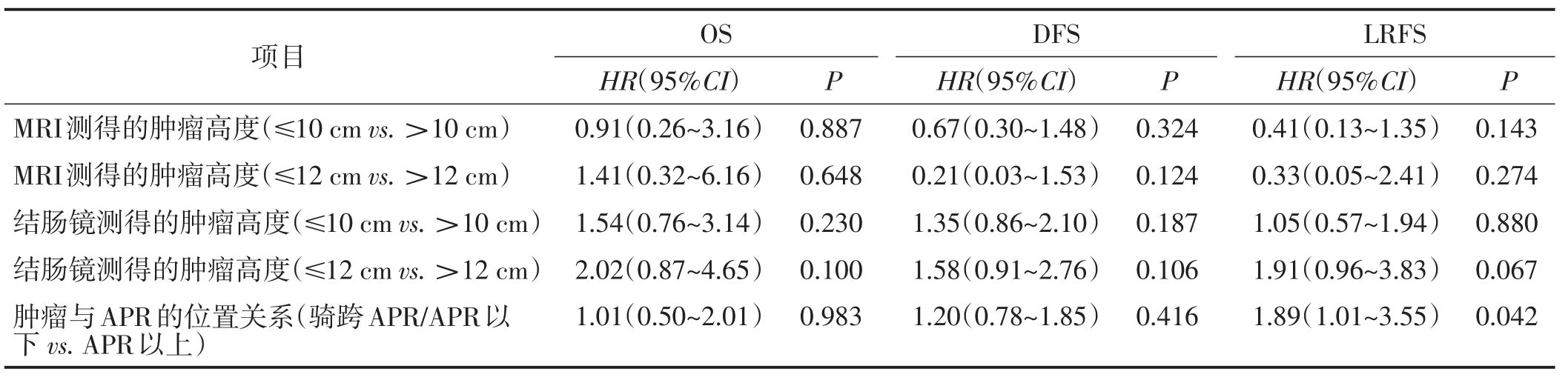
表4 基于5种不同的URC定义的患者生存情况分析
2.6 根据5种不同的UURRCC定义筛选出需要行放疗的直肠癌患者比例分析
根据前文提到的多个权威指南,URC不需要行放疗,中低位直肠癌需要放疗。我们统计了采用5种不同的URC定义时,需要放疗的直肠癌患者的百分比,结果表明,与其他4种基于MRI或结肠镜测得的某个固定肿瘤高度的定义相比,使用以APR为标志的定义时,临床认为需要放疗的直肠癌患者比例更少【61.5%vs.(71.2%~93.0%)】。见表5。

表5 根据5种不同的URC定义筛选出需要行放疗的直肠癌患者比例 n(%)
3 讨论
尽管目前多个指南都不推荐URC患者接受放疗,但不同指南对URC的定义差别很大。我们的研究表明,APR高度与性别和身高相关,APR以上直肠癌的局部复发率显著低于骑跨APR/APR以下的直肠癌。多因素Cox比例风险回归模型分析结果表明,肿瘤与APR的位置关系是LRFS的独立影响因素。在生存分析中发现,结肠镜、MRI测得的肿瘤高度对OS、DFS和LRFS无明显影响。亚组分析显示,在骑跨APR/APR以下的直肠癌患者中,放疗组的LRFS明显长于未放疗组;对于APR以上的直肠癌患者,放疗组和非放疗组在OS、DFS和LRFS方面差异无统计学意义。此外,与其他4种定义相比,以APR为标志定义URC时需要行放疗的直肠癌患者更少。因此,我们认为,将URC定义为APR以上的直肠癌,可能更有助于精准选择Ⅱ/Ⅲ期直肠癌患者进行术后辅助放疗。
据我们所知,本研究是第一个探讨URC的不同定义在Ⅱ/Ⅲ期直肠癌患者放疗决策中指导价值的研究。2020年NCCN指南将APR以上的直肠癌定义为URC,但是建议所有URC患者应接受新辅助或辅助放疗[1]。在本研究中,我们发现以APR为标志来定义URC,可以更好地指导Ⅱ/Ⅲ期直肠癌患者术后辅助放疗的决策。肿瘤与APR的位置关系可以通过术前MRI与术中检查来判定。对于术后放疗的选择,术中判定肿瘤与APR的位置关系更为直接和准确,因为APR在开腹或腹腔镜手术中很容易识别[12,14]。对于术前放疗的选择,术前MRI是识别APR最有用的方法。
本研究中85.9%的病例术前MRI图像上可见APR,这与以往其他研究的结果相似[13,20]。我们的结果还显示,MRI对APR以上、骑跨APR和APR以下肿瘤的定位准确率分别为89.1%、95.3%和93.1%。其他研究中的相应百分比分别为70%、50%和98.2%[20],以及93.5%、90.0%和84.6%[17],结果较为相近。不同性别、不同身高的患者APR高度差异较大。一些研究通过术中硬式乙状结肠镜测量了APR高度。在美国一项对50名患者的研究中,女性APR的中位高度为9.0(范围:5.5~13.5)cm,男性APR的中位高度为9.7(7.0~16.0)cm[14]。在韩国对46名患者进行的研究中,男性APR的平均高度为(8.8±2.2)cm,女性为(8.1±1.7)cm[12]。直肠MRI也可用于测量APR高度,一项使用MRI测量APR高度的大型研究(n=319)显示,女性和男性之间APR的高度比较差异有统计学意义【(10.4±1.1)cm vs.(10.0±1.2)cm,P=0.014】[20]。我们的结果显示,MRI测量的中位APR高度为8.7(4.5~14.3)cm,与身高呈正相关,这与已发表的研究结果相符[12,14]。
硬式乙状结肠镜被推荐用于测量直肠癌的肿瘤高度,但它仅在部分患者中进行[21],在我国并不常用,我国通常使用软式结肠镜、DRE和MRI。目前筛查和检测结直肠癌的金标准是软式结肠镜[22]。ES⁃MO指南指出,通过硬式结肠镜和软式结肠镜测量直肠癌的肿瘤高度差异很小[23]。因此,如果硬式乙状结肠镜不可用,软式结肠镜也是可接受的替代方法。采用MRI测量肿瘤高度是硬式乙状结肠镜检查的一种可重复的替代方法[21]。在硬式乙状结肠镜检查时,因为测量的是直线距离,所以测得的肿瘤高度可能偏低。用MRI测量时,这个距离是由多条线段的距离相加得出来的。对于高位直肠癌,肿瘤高度等于多条线段的长度之和,这可能会导致测量的肿瘤高度偏高。我们的结果表明,不同方法测量肿瘤高度的结果存在较高的相关性,但是在许多情况下仍然存在显著差异[24]。与上述基于某一个固定肿瘤高度的定义方法相比,APR是一个独特的个性化的标志。APR将直肠癌分为腹膜内和腹膜外两组。与腹膜外直肠癌患者[15]相比,腹膜内直肠癌的局部复发率更低,我们的研究结果与之相符。本研究的结果表明,放疗延长了骑跨APR/APR以下的直肠癌患者的LRFS,放疗对APR以上直肠癌患者的OS、DFS和LRFS无影响,这与以往的研究结果相符[4-5,25]。
我们的研究结果表明,APR以上的URC局部复发率较低,其中放疗组与非放疗组的LRFS比较差异无统计学意义。肿瘤与APR的位置关系是LRFS的独立影响因素,而DRE、MRI或结肠镜测量的肿瘤高度与OS、DFS、LRFS无关。因此,将URC定义为APR以上的直肠癌,显著优于基于MRI和结肠镜测量的某一个固定肿瘤高度的其他定义。
本研究也存在一定的局限性:首先,本研究为回顾性研究,在临床实践中,我们通常只向高危患者推荐术后辅助放疗,因此,选择偏倚是不可避免的;其次,本研究排除了切缘阳性的患者,当中一些接受R1/R2切除的URC患者可能也需要行术后辅助放疗;再次,由于各种原因,纳入的患者没有按照NCCN和ESMO指南的建议进行术前CRT。在亚洲国家(中国、日本、韩国),术后辅助CRT或辅助化疗被认为是Ⅱ期或Ⅲ期直肠癌的首选治疗方法,尤其是低危患者和URC患者[26];最后,我们没有硬式乙状结肠镜测得肿瘤高度的数据,因为这在我国并不常用。
综上所述,将URC定义为APR以上的直肠癌,显著优于基于MRI和结肠镜测量的某一个固定肿瘤高度的其他定义。这一定义不仅有助于我们选择合适的Ⅱ/Ⅲ期直肠癌患者进行放疗,减少不必要的放疗,而且有助于减少放疗相关的毒副作用和医疗费用。术前MRI、手术记录和术后组织病理报告应详细记录肿瘤与APR的位置关系,用于预测疗效和制定术后辅助放疗计划。然而,本研究的结论还需要更大样本的前瞻性随机对照试验来验证。
