出生后不同发育阶段小鼠耳蜗Connexin30的表达△
2021-09-30刘文静王文王旭东杨军
刘文静 王文 王旭东 杨军
缝隙连接是一种连接细胞间的通道,由相邻细胞膜上的两个半通道组成,半通道又是由6个相同(同聚体半通道)或不同(异聚体半通道)缝隙连接蛋白(Connexin,Cx)构成。 Cx在听觉功能中发挥十分重要的作用,研究证实,编码Cx26和Cx30的GJB2以及GJB6基因突变是导致人类非综合征型遗传性聋最常见的原因[1],但Cx26和Cx30致聋机制目前尚未完全明确。人类GJB2基因与GJB6 具有77%的序列同源性,但Cx26和Cx30两种蛋白在耳蜗功能中各自具有独特的功能和不可替代的作用[2]。有研究发现,内淋巴电位(EP)的大幅度下降是GJB6基因敲除导致先天性聋的重要原因之一[3]。GJB6基因敲除可能通过小鼠对耳蜗血管纹内皮细胞超微结构的影响造成内皮细胞屏障破坏,从而引起EP缺失,最终导致耳聋[4]。EP的生成主要源于耳蜗外侧壁,对耳蜗放大器及耳蜗高敏感性起重要作用。EP在小鼠新生阶段出现,2周左右达成年水平,这表明出生后早期Cx30的表达在EP发育过程中具有重要意义。Cx的正常表达是决定缝隙连接生理作用的主要因素之一,连接蛋白在早期发育过程中的研究有利于阐明因GJB2基因异常而导致先天性聋的部分机制[5]。然而,Cx30在耳蜗早期发育过程中的表达及定位的研究较少,故本研究拟通过检测出生后不同阶段小鼠耳蜗的Cx30表达分布及其变化,探讨其在听觉功能中可能发挥的作用,为Cx30致聋机制的研究提供参考。
1 材料与方法
1.1实验动物及分组 选取10周龄健康BALB/c小鼠8对作为种鼠,外耳道清洁,耳廓反射均正常。每对种鼠提供1个年龄段的新生鼠,按照出生后的天数将小鼠分为出生后(postmatal day,P)1天(P1)、5天(P5)、7天(P7)、10天(P10)、14天(P14)、21天(P21)以及30天(P30)共7组,每组6只。
1.2实验方法
1.2.1耳蜗标本制备 将小鼠用4%多聚甲醛及0.9%生理盐水经心脏灌注,迅速断头,置入新鲜配制的4%多聚甲醛溶液,在解剖显微镜(Leica,德国)下取出耳蜗;开放圆窗及卵圆窗,蜗尖打孔,行蜗管内灌注,室温后固定1 h。P7及P7以上天龄的小鼠耳蜗置于10%EDTA4 ℃酌情脱钙,定时更换脱钙液,15%蔗糖溶液4 ℃浸泡3 h,30%蔗糖溶液过夜沉底。OCT(optimal cutting temperature)包埋剂4 ℃包埋3 h,沿耳蜗蜗轴水平作冰冻切片(Leica恒冷冰冻切片机),片厚7 μm。
1.2.2免疫荧光染色 新鲜耳蜗冰冻切片室温晾干1 min,PBS漂洗,洗OCT胶;0.3%Triton X-100/10%驴血清溶液室温通透封闭处理35 min,PBS漂洗,滴加兔抗小鼠Cx30多克隆抗体(1∶200,Life Technologies公司)以及耳蜗支持细胞标记蛋白羊抗小鼠Sox2单克隆抗体(1∶200,Santa Cruz Biochemicals公司)4 ℃孵育过夜,用PBS代替一抗作空白对照,PBS漂洗;加抗兔Alexa Fluor 546 (1∶200,碧云天公司)和IFKineTMGreen Donkey Anti-Goat IgG (1∶200,博士德公司)37 ℃孵育1 h,PBS漂洗。DAPI(1∶800,碧云天公司)染核5 min,抗荧光淬灭剂封片。激光共聚焦显微镜(Leica,德国)下观察,激发波长分别为561 nm、488 nm以及405 nm,绿色及红色荧光为阳性结果。采用Image-Pro Plus 6.0软件计算Cx30在P1、P5、P7、P10、P14、P21和P30小鼠耳蜗血管纹,P5、P7、P10、P14、P21和P30螺旋缘以及P7、P10、P14、P21和P30 Deiters细胞3个区域免疫荧光阳性染色的平均光密度值(average optical densities,AOD)。
1.3统计学方法 采用IBM-SPSS24.0(IBM Company,Armonk,New York,USA)软件包进行统计学分析,多组间均数比较采用单因素方差分析(one-way ANOVO),P<0.05为差异有统计学意义。
2 结果
2.1不同天龄小鼠耳蜗Cx30的表达 各组小鼠耳蜗外侧壁均可见Cx30表达分布,并随鼠龄的增加而出现年龄相关性改变。在P1组小鼠耳蜗Cx30呈点状,其主要表达于不同蜗回的大上皮嵴柱状细胞和耳蜗外侧型,大上皮嵴是出生后耳蜗早期发育阶段特有的细胞群,其胞核可被Spx2标记;在P1组Cx30呈点状染色分布于不同蜗回的大上皮嵴顶部和基底部;而在不同蜗回的耳蜗外侧壁Cx30阳性表达有差异,在顶回耳蜗外侧壁未见有Cx30的表达,在中回,耳蜗外侧壁开始出现Cx30的表达,其表达定位在毗邻血管纹基底细胞的部分螺旋韧带Ⅰ型纤维细胞;在底回,Cx30阳性表达不仅出现在螺旋韧带纤维细胞,而且也表达于血管纹基底细胞(图1a~i)。在P5组,不同蜗回的耳蜗外侧壁均有Cx30表达,其呈连续线状集中分布在血管纹基底细胞;螺旋韧带纤维细胞中Cx30的表达消失。另外,螺旋缘内齿细胞和纤维细胞开始出现Cx30的点状染色,在听觉上皮,Cx30在大上皮嵴的染色不均匀分布,部分区域呈点状染色,部分区域呈颗粒聚集(图2a~f)。在P7组,大上皮嵴、螺旋缘及血管纹基底细胞均可见Cx30的表达,且其开始出现在Corti器支持细胞;Cx30点状染色分布在3排Deiters细胞膜的侧面(图3a~f)。在P10组的听觉上皮,Cx30在Corti器Deiters细胞的阳性表达清晰显著,尤其是在基底侧;除了残留大上皮嵴细胞和螺旋缘外,内凹细胞开始有Cx30的表达;Cx30仍表达在血管纹基底细胞,呈锯齿状分布(图3g~i)。在P14组,伴随小鼠听觉的形成,大上皮嵴退化解体,Cx30在内凹细胞呈现连续条带状染色;Corti器中Deiters细胞、Hensen细胞以及环绕内毛细胞的内指细胞均有Cx30的表达;耳蜗外侧壁Cx30分布范围自血管纹基底细胞向外延伸至螺旋韧带,螺旋韧带纤维细胞几乎全部表达Cx30;Cx30在螺旋缘中的表达无明显变化(图4a~f)。在P21和P30组,Cx30在Corti器支持细胞、血管纹基底细胞、螺旋韧带和螺旋缘中持续性表达(图5a~i)。

图1 P1小鼠耳蜗Cx30的表达分布 a.Cx30(红色荧光)在P1耳蜗不同蜗回均有表达; b.在P1顶回,Cx30分布在大上皮嵴和外沟细胞; c.P1螺旋缘未见Cx30的表达; d、e.Cx30(红色荧光)和Sox2(绿色荧光)在P1中回的表达,Cx30表达在血管纹后方螺旋韧带纤维细胞、大上皮嵴和外凹细胞。Sox2标记大上皮嵴柱状细胞; f.图1d和图1e的叠加成像; g.Cx30表达在P1底回血管纹基底细胞、少量螺旋韧带纤维细胞和外凹细胞; h.Cx30表达在P1底回大上皮嵴; i.为图1g和图1h的叠加。ger:大上皮嵴(greater epithelial ridge),OS:外沟细胞(outer sulcus),sb:螺旋缘(spiral limbus),SV:血管纹(stria vascularis),SL:螺旋韧带(spiral ligament)。 图2 P5小鼠耳蜗Cx30的表达分布 a.Cx30表达分布在P5不同蜗回的耳蜗外侧壁、螺旋缘及大上皮嵴; b.P5螺旋缘内齿细胞及纤维细胞可见Cx30的表达; c.P5血管纹基底细胞可见Cx30的表达; d、e.P5听觉上皮Cx30(红色荧光)和Sox2(绿色荧光)的表达分布。Cx30表达分布在P5大上皮嵴,Sox2标记大上皮嵴柱状细胞; f.为图2g和图2h的叠加。ger:大上皮嵴(greater epithelial ridge),sb:螺旋缘(spiral limbus),Sf:血管纹(stria vascularis),SL:螺旋韧带(spiral ligament)。

图3 P7和P10小鼠耳蜗Cx30的表达分布 a~c.P7血管纹基底细胞和螺旋缘可见Cx30的表达; d、e.P7听觉上皮Cx30(红色荧光)和Sox2(绿色荧光)的表达分布,Deiters细胞(箭头)可见Cx30的表达; f.为图3d和图3e的叠加; g~i. P10血管纹基底细胞、螺旋缘、大上皮嵴、Deiters细胞、内凹细胞和外沟细胞可见Cx30的表达。ger:大上皮嵴(greater epithelial ridge),sb:螺旋缘(spiral limbus),dc:Dei-ters细胞(Deiters cells), OS:外沟细胞(outer sulcus),is:内凹细胞(inner sulcus),SV:血管纹(stria vascularis),SL:螺旋韧带(spiral liga-ment)。 图4 P14小鼠耳蜗Cx30的表达分布 a~c.血管纹基底细胞以及螺旋韧带纤维细胞可见Cx30的表达; d.螺旋缘及内凹细胞可见Cx30的表达; e. Cx30表达分布在Corti器Deiters细胞、Hensen细胞、内指细胞; f.P14听觉上皮Cx30(红色荧光)和Sox2(绿色荧光)图像叠加。sb:螺旋缘(spiral limbus),dc:Deiters细胞(Deiters cells),hc: Hensen细胞(Hensen cells),is:内沟细胞(inner sulcus),SV:血管纹(stria vascularis),SL:螺旋韧带(spiral ligament),sb:螺旋缘(spiral limbus),iph:内指细胞(inner phalangeal cells)。

图5 P21及P30小鼠耳蜗Cx30的表达分布 a~c.P21组螺旋韧带纤维细胞以及血管纹基底细胞可见Cx30的表达;d.P21组螺旋缘及内凹细胞有Cx30的表达;e. P21听觉上皮Cx30的表达分布。Cx30表达分布在Corti器内指细胞、Deiters细胞和Hensen细胞;f.在明场下观察Cx30在P21听觉上皮Cx30的表达分布;g、h.在P30,螺旋韧带纤维细胞、血管纹基底细胞及螺旋缘可见Cx30的表达;i.Corti器中Cx30(红色荧光)和Sox2(绿色荧光)图像叠加,Cx30表达分布在Corti器中内指细胞和Deiters细胞。sb:螺旋缘(spiral limbus),dc:Dei-ters细胞(Deiters cells),hc:Hensen细胞(Hensen cells),is:内沟细胞(inner sulcus),SV:血管纹(stria vascularis),SL:螺旋韧带(spiral liga-ment),sb:螺旋缘(spiral limbus),iph:内指细胞(inner phalangeal cells)。
2.2免疫荧光半定量分析 不同发育阶段小鼠耳蜗螺旋缘、Deiters细胞和血管纹Cx30的平均光密度值比较见表1,可见,与P5组相比较,P7、P10、P14、P21和P30组耳蜗螺旋缘Cx30平均光密度值增高(P<0.05);与P7组相比,P10、P14、 P21和P30 Deiters细胞Cx30平均光密度值明显增加(P<0.05);与P1组比较,P5、P7、P10、P14、 P21和P30血管纹中Cx30平均光密度值均增高(P<0.05)。
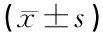
表1 不同天龄小鼠耳蜗不同部位Cx30的平均光密度值(n=6只)
3 讨论
缝隙连接通道可通过介导离子、第二信使和小分子代谢物等发育所需的营养物质在细胞间的传递,执行细胞间通讯,从而实现其在组织发育过程中的作用。有研究报道Cx30条件敲除小鼠Corti器内毛细胞发育受阻及外毛细胞带状突触数量的减少,影响神经递质的释放,进而引起感觉毛细胞声音信号传递的异常[6,7]。本研究结果显示,出生后各个发育阶段小鼠耳蜗均可见Cx30的表达,出生后早期阶段,小鼠耳蜗Cx30特异性表达在大上皮嵴及外沟细胞;在听觉形成时,大上皮嵴退化及凋亡,最终被内凹细胞替代,Cx30的表达亦消失。Jagger等[8]通过全细胞膜片钳联合荧光染料示踪技术,发现大上皮嵴细胞间染料的扩散,缝隙连接和半通道阻断剂可将大上皮嵴细胞间染料耦联受阻,从而确定了其细胞间存在功能性的缝隙连接耦合。另有研究报道,在听觉形成前,Cx组成的半通道可介导大上皮嵴自发性释放三磷酸腺苷(ATP),促使未成熟的内毛细胞去极化,从而引起初级听觉神经元动作电位的发放[9]。本研究结果显示,P1~P5小鼠耳蜗Corti器Deiters细胞Cx30无明显表达,提示在此发育阶段耦联大上皮嵴细胞和外沟上皮细胞的缝隙连接通道尚未形成,进一步说明大上皮嵴ATP的释放可能不依赖于缝隙连接,而通过半通道单独发挥作用。已有研究报道,大上皮嵴发育异常可能导致先天性耳聋[10],因此,可以认为Cx30在大上皮嵴的早期表达在维持其正常生理活动中起重要作用。
文中结果显示在Corti器支持细胞,Cx30的表达亦呈现年龄依赖性,到P7时Deiters细胞开始有Cx30的表达,并随着年龄的增长其表达出现变化。荧光染料示踪技术也证实了听觉形成前不同鼠龄Corti器支持细胞间染料耦联存在差异[11],据报道,出生后早期Deiters细胞中缝隙连接蛋白的表达在钙波形成中起十分重要的作用;在耳蜗支持细胞和外沟细胞,Cx26和Cx30组成的同型缝隙连接或异型缝隙连接是钙波产生及传播的解剖生理基础[12],Cx26或Cx30表达的缺陷可抑制耳蜗细胞钙波的产生和传播。超微结构研究显示,Cx30缺失小鼠Corti器支持细胞缝隙连接斑面积和数量明显减少,同时,缺失Cx30亦可影响D-葡萄糖同系物在支持细胞间扩散的速度和范围,并认为Cx30突变引起耳聋的原因可能是耳蜗内葡萄糖重要代谢物质的转运障碍;此外,Cx30介导的细胞间通讯在促进感觉毛细胞损伤修复过程中也有着相当重要的作用,Cx30突变可致支持细胞迁移修复能力下降[13]。
本研究中,Cx30在小鼠耳蜗侧壁的表达也具有年龄依赖性。新出生阶段,Cx30表达分布在血管纹基底细胞及其和临近的少量螺旋韧带纤维细胞,该阶段这些细胞已被实验证实存在区域性染料扩散,另外,这一发育阶段血管纹基底细胞可由出生后的螺旋韧带纤维细胞通过间质上皮转化生成[14]。由此可以推测,Cx30及其形成的缝隙连接通道可能参与血管纹的发育过程。在P14,Cx30表达的扩展与EP成熟的时程相平行,提示Cx30在耳蜗侧壁的早期表达及其发育中的表达变化对EP的产生和维持具有十分重要的意义。此外,本研究还发现Cx30在生后早期小鼠螺旋缘的表达变化,即:P1时螺旋缘Cx30无表达,到P5时Cx30开始表达,且持续至成年。已有研究提出,Cx30或Cx26组成的缝隙连接通道可介导成年鼠螺旋缘纤维细胞之间葡萄糖的转运[15],对维持耳蜗离子稳态具有十分重要的作用。本实验结果进一步指出,螺旋缘细胞间Cx30以及由Cx30介导的缝隙连接细胞间通讯在出生后早期建立,以保证听觉功能发育的需要。
本研究用免疫荧光染色方法检测了Cx30在出生后不同天龄小鼠耳蜗中的表达及分布,发现了其在出生后耳蜗早期发育过程中表达的时空差异性,小鼠听觉形成后,Cx30的表达趋于稳定,据此推断Cx30年龄相关性表达可能在听觉功能的建立和成熟过程中具有十分重要的作用;这尚需通过后续实验进一步研究证实。
