DcR3 ALB水平与慢阻肺急性加重期合并呼衰患者转归关系
2021-09-29赵佳媛许婷婷刘长江张黎黎
赵佳媛,许婷婷,吴 笛,赵 斌,刘长江,张黎黎
(吉林省吉林市化工医院,吉林 吉林 132021))
慢性阻塞性肺疾病(COPD)的主要特征为不完全可逆气流受限,是呼吸系统的常见疾病[1,2],具有发生率高、病因复杂、防治困难的特点,对人们的健康安全造成了较大的威胁。慢性阻塞性肺疾病急性加重期(AECOPD)患者由于合并肺功能障碍,常伴随呼吸衰竭症状,增加患者的死亡风险。随着临床研究的不断深入,发现细菌感染是引起COPD患者病情加重的重要原因[3],且与炎症因子过度表达有密切的相关性,如C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)等。TNF-α可与肿瘤坏死因子受体结合,从而导致大量炎症因子施放,加速细胞凋亡,从而引起COPD患者病情加重。诱骗受体3(DcR3)可与TNF-α结合且生成TNF-DcR3,其无法介导细胞凋亡信号,从而抑制TNF-α调控炎症因子的作用,具有抑制特殊细胞凋亡的效果。血清白蛋白(ALB)在人体具有重要的生理功能,能够维持血浆胶体渗透压稳定性,且能够与让多种难溶性小分子有机物和无机离子可逆性结合形成复合物,并且能够实现细胞内液、外液与组织液间的交流[4]。文章选取2017 年5月至2019年5月93例医院收治慢性阻塞性肺疾病急性加重期患者,针对DcR3、ALB水平对AECOPD合并呼吸衰竭患者转归关系展开分析,报道如下。
1 资料与方法
1.1一般资料:选取2017年5月至2020年5月93例医院收治慢性阻塞性肺疾病急性加重期患者作为观察对象,根据患者有无合并呼吸衰竭分为观察组(合并呼吸衰竭,41例)和对照组(无呼吸衰竭症状,52例)。
1.2方法:采用全自动生化分析仪检测血清白蛋白(ALB)以及C反应蛋白(CRP)水平,并采用酶联免疫吸附法检测诱骗受体3(DcR3)和肿瘤坏死因子-α(TNF-α),然后使用血气分析仪检测PO2和PCO2水平,使用肺功能测定仪检查第1秒用力呼吸容积占预计值百分比(FEV1%)和第1秒用力呼吸容积用力肺活量百分比(FEV1/FVC)水平。
1.3观察指标:观察两组患者在血清生化及炎症因子指标、动脉血气指标以及肺功能指标方面的差异,采用电话随访1年观察两组患者的存活率,同时通过多因素分析影响AECOPD合并呼吸衰竭患者预后情况的独立危险因素。
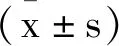
2 结 果
2.1两组患者一般资料比较:两组患者一般资料差异无统计学意义(P>0.05),存在可比性,见表1。
2.2两组患者血清生化及炎症因子指标差异:观察组DcR3、CRP、TNF-α均明显高于对照组(P<0.05),观察组ALB明显低于对照组(P<0.05),见表2。
2.3两组患者动脉血气指标及肺功能指标差异:观察组PO2明显低于对照组(P<0.05),且在PCO2明显高于对照组(P<0.05),观察组患者FEV1%、FEV1/FVC均明显低于对照组(P<0.05)。见表3。
2.4两组患者的1年存活率及影响因素分析:观察组与对照组患者的1年存活率为16例(39.0%)和32例(61.54%),观察组患者的1年存活率明显低于对照组(χ2=4.653,P=0.031<0.05)。以观察组患者死亡与否为因变量,将患者DcR3、ALB、CRP、TNF-α、PO2、PCO2、FEV1%、FEV1/FVC各项指标纳入多元Logistic回归分析通过多因素分析发现,DcR3、ALB、CRP、TNF-α、PO2、PCO2、FEV1%、FEV1/FVC是影响AECOPD合并呼吸衰竭患者预后情况的独立危险因素,见表4。
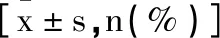
表1 两组患者一般资料比较结果
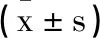
表2 两组患者血清生化及炎症因子指标差异
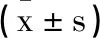
表3 两组患者动脉血气指标差异

表4 影响AECOPD合并呼吸衰竭患者预后情况的多因素分析
3 讨 论
慢性阻塞性肺疾病(COPD)是一种常见的呼吸系统疾病,具有病程长、发生率高且死亡率高的特点[5],对患者的劳动力和生活质量造成直接影响,增加家庭与社会的负担。WHO相关报道预测到2025年COPD发生率将升高至第三名[6]。该病在我国发生率较高,COPD患者总人数超过4000万,且有超过500万患者因该病丧失劳动能力,有100万患者死于该病。慢性阻塞性肺疾病急性加重期(AECOPD)是COPD进展中的重要阶段,表现为患者的呼吸症状加重,需要改变治疗方法,避免严重并发症的发生。肺功能障碍是AECOPD患者死亡的重要原因,目前主要是采取机械通气的治疗方法,能够有效改善呼吸衰竭的症状。但是临床研究发现,AECOPD合并呼吸衰竭患者与无合并呼吸衰竭的AECOPD患者相比预后较差[7]。因此,需要分析影响AECOPD合并呼吸衰竭患者的独立危险因素,从而指导临床治疗和预后评估。
TNF-α是有单核细胞、巨噬细胞表达的一种细胞因子[8],具有促炎效果,生物活性多,可刺激气道平滑肌释放内皮素-1,从而引起平滑肌收缩,引发气道重塑。TNF-α在COPD患者急性加重中起到了重要的作用,是患者免疫应道的重要介质,可导致炎症因子、氧自由基以及脂类异常表达,引发肺功能损伤。TNF-α表达水平升高加重了炎症反应,导致气道分泌物增加,容易诱发呼吸衰竭。机体免疫机制在炎症反应发生之后会增加抗炎介质的表达,从而控制炎症反应,其中以DcR3的作用最为突出。DcR3可与TNF-α结合,在部分恶性肿瘤患者中的表达水平较高。临床研究发现DcR3能够促使巨噬细胞向抗炎特性转变,从而减少其炎症因子表达,同时能够阻断淋巴毒素介导的细胞凋亡信号介导,能够有效激活树突状细胞,参与细胞免疫调节机制,促使Th1/Th2平衡。DcR3能够有效降低TNF-α活性,从而降低人体促炎因子表达水平,有效降低炎症水平。
ALB也是炎性指标的一种[9],其的生理作用为:①维持渗透压:ALB的分子量小,但是在血浆总蛋白中的所占比重高,能够维持渗透压的稳定性[10]。②物质交换:ALB能够通过调节组织液改善微循环,并实现血液与组织液中的物质交换,当ALB下降后,血浆渗透压下降,血液中的水分会进入组织间隙,从而引起水肿症状。因此对于合并低蛋白血症的危重症患者主要是通过输注白蛋白来改善渗透压,从而减少肺水肿发生率。③结合与运输功能:ALB能够与多种物质结合,从而为许多组织器官提供营养物质。例如与肾上腺皮质激素、性激素结合,从而让这些激素维持较长的作用时间,同时还可与许多药物结合,对药物代谢与清除造成影响。④清除自由基:ALB可通过与Cu2+结合抑制自由基的产生。⑤抗凝效果:ALB具有负电荷,能够与NO-结合产生抗凝效果,但也有可能增加出血风险。
本次研究中观察组与对照组的DcR3为(11.5±4.2)ng/mL和(4.6±1.6)ng/mL,ALB为(22.2±4.6)g/L和(34.6±7.5)g/L,CRP为(48.6±16.5)mg/L和(25.4±7.5)mg/L,TNF-α为(662.5±220.6)pg/mL和(413.6±181.6)pg/mL,观察组DcR3、CRP、TNF-α均明显高于对照组(P<0.05),观察组ALB明显低于对照组(P<0.05),这说明AECOPD合并呼吸衰竭患者血清CRP、TNF-α水平明显高于对照组,因此DcR3也明显升高,而AECOPD合并呼吸衰竭患者的ALB水平明显低于对照组(P<0.05),提示AECOPD合并呼吸衰竭与炎症反应异常升高有密切的相关性,而DcR3升高与机体免疫应答机制有密切相关性,ALB下降与肝功能下降有一定的相关性。
研究指出,呼吸衰竭的出现导致患者血氧水平下降[11],因此本次观察组与对照组的PO2为(5.6±1.0)kPa和(10.6±1.8)kPa,PCO2为(7.6±1.6)kPa和(5.3±1.2)kPa,观察组PO2明显低于对照组(P<0.05),且在PCO2明显高于对照组(P<0.05),这说明AECOPD合并呼吸衰竭容易引起低氧血症,加重机体缺氧性损伤,引发全身性炎症反应,对患者的预后造成了较大的影响。肺功能检查主要是反映肺部通气以及肺容量情况,本次观察组与对照组FEV1%为(32.1±6.5)和(48.6±9.6),FEV1/FVC为(40.6±8.4)和(53.6±10.6):观察组患者FEV1%、FEV1/FVC均明显低于对照组(P<0.05);观察组与对照组患者的1年存活率为39.0%和61.54%,观察组患者的1年存活率明显低于对照组(P<0.05),这说明AECOPD合并呼吸衰竭的肺功能明显下降。
通过多因素分析发现,DcR3、ALB、CRP、TNF-α、PO2、PCO2、FEV1%、FEV1/FVC是影响AECOPD合并呼吸衰竭患者预后情况的独立危险因素。DcR3具有抗细胞凋亡、抑制炎症因子表达、抑制T细胞趋化以及过激免疫应答发挥作用。DcR3在脓毒症、全身性炎症反应综合征、癌症中有异常表达的特点,主要与其免疫调节效果有密切的相关性。DcR3对炎症反应有着较高的敏感性,可用于评价COPD患者的炎症反应水平。ALB是血浆中含量最多的蛋白质,占血浆总蛋白的40~60%,半衰期为15~19d,对血浆渗透压维持、自由基清除、抑制血小板聚集、内源性和外源性物质运输具有重要作用。血清ALB水平受多重因素的影响,在临床诊断、治疗以及预后评估中具有广泛应用。血清ALB正常范围在35~55g/L,当血清ALB水平下降时,更容易发生心脑血管疾病。
综上所述,与无呼吸衰竭症状的AECOPD患者相比,AECOPD合并呼吸衰竭患者DcR3表达水平异常升高,而ALB水平呈下降趋势,与患者的疾病转归有密切的相关性。
