秀珍菇菌丝活化培养条件优化
2021-09-29周灯银王寿容吴智艳解春艳
林 童 周灯银 马 博 王寿容 吴智艳,2,3 解春艳*
(1廊坊师范学院生命科学学院,河北廊坊065000;2河北省食药用菌资源高值利用技术创新中心,河北廊坊065000;3廊坊市微生物发酵研究重点实验室,河北廊坊065000;4廊坊市食品营养与安全重点实验室,河北廊坊065000)
秀珍菇Pleurotus geesteranus,是常见的食用菌之一,味道鲜美,蛋白质含量丰富,营养价值与牛奶相当,含有人体所需的8种必需氨基酸及多种矿质元素,营养价值极高[1-3]。秀珍菇属于白腐真菌之一,吸收由自身分泌胞外酶裂解基质成小分子物质完成营养生长和生殖生长,即由胞外木质素酶及纤维素酶来分解基质中的木质纤维素作为自身所需的营养物质[4-7]。而秀珍菇菌丝分泌胞外酶的能力与培养基成分(如碳源、氮源、pH等)及培养周期有密切的关联。
固态发酵是微生物在无游离水或游离水含量极低的环境中生长的过程。在这个过程中,固态基质可以看作是微生物整个生长代谢过程中营养和能量的来源,是微生物生长中必不可少的重要依存物质[8-9]。固态发酵对人类饮食的历史重要性可以追溯到几千年前,如西方国家的面包、奶酪制作及东方国家的酒曲。与液体发酵相比,固态发酵具有设备构造简单、能耗低、易操作、污染少等特点。食用菌固态发酵经过多年的发展,在农业、食品、工业、环境、能源等有重要的应用价值[10-13]。秀珍菇为常见的食用菌之一,可以利用其菌丝胞外酶特性固态发酵谷物等粮食作物,提高谷物的营养价值,具有投资少、成本低、可大规模生产等优点,促进谷物的精深加工。
观测秀珍菇菌丝的生长特性、胞外酶活性及菌丝生长周期等,探寻固态发酵前秀珍菇活化的最佳菌丝状态,以期获得最佳的秀珍菇活化培养条件,提高其各方面性能,促进固态发酵效率,为秀珍菇固态发酵谷物等粮食作物提供借鉴,也为其他食用菌固态发酵、理化性质的研究及新品种的选育提供科学的依据。
1 材料与方法
1.1 材料与试剂
供试秀珍菇菌株080009,引自河北省食药用菌资源高值利用技术创新中心。土豆购于廊坊元辰超市。其他试剂:酵母粉、蛋白胨、乳糖、蔗糖、硝酸铵、盐酸、苯酚、浓硫酸、氢氧化钠、葡萄糖、羟甲基纤维素钠、二硝基水杨酸法(DNS)等均购自天津鼎国生物技术有限公司。
1.2 主要仪器设备
BPC-150生化培养箱,上海一恒科学仪器有限公司;TD5A-WS低速离心机,长沙湘仪离心机仪器有限公司;PHS-25-01型pH计,上海盛磁仪器有限公司;BAS224S赛多利斯电子天平,赛多利斯科学仪器(北京)制造有限公司;DHG-9070鼓风干燥箱,中仪国科(北京)科技有限公司;SW-CJ-2FD超净工作台,苏净安泰空气技术有限公司;HH-4数显恒温水浴锅,上海力辰邦西仪器科技有限公司;L3L4物联智能紫外可见分光光度计,上海佑科仪器仪表有限公司;OLB-2102C恒温振荡器,济南敏创生物科技有限公司。
1.3 试验方法
1.3.1 培养基的制备
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,KH2PO43 g,MgSO41.5 g,VB10.01 g,蒸 馏水1 000 mL,pH自然。
加富PDA培养基:PDA培养基中加入5 g/L蛋白胨。
无氮培养基:葡萄糖20 g,KH2PO43 g,MgSO41.5 g,VB10.01 g,琼脂20 g,蒸馏水1 000 mL,pH自然。
无碳培养基:蛋白胨5 g,KH2PO43 g,MgSO41.5 g,VB10.01 g,琼脂20 g,蒸馏水1 000 mL,pH自然。
液体培养基:上述固体培养基中去除琼脂。所有培养基均经121℃20 min高温高压灭菌后使用。
1.3.2 菌丝培养及检测
利用PDA平板培养基初步活化秀珍菇菌丝体,待菌丝长满平板,挑选生长状态良好的菌丝,用直径0.8 cm打孔器制作菌饼,放入新的平板中央,于26℃恒温生化培养箱中培养,每个条件4个重复。用十字交叉法每天固定时间测量菌落的直径,同时观察菌丝生长情况,直至菌丝长满平板。
秀珍菇菌丝体活化后,用直径0.8 cm打孔器制作菌饼,放入含100 mL液体培养基的锥形瓶中,每个锥形瓶放5块菌饼,26℃150 r/min振荡培养,3个重复。发酵结束后发酵液离心,取上清液测酶活,取沉淀的菌丝体烘干,称重。
1.3.3 不同氮源对秀珍菇菌丝生长的影响
在无氮培养基中分别加入5 g/L的蛋白胨、硫酸铵、硝酸钾和酵母粉,以无氮培养基、PDA和加富PDA为对照。观察秀珍菇菌丝的生长状态,初步确定氮源。
1.3.4 不同碳源对秀珍菇菌丝生长的影响
在无碳培养基中分别加入20 g/L的乳糖、麦芽糖、淀粉、蔗糖和葡萄糖,以无碳培养基为对照。观察秀珍菇菌丝的生长状态,确定最佳碳源。
1.3.5 不同pH对秀珍菇菌丝生长的影响
加富PDA培养基用1 mol/L盐酸或氢氧化钠调节其pH分别为5.0、6.0、7.0、8.0、9.0、10.0。观察秀珍菇菌丝的生长状态,确定最佳pH。
1.3.6 木质纤维素降解相关的酶活性测定
1.3.6.1 纤维素酶活性测定
葡萄糖标曲的绘制:采用二硝基水杨酸法(DNS)测定葡萄糖含量[14-16]。在540 nm条件下测定不同浓度葡萄糖标准溶液的吸光度值,绘制葡萄糖标准曲线。
羧甲基纤维素酶活性测定:在试管中加入1.5 mL 0.5%的羧甲基纤维素钠溶液(0.1 mol/L醋酸盐缓冲液配制)[17],加入0.5 mL粗酶液,50℃水浴30 min后,采用DNS法测定上清液中葡萄糖的含量,以煮沸灭活15 min的酶液做对照。每个样品3次重复。
半纤维素酶活性测定:在试管中加入1.5 mL 0.5%的木聚糖溶液(0.1 mol/L醋酸盐缓冲液配制)[17],加入0.5 mL粗酶液,50℃水浴30 min后,采用DNS法测定上清液中葡萄糖的含量,以煮沸灭活15 min的酶液做对照。每个样品3次重复。
1.3.6.2 多酚氧化酶活性测定
采用邻苯二酚法测定多酚氧化酶活性[18]。取1 mL 0.1 mol/L邻苯二酚,加入5 mL磷酸盐缓冲液(pH 6.9),混匀,30℃水浴10 min,加入1 mL粗酶溶液,快速摇匀,以煮沸灭活15 min的酶液作为参比液,采用分光光度计于波长410 nm处测定溶液的吸光度。每30 s记录1次,共测定3 min。以1 mL酶液,1 min内增加的吸光度表示酶活性的强弱。
1.3.6.3 愈创木酚酶活性测定
采用比色法测定愈创木酚酶活性[18]。取0.08 mol/L愈创木酚溶液0.5 mL,加入0.1 mL粗酶液,以沸水灭活粗酶液为对照,加入2 mL 0.05 mol/L磷酸盐缓冲液(pH6),混匀后490 nm处测定溶液的吸光度值,每30 s记录1次。
1.3.6.4 漆酶活性测定
采用ABTS法测定漆酶活性[19]。1 mL粗酶液加入2 mL 0.25 mmol/L的ABTS缓冲液,反应3 min,分光光度计测410 nm波长处OD值。每30 s记录1次,定义每分钟使OD均值增加0.1所需的酶量为1个酶活力单位(U),计算酶活性。
1.3.6.5 淀粉酶活性测定
采用DNS法测定淀粉酶活性[20]。将0.5 mL 0.1 mol/L柠檬酸缓冲液(pH5.6)和0.5 mL粗酶液混合,40℃水浴15 min,加入1 mL预热的1%可溶性淀粉混匀,40℃水浴5 min后加入2 mL 0.4 mol/L NaOH混匀,取等量的混合液与DNS试剂混合定容,测吸光度值变化。
2 结果与分析
2.1 培养基氮源筛选
由图1可知,固体培养基为PDA、加富PDA、蛋白胨和酵母粉时,菌落生长速度较快,但加富PDA菌落边缘生长不整齐(表1),而氮源为硫酸铵、硝酸钾及无氮源的培养基培养上,菌丝生长较慢,说明氮源影响菌丝的生长速度。此外,PDA培养基和加富PDA培养基中虽然菌丝生长速度较快,但是菌丝密度较密(表1),菌丝活力弱,而以蛋白胨和酵母粉为氮源时,菌丝生长速度快且菌丝浓密,活力强,第7天菌落直径分别为8.07 cm和8.12 cm,两者相差不大,因此,蛋白胨和酵母粉都有利于秀珍菇菌丝生长。
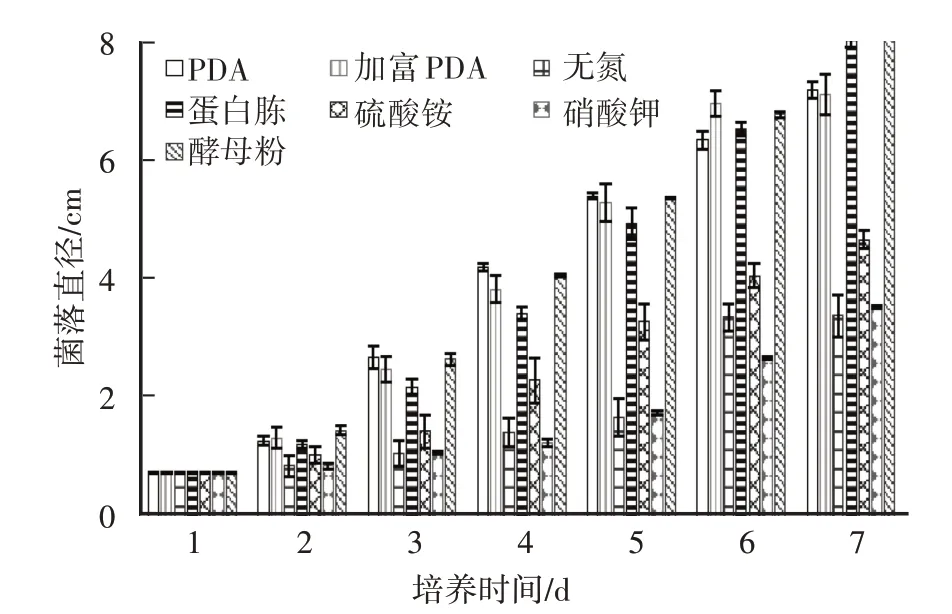
图1 不同氮源培养基上秀珍菇菌丝菌落直径
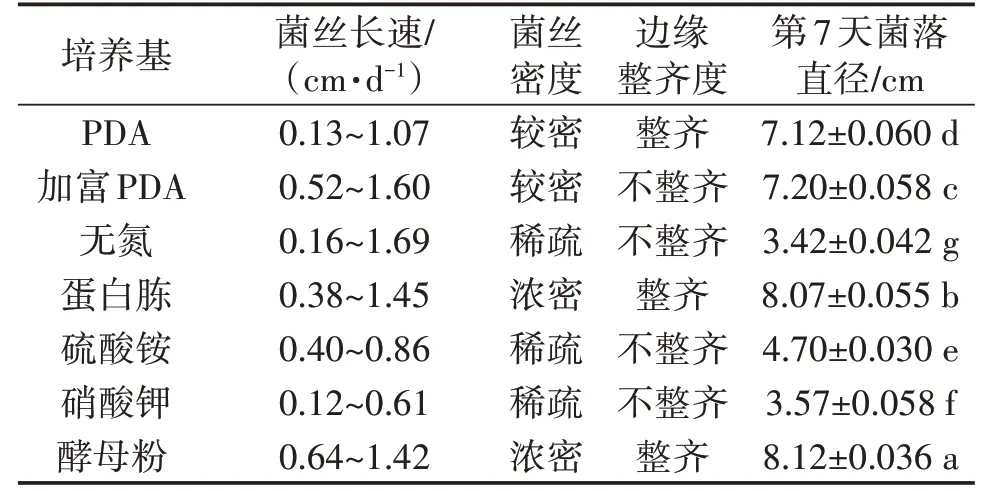
表1 不同氮源培养基上秀珍菇菌丝生长情况
2.2 培养基碳源筛选
从菌落直径看,乳糖为碳源时菌落增长最缓慢,其他四种碳源的菌落增长都相对较快(图2),然而菌丝的生长状况却有很大差异。由表2可知,淀粉和葡萄糖为碳源时,菌丝生长浓密,边缘整齐,菌丝活力强,而碳源为麦芽糖和蔗糖时,菌丝密度一般,活力不如淀粉和葡萄糖的菌丝,乳糖为碳源的菌丝最差,菌丝稀疏。从第7天的菌落直径看,淀粉或葡萄糖为碳源时菌落直径分别为7.92 cm和8.69 cm,差距不是很大,综合考虑最终确定碳源为葡萄糖。
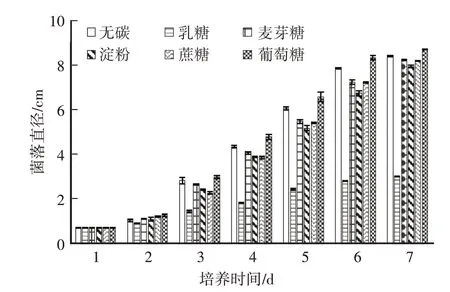
图2 不同碳源培养基上秀珍菇菌落直径

表2 不同碳源培养基上秀珍菇菌丝生长情况
2.3 培养基p H筛选
由图3可以看出,培养基呈碱性时,秀珍菇菌落直径增长较快,但菌丝稀疏(表3);呈弱酸性(pH6)或中性(pH7)时,菌丝生长洁白浓密,活力较强,pH自然值时,菌丝生长较密,优于碱性培养基。因此,培养基的pH以弱酸性或中性比较合适,具体pH数值还需要进一步筛选。
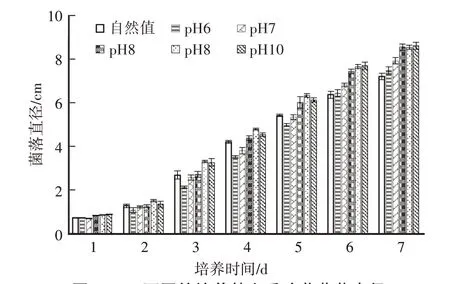
图3 p H不同的培养基上秀珍菇菌落直径

表3 p H不同的培养基上秀珍菇菌丝生长情况
2.4 培养基氮源最终筛选
根据固体培养基试验结果,确定培养基碳源为葡萄糖,为进一步确定最佳氮源,进行液体培养比较,以菌丝体生物量、菌丝胞外酶活性为考察指标。
由图4可知,相同液体培养(发酵)周期内,以蛋白胨为氮源的菌丝生物量为(5.42±0.14)g/L,而以酵母粉为氮源菌丝生物量为(7.70±0.10)g/L,且酵母粉为氮源时菌丝球更加均匀。
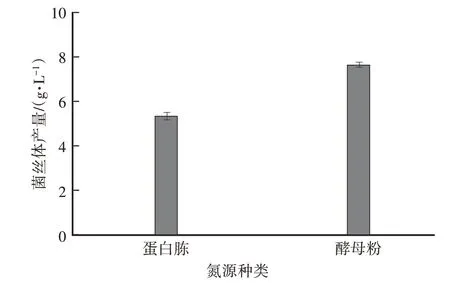
图4 两种氮源培养基中菌丝生物量
由图5可知,两种氮源的液体培养基培养秀珍菇菌丝的半纤维素酶、愈创木酚酶活性差异不大,而酵母粉为氮源的液体培养基培养秀珍菇菌丝的胞外羧甲基纤维素酶、多酚氧化酶、漆酶和淀粉酶酶活性稍高于氮源为蛋白胨。因此,氮源为酵母粉时培养秀珍菇效果最佳,菌丝生长浓密、长速较快,且胞外酶活性更强。
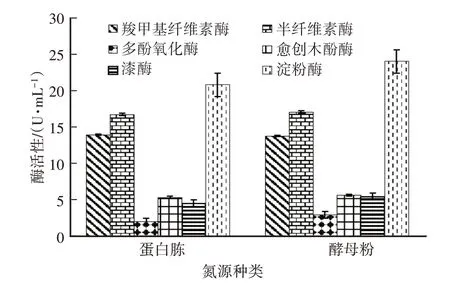
图5 两种氮源培养基中胞外酶活性
2.5 培养基p H最终筛选
培养基以葡萄糖为碳源,酵母粉为氮源,依据固体培养基试验结果,分别调节液体培养基pH为5、6、7。
由图6可知,当液体培养基pH为5、6、7时,秀珍菇菌丝生物量分别为(7.57±0.42)g/L、(9.34±0.22)g/L、(11.475±0.36)g/L,pH中性时菌丝生物量最高。由图7可知,pH为7时,菌丝胞外酶活性相对较高,其次是pH为6,pH为5时,除羧甲基纤维素酶外,其他酶活性相对较低。因此,最终确定培养基的pH为7,此时的秀珍菇菌丝生长较好,活力强,且菌丝胞外酶活性较高。
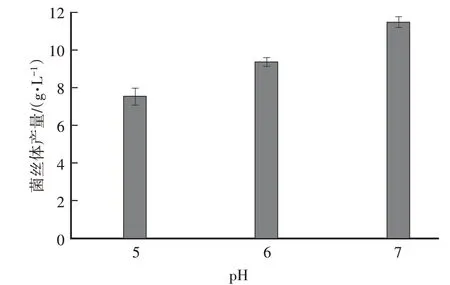
图6 不同p H的液体培养基中菌丝生物量
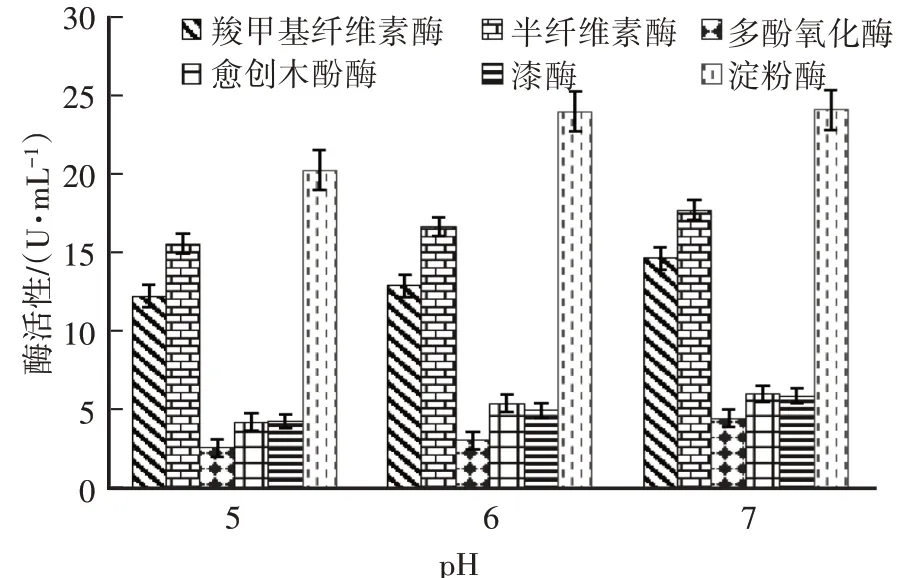
图7 不同pH的液体培养基中菌丝胞外酶活性
2.6 秀珍菇菌丝培养周期筛选
秀珍菇液体培养周期也会影响其菌丝体的活力,培养周期短,菌丝生物量低,最终影响固态发酵周期,而培养周期太长,菌丝老化,活力下降,也会影响后期固体发酵效率。
由图8可知,液体培养第4天开始,菌丝生物量随着培养时间的延长,逐渐增多。由图9可知,培养第6天,半纤维素酶、羧甲基纤维素酶、愈创木酚酶活性最高,多酚氧化酶活性在第8天最高,淀粉酶活性第5天最高,此后一直下降。因此,秀珍菇培养周期6 d为佳,此时与木质纤维素降解相关的大部分酶活性最高,说明此时的菌丝活力最强。
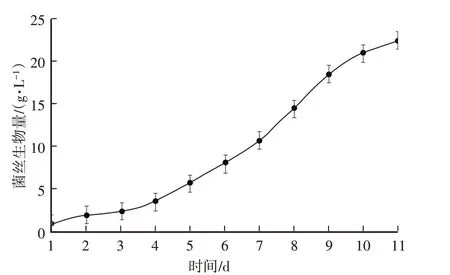
图8 不同培养周期菌丝生物量
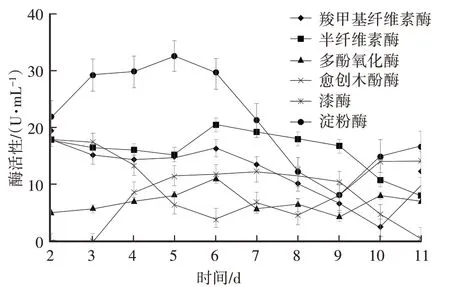
图9 不同培养周期菌丝胞外酶活性
3 小结
氮源、碳源、pH和培养周期都会影响秀珍菇菌丝体的活力,通过平板培养观测菌丝体生长状态,初步确定菌丝活化最佳碳源为葡萄糖,而氮源为蛋白胨和酵母粉时差异较小,且pH在弱酸性或中性条件下菌丝生长最佳。之后的液体培养进一步确定秀珍菇菌丝活化最佳氮源为酵母粉,碳源为葡萄糖,pH为7.0。通过菌丝体培养周期的生长曲线和菌丝胞外酶活性,最终确定发酵6 d时菌丝活力最佳,且菌丝胞外酶活性最强。
试验明晰了秀珍菇菌丝活化最佳的碳源、氮源、pH和培养周期,为后期秀珍菇高效固体发酵提供保障,同时可为其他食用菌菌种选育、活化及理化性质的研究提供参考。
