右美托咪定对心肌肥厚模型家兔心律失常及心肌组织CaMKⅡ表达的影响
2021-09-28刘旭东赵亮曹雪峰胡杰
刘旭东 赵亮 曹雪峰 胡杰


中图分类号 R541.7;R965 文献标志码 A 文章编号 1001-0408(2021)18-2209-09
DOI 10.6039/j.issn.1001-0408.2021.18.06
摘 要 目的:研究右美托咪定对心肌肥厚模型家兔心律失常及心肌组织中钙离子-钙调蛋白依赖性蛋白激酶Ⅱ(CaMKⅡ)表达的影响。方法:将家兔随机分为假手术组,模型组,右美托咪定低、中、高剂量组(10、25、50 μg/kg),CaMKⅡ抑制剂KN-93组(10 mg/kg)和右美托咪定高剂量+KN-93组(50 μg/kg+10 mg/kg),每组10只。除假手术组外,其余各组家兔均采用腹主动脉缩窄术复制心肌肥厚模型。术后,各给药组家兔静脉注射相应剂量的右美托咪定或/和腹腔注射KN-93,假手术组和模型组家兔静脉注射等体积生理盐水,隔天给药1次,连续给药8周。末次给药后,采用程序性刺激诱发室性心律失常,记录各组家兔早期后除极(EAD)和尖端扭转型室性心动过速(Tdp)的诱发率,检测左室射血分数(LVEF)和左心室缩短分数(FS),记录离体楔形心肌组织QT间期、跨室壁复极离散度(TDR)和内、外膜心肌细胞跨膜动作电位复极90%时程(APD90),测量并计算心脏质量/体质量比值(HW/BW)以及左心室壁厚度(LVT),检测心肌细胞横截面积以及心肌组织中心房钠尿肽(ANP)和脑钠肽(BNP) mRNA以及CaMKⅡ、磷酸化CaMKⅡ(p-CaMKⅡ)蛋白的相对表达量。结果:与假手术组比较,模型组家兔EAD、Tdp诱发率和HW/BW、LVT以及心肌组织中ANP、BNP mRNA的相对表达量和CaMKⅡ、p-CaMKⅡ蛋白的相对表达量均显著升高,LVEF、FS均显著降低,QT间期和内、外膜心肌APD90均显著延长,TDR显著增加,心肌细胞横截面积显著增大(P<0.05)。与模型组比较,各给药组家兔EAD、Tdp诱发率和HW/BW(右美托咪定低剂量组除外)、LVT(右美托咪定低剂量组除外)以及心肌组织中ANP mRNA(右美托咪定低剂量组除外)、BNP mRNA(右美托咪定低剂量组除外)的相对表达量和CaMKⅡ、p-CaMKⅡ蛋白的相对表达量均显著降低,LVEF(右美托咪定低剂量组除外)、FS(右美托咪定低剂量组除外)均显著升高,QT间期和内、外膜心肌APD90均显著缩短,TDR均显著减小,心肌細胞横截面积(右美托咪定低剂量组除外)均显著缩小(P<0.05),且右美托咪定高剂量组的改善效果优于右美托咪定低、中剂量组(P<0.05)。与右美托咪定高剂量组和KN-93组比较,右美托咪定高剂量+KN-93组家兔上述指标的改善更明显(P<0.05)。结论:右美托咪定可降低心肌肥厚模型家兔心律失常的诱发率,改善其心肌肥厚,其机制可能与下调CaMKⅡ表达有关。
关键词 右美托咪定;心肌肥厚;心律失常;钙离子-钙调蛋白依赖性蛋白激酶Ⅱ;家兔
Effects of Dexmedetomidine on Ventricular Arrhythmia in Myocardial Hypertrophy Model Rabbits and CaMKⅡ Expression in Cardiac Tissue
LIU Xudong1,ZHAO Liang2,CAO Xuefeng3,HU Jie1(1. Dept. of Anesthesiology, Chengde Central Hospital, Hebei Chengde 067024,China; 2. Dept. of Pharmacology,Chengde Medical College,Hebei Chengde 067050,China; 3. Dept. of Anesthesiology,the Affiliated Hospital of Chengde Medical College,Hebei Chengde 067020,China)
ABSTRACT OBJECTIVE: To study the effects of dexmedetomidine on ventricular arrhythmia in myocardial hypertrophy model rabbits and the expression of calcium ion/calmodulin-dependent protein kinase Ⅱ (CaMKⅡ) in myocardial tissue of rabbits. METHODS: The rabbits were randomly divided into sham operation group, model group, dexmedetomidine low-dose, medium-dose and high-dose groups (10, 25, 50 μg/kg), CaMKⅡ inhibitor KN-93 group (10 mg/kg), high-dose of dexmedetomidine+KN-93 group (50 μg/kg+10 mg/kg), with 10 rabbits in each group. Except for the sham operation group, other groups received abdominal aortic coarctation to induce myocardial hypertrophy model. After surgery, administration groups were given relevant dose of dexmedetomidine or/and intraperitoneal injection of KN-93; sham operation group and model group were given constant volume of normal saline intravenously, once every other day, for consecutive 8 weeks. After last medication, programmed stimulation was used to induce ventricular arrhythmia. The induction rate of early posterior depolarization (EAD) and tip torsion type ventricular tachycardia (Tdp) were recorded. Left ventricular ejection fraction (LVEF) and left ventricular shortener fraction (FS) were measured. QT interval, transventricular wall repolarization dispersion (TDR) and transmembrane 90% action potential duration(APD90) of endocardial and epicardial cardiomyocytes in wedge-shaped myocardium were recorded. The ratio of heart weight to body weight (HW/BW) and the thickness of left ventricular wall (LVT) were measured and calculated. The cross-sectional area of cardiomyocytes, mRNA expression of ANP and BNP as well as protein expression of CaMKⅡ and p-CaMKⅡ in myocardial tissue was measured. RESULTS: Compared with sham operation group, the induction rate of EAD and Tdp, HW/BM, LVT, mRNA expression of ANP and BNP and protein relative expression of CaMKⅡ and p-CaMKⅡ in cardiac tissue were all increased significantly, while LVEF and FS were decreased significantly; QT interval, APD90 of endocardial and epicardial cardiomyocytes were all prolonged significantly; TDR was increased significantly, while cross-sectional area of cardiomyocytes was increased significantly in model group (P<0.05). Compared with model group, induction rate of EAD and Tdp, HW/BW (except for dexmedetomidine low-dose group), LVT (except for dexmedetomidine low-dose group), mRNA relative expression of ANP (except for dexmedetomidine low-dose group) and BNP (except for dexmedetomidine low-dose group) as well as protein relative expression of CaMKⅡ and p-CaMKⅡ were all decreased significantly in administration groups; the levels of LVEF (except for dexmedetomidine low-dose group) and FS (except for dexmedetomidine low-dose group) were all increased significantly; QT interval, APD90 of endocardial and epicardial cardiomyocytes were shortened significantly; TDR and cross-sectional area of cardiomyocytes (except for dexmedetomidine low-dose group) were decreased significantly (P<0.05); the improvement effects of dexmedetomidine high-dose group were significantly better than those of dexmedetomidine low-dose and medium-dose groups (P<0.05). Compared with dexmedetomidine high-dose group and KN-93 group, the improvement of above indexes were all more significant in high-dose of dexmedetomidine+KN-93 group (P<0.05). CONCLUSIONS: Dexmedetomidine can reduce the induction rate of ventricular arrhythmia and improve myocardial hypertrophy in myocardial hypertrophy model rabbits, the mechanism of which may be associated with down-regulation of CaMKⅡ expression.
KEYWORDS Dexmedetomidine; Myocardial hypertrophy; Ventricular arrhythmia; CaMKⅡ; Rabbit
心肌肥厚是心肌梗死、心律失常等一系列心血管疾病的病理基础,主要表现为心肌间质增生和心室肌肥厚[1]。其中,心室肌肥厚随病情的进展容易诱发恶性心律失常,甚至诱发急性心肌梗死、猝死,严重影响患者的生命健康[2]。研究表明,肥厚心肌的心律失常与钙调蛋白的激活密切相关[3]。钙离子-钙调蛋白依赖性蛋白激酶Ⅱ(CaMKⅡ)的活性在肥厚心肌组织中显著增强,并可通过作用于L型钙离子通道(LTCC),致使心肌细胞钙离子(Ca2+)超载,进而提高肥胖和高血脂患者恶性心律失常的发生率[4]。有研究报道,右美托咪定可以通过减弱LTCC电流来影响心肌肥厚和充血性心力衰竭患者的心肌收缩力和心脏电活动,这一作用可能与其缓解心肌细胞的Ca2+超负荷相关[5]。多项临床研究证明,右美托咪定可降低心脏病患者术后异位心动过速和快速心律失常的发生率[6-8]。基于此,本研究以心肌肥厚模型家兔為对象,以程序性刺激诱发室性心律失常,记录其早期后除极(EAD)和尖端扭转型室性心动过速(Tdp)的诱发率,检测左室射血分数(LVEF)和左心室缩短分数(FS),同步记录家兔离体楔形心肌组织QT间期、跨室壁复极离散度(TDR)和内、外膜心肌细胞跨膜动作电位复极90%时程(APD90),评价右美托咪定的抗心律失常作用;同时,检测右美托咪定对家兔心肌细胞横截面积以及心肌组织中心房钠尿肽(ANP)、脑钠肽(BNP) mRNA和CaMKⅡ、磷酸化CaMKⅡ(p-CaMKⅡ)蛋白表达的影响,为右美托咪定用于改善心肌肥厚致心律失常提供科学依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有:PowerPac型基础电泳仪、Mini-protean型垂直板电泳槽、Trans-blot型电转膜系统、T100型聚合酶链式反应(PCR)仪(美国Bio-Rad公司),YC-2型程控刺激器、RM6240B型多道生理信号采集处理系统(成都仪器厂),Vevo 2100型小动物心脏超声仪(加拿大Visual Sonics公司),Omega Glum型凝胶成像系统(美国Aplegen公司),Simplicity型超纯水机(美国Millipore公司),LSM 800型激光共聚焦显微镜(美国Zeiss公司)等。
1.2 主要药品与试剂
右美托咪定原料药(批号113775-47-6,纯度99%)购自江苏恒瑞医药股份有限公司;氯胺酮(批号K-003)、戊巴比妥钠(批号57-33-0)、麦胚凝集素(WGA)原液(批号W11261)、4′,6-二脒基-2-苯基吲哚(DAPI)溶液(批号62248)、Trizol试剂盒(批号15596026)均购自美国Invi- trogen公司;CaMKⅡ抑制剂KN-93原料药(批号GC10629,纯度>98.00%)购自美国GlpBio公司;逆转录试剂盒(批号K1691)购自美国Thermo Fisher Scienti- fic公司;兔CaMKⅡ单克隆抗体(批号ab181052)、兔p-CaMKⅡ单克隆抗体(批号ab124880)、兔甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体(批号ab8245)和辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(IgG)二抗(批号ab205718)均购自美国Abcam公司;高钾停跳液(批号PB155313)、台式液(批号PB180338)均购自武汉普诺赛生命科技有限公司;SYBR Premix Ex Taq试剂盒(批号RR820A)购自宝日医生物技术(北京)有限公司;RIPA裂解液(批号P0013B)、loading buffer(批号P0015F)、TBST洗涤液(批号ST673)均购自上海碧云天生物技术有限公司;化学发光试剂盒(批号sk16429)购自美国Bio-Rad公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 实验动物
本研究所用实验动物为成年雄性健康家兔,共70只,4~5月龄,体质量为1.8~2.2 kg,购自北京维通利华实验动物技术有限公司,实验动物使用许可证号为SYXK(京)2017-0033。所有家兔均自由摄食、饮水,饲养于室温18~22 ℃、相对湿度40%~60%、每12 h光暗交替的环境中。本实验方案经承德医学院动物保护与使用委员会批准,并按照《国家卫生研究院实验动物中心小动物区动物使用》要求执行。
2 方法
2.1 分组、造模与给药
将家兔随机分为假手术组,模型组,右美托咪定低、中、高剂量组,KN-93组和右美托咪定高剂量+KN-93组,每组10只。除假手术组家兔开腹但不行手术外,其余各组家兔均采用腹主动脉缩窄术复制心肌肥厚模型[以心脏质量/体质量比值(HW/BW)和左心室壁厚度(LVT)均升高视为造模成功][9]。术后,右美托咪定低、中、高剂量组家兔分别按10、25、50 μg/kg静脉注射右美托咪定药液(给药剂量参考文献[10]和预实验结果设置,以生理盐水为溶剂),KN-93组家兔按10 mg/kg腹腔注射KN-93药液(给药剂量参考文献[11]和预实验结果设置,以生理盐水为溶剂),右美托咪定高剂量+KN-93组家兔同时静脉注射右美托咪定药液(50 μg/kg,以生理盐水为溶剂)+腹腔注射KN-93药液(10 mg/kg,以生理盐水为溶剂),假手术组和模型组家兔静脉注射与右美托咪定等体积的生理盐水,隔天给药1次,连续给药8周。
2.2 家兔EAD和Tdp诱发率检测
末次给药后,用程控刺激器以2 000 ms的慢频率程序电刺激诱发家兔心律失常,记录各组家兔EAD和Tdp的诱发率。
2.3 家兔心脏超声检测
各组家兔在异氟烷吸入麻醉的情况下,经胸部脱毛后仰面固定于心脏超声平台,运用小动物心脏超声仪在左室乳头肌的长轴和短轴截面采集M-mode图像,当心率在400~450次/min时测量并计算LVEF、FS。
2.4 家兔离体楔形心肌组织标本制备
每组随机选取5只家兔,按照文献[10]报道的方法制备离体楔形心肌组织标本:家兔经肝素化后,静脉注射氯胺酮(30 mg/kg)进行麻醉,随后开胸快速取出其心脏,将心脏置于4 ℃台式液中固定30 min,取出后用灌注头经冠状动脉左侧回旋支插管,灌注高钾停跳液,剪去未灌注的心肌组织,余下部分即为离体楔形心肌组织标本。将该标本置于4 ℃台式液中,继续经冠状动脉灌注台式液,用于后续实验。
2.5 家兔QT间期和跨膜动作电位参数检测
将起搏电极固定于各组家兔离体楔形心肌组织标本的心内膜侧中部,采用脉宽1 ms、2倍阈电压、基础起搏周长1 000 ms对心肌组织进行连续起搏刺激,利用多道生理信号采集处理系统记录QT间期、TDR和内、外膜心肌APD90。
2.6 家兔HW/BW、LVT检测
称定各组剩余5只家兔的体质量(BW)后,静脉注射戊巴比妥钠(100 mg/kg)将其处死,取其心脏并称定心脏质量(HW),计算HW/BW;测量LVT并记录。
2.7 家兔心肌细胞横截面积检测
采用WGA染色法进行检测。将“2.6”项下各组家兔心肌组织制成冷冻切片,用4%多聚甲醛溶液固定30 min,室温孵育20 min,用磷酸盐缓冲液(PBS,pH为7.3±0.1,下同)清洗后,在室温避光条件下用WGA稀释液(WGA原液与PBS体积比为1 ∶ 200)染色30 min;用PBS清洗后,以DAPI稀释液(DAPI与PBS体积比为1 ∶ 2 000)染细胞核,室温孵育20 min;用PBS清洗后,以50%甘油封片,低温避光保存。在激光共聚焦显微镜下观察并拍照(染色的部位是心肌细胞膜,呈绿色)。采用Image J v1.8.0软件分析心肌细胞横截面积。
2.8 家兔心肌组织中ANP、BNP mRNA表达水平检测
采用荧光定量PCR法进行检测。取“2.6”项下各组家兔米粒大小的心肌组织,破碎后,加入Trizol试剂裂解组织,提取总RNA,测定纯度和浓度后,取总RNA 40 ng,按逆转录试剂盒说明书操作以逆转录合成cDNA,按照1 ∶ 35的体积比将cDNA与SYBR Premix Ex Taq混合,进行PCR反应。反应条件如下:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸40 s,共40个循环。反应体系(10 μL)如下:上、下游引物(用无核酸酶水稀释至 1 μmol/L)5 μL,cDNA-SYBR混合液(體积比1 ∶ 35)5 μL。ANP上游引物序列为5′-TGACGGACAAAAGCTGAGA-3′,下游引物序列为5′-CAGGGTGATGGAGAAGGAG-3′,产物片段长度为179 bp;BNP上游引物序列为5′-AAGGGAGAACACGGCAT-3′,下游引物序列为5′-CAGAGGATGGGAGTGACC-3′,产物片段长度为114 bp;18S rRNA上游引物序列为5′-AGGGGAGAGCGGGTAAGAGA-3′,下游引物序列为5′-GGACAGGACTAGGCGGAACA-3′,产物片段长度为140 bp。以 18S rRNA为内参,利用2-ΔΔCt法分析各组家兔心肌组织中ANP、BNP mRNA的相对表达量。
2.9 家兔心肌组织中CaMKⅡ、p-CaMKⅡ蛋白表达水平检测
采用Western blot法进行检测。取“2.6”项下各组家兔左心室游离壁的心肌组织适量,用液氮混匀并研磨后,使用RIPA裂解液在冰上充分裂解提取蛋白,将蛋白与loading buffer混合并煮沸变性。取变性后的蛋白适量,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后,湿法转移至聚偏二氟乙烯膜上,用5%脱脂牛奶于室温下封闭1 h;加入CaMKⅡ、p-CaMKⅡ、GAPDH一抗(稀释度均为1 ∶ 1 000),4 ℃下孵育过夜;经TBST洗涤液洗膜后,加入相应二抗(稀释度为1 ∶ 10 000),室温孵育1 h;经TBST洗涤液洗膜后,采用化学发光法显影,并使用凝胶成像系统成像。采用Image J v1.8.0软件对蛋白条带的灰度值进行分析,以目标蛋白与内参蛋白(GAPDH)条带的灰度值比值作为目标蛋白的相对表达量。
2.10 统计学方法
采用SPSS 22.0软件对数据进行统计分析。采用Shapiro-Wilk检验分析计量资料是否符合正态分布,采用单因素方差分析检验其方差齐性。若数据服从正态分布且方差齐,以x±s表示,采用SNK-q检验进行组间比较;若不符合正态分布,则以中位数表示,采用非参数检验进行组间比较。计数资料以率表示,采用χ 2检验进行组间比较。检验水准α=0.05。
3 结果
3.1 右美托咪定对心肌肥厚模型家兔EAD和Tdq诱发率的影响
与假手术组比较,模型组家兔EAD和Tdp诱发率均显著升高(P<0.05),且达到100%。与模型组比较,右美托咪定低、中、高剂量组和KN-93组、右美托咪定高剂量+KN-93组家兔EAD和Tdp诱发率均显著降低(P<0.05),且右美托咪定高剂量组显著低于右美托咪定低、中剂量组(P<0.05)。与右美托咪定高剂量组和KN-93组比较,右美托咪定高剂量+KN-93组家兔EAD和Tdp诱发率均显著降低(P<0.05),详见表1。
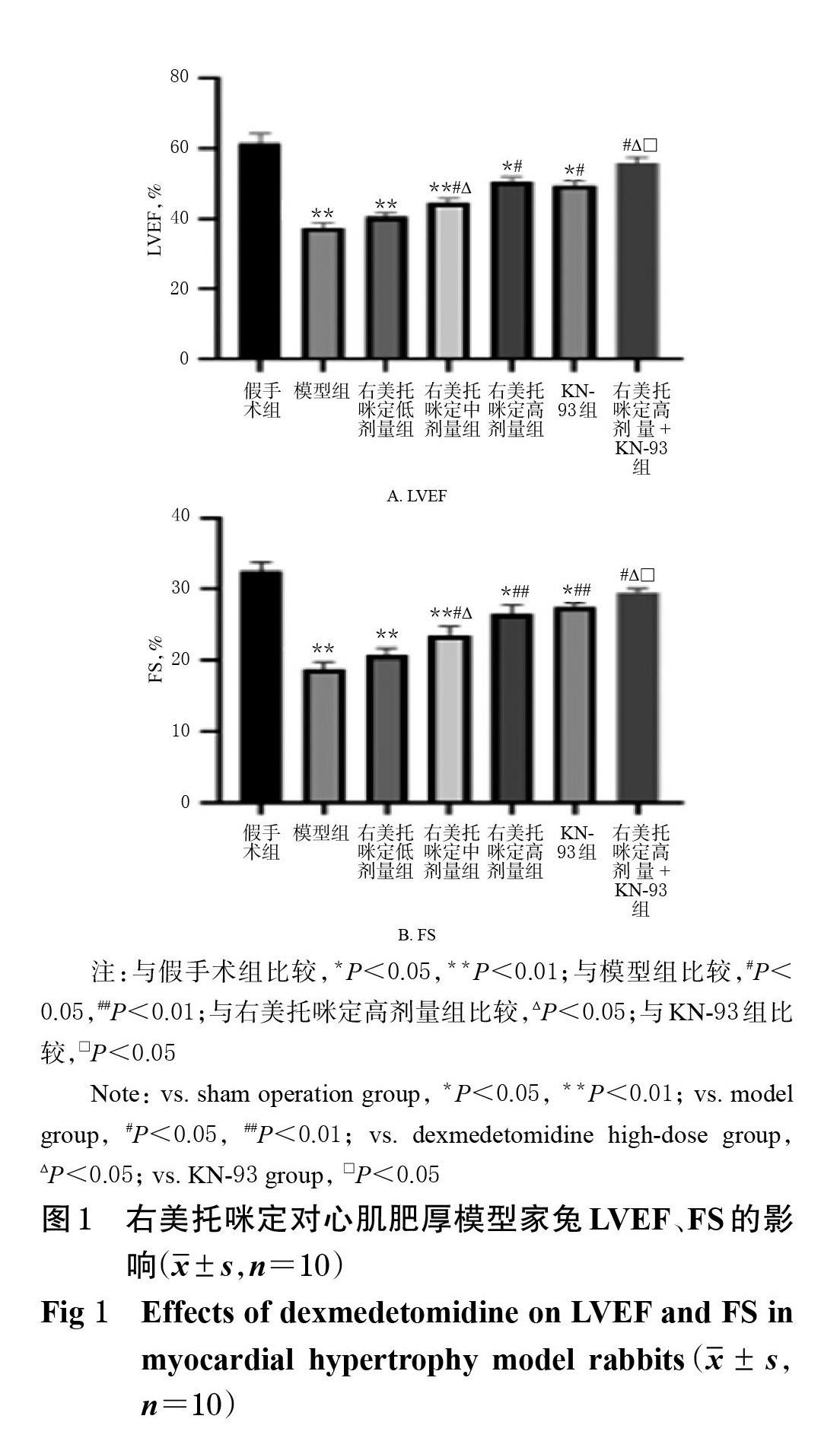
3.2 右美托咪定对心肌肥厚模型家兔LVEF、FS的影响
与假手术组比较,模型组家兔LVEF、FS均显著降低(P<0.01)。与模型组比较,右美托咪定中、高剂量组和KN-93组、右美托咪定高剂量+KN-93组家兔LVEF、FS均显著升高(P<0.05或P<0.01),且右美托咪定高剂量组显著高于右美托咪定中剂量组(P<0.05)。与右美托咪定高剂量组和KN-93组比较,右美托咪定高剂量+KN-93组家兔LVEF、FS均显著升高(P<0.05),详见图1。
3.3 右美托咪定对心肌肥厚模型家兔QT间期、TDR和内、外膜心肌APD90的影响
与假手术组比较,模型组家兔QT间期和内、外膜心肌APD90均显著延长,TDR显著增加(P<0.05)。与模型组比较,右美托咪定低、中、高剂量组和KN-93组、右美托咪定高剂量+KN-93组家兔QT间期和内、外膜心肌APD90均显著缩短,TDR均显著减小(P<0.05),且右美托咪定高剂量组QT间期、TDR均显著短于或小于右美托咪定低、中剂量组,内、外膜心肌APD90均显著短于右美托咪定低剂量组(P<0.05)。与右美托咪定高剂量组比较,右美托咪定高剂量+KN-93组家兔QT间期和内、外膜心肌APD90均显著缩短,TDR显著减小(P<0.05)。与KN-93组比较,右美托咪定高剂量+KN-93组家兔QT间期和内膜心肌APD90均显著缩短(P<0.05),详见表2。
3.4 右美托咪定对心肌肥厚模型家兔HW/BW、LVT的影响
与假手术组比较,模型组家兔HW/BW、LVT均显著升高(P<0.05)。与模型组比较,右美托咪定中、高剂量组和KN-93组、右美托咪定高剂量+KN-93组家兔HW/BW、LVT均显著降低(P<0.05),且右美托咪定高剂量组上述指标均显著低于右美托咪定中剂量组(P<0.05)。与右美托咪定高剂量组和KN-93组比较,右美托咪定高剂量+KN-93组家兔HW/BW、LVT均显著降低(P<0.05),详见表3。
3.5 右美托咪定对心肌肥厚模型家兔心肌细胞横截面积的影响
与假手术组比较,模型组家兔心肌细胞横截面积显著增大(P<0.01)。与模型组比较,右美托咪定中、高剂量组和KN-93组、右美托咪定高剂量+KN-93组家兔心肌细胞横截面积均显著缩小(P<0.05),且右美托咪定高剂量组显著小于右美托咪定中剂量组(P<0.05)。与右美托咪定高剂量组和KN-93组比较,右美托咪定高剂量+KN-93组家兔心肌细胞横截面积显著缩小(P<0.05),详见图2、图3。
3.6 右美托咪定对心肌肥厚模型家兔心肌组织中ANP、BNP mRNA相对表达量的影响
与假手术组比较,模型组家兔心肌组织中ANP、BNP mRNA的相对表达量均显著升高(P<0.01)。与模型组比较,右美托咪定中、高剂量组和KN-93组、右美托咪定高剂量+KN-93组家兔心肌组织中ANP、BNP mRNA的相对表达量均显著降低(P<0.05或P<0.01),且右美托咪定高剂量组BNP mRNA的相对表达量显著低于右美托咪定中剂量组(P<0.05)。与右美托咪定高剂量组和KN-93组比较,右美托咪定高剂量+KN-93组家兔心肌组织中ANP、BNP mRNA的相对表达量均显著降低(P<0.05),详见图4。
3.7 右美托咪定对心肌肥厚模型家兔心肌组织中CaMKⅡ、p-CaMKⅡ蛋白相对表达量的影响
与假手术组比较,模型组家兔心肌组织中CaMKⅡ、p-CaMKⅡ蛋白的相对表达量均显著升高(P<0.05)。与模型组比较,右美托咪定低、中、高剂量组和KN-93组、右美托咪定高剂量+KN-93组家兔心肌组织中CaMKⅡ、p-CaMKⅡ蛋白的相对表达量均显著降低(P<0.05),且右美托咪定高剂量组显著低于右美托咪定低、中剂量组(P<0.05)。与右美托咪定高剂量组和KN-93组比较,右美托咪定高剂量+KN-93组家兔心肌组织中CaMKⅡ、p-CaMKⅡ蛋白的相对表达量均显著降低(P<0.05),详见图5、表4。
4 讨论
心肌肥厚是血压升高和后负荷增加最初的生理代偿反应,也是许多心血管疾病的共同病理生理过程。有研究指出,腹主动脉血管阻力上升可直接导致左心室后负荷上升,从而刺激心肌细胞导致心肌肥大[12]。因此,本研究采用腹主动脉缩窄术复制家兔心肌肥厚模型。ANP和BNP是由心脏分泌的激素,均有很强的排钠、利尿、扩张血管等作用。本研究结果显示,腹主动脉缩窄术能诱导家兔心肌肥厚,并能显著提高心肌组织中ANP、BNP mRNA的相对表达量,同时增加了HW/BW、LVT、LVEF、FS,增大了心肌细胞横截面积,提示造模成功。
有研究表明,促进心肌肥厚易感恶性心律失常的一种生理机制是心肌细胞复极时程延长,TDR增加,从而诱发EAD和Tdq[13-15]。其中,EAD是指早期后除极,发生在动作电位2相平台期或3相早期的振荡性电位变化[16]。Tdp指发生在QT间期延长的基础上连续5个或者以上的QRS波围绕等电位且改变极性的频率大于200次/min的多形性室性心动过速[17]。EAD和Tdp是心肌肥厚患者经常出现的心律失常类型,且EAD是Tdp的始发因素,其可折返使得Tdp维持,TDR增加提高了折返性心律失常的发生率[18]。有研究发现,心肌肥厚在心脏形态以及心功能改变的同时,还伴随着心肌细胞的离子通道、膜电位的变化,主要表现为Ca2+稳态失调,QT间期和内、外膜心肌细胞APD90均延长,TDR增加[19]。本研究结果进一步证实了这个结论,即与假手术组比较,模型组家兔不仅表现出QT间期和内、外膜心肌细胞APD90均延长,TDR增加,而且其EAD和Tdp的誘发率还达到了100%。
Ca2+稳态失调与心肌肥厚易感心律失常密切相关[20]。Ca2+是心肌细胞最重要的第二信使,在调节心肌收缩力相关基因表达和心肌肥厚、心律失常中具有重要作用[21]。研究证明,Ca2+通过流入LTCC和瞬时受体电位通道来激活病理性心肌肥大信号[22]。Ca2+通道阻滞剂维拉帕米可以通过下调LTCC上的α1C亚基,抑制心肌蛋白诱导的心肌肥大[23]。另有研究表明,EAD和Tdp的发生也与LTCC相关:一方面,心肌肥厚时心肌细胞腺苷三磷酸的合成减少,肌浆网对Ca2+的摄取减少,从而引发Ca2+稳态失调;另一方面,LTCC开放可导致Ca2+内流增加,从而导致内层心肌细胞复极时程的明显延长和TDR的增加[14]。Ca2+与钙调蛋白(CaM)结合后,可激活下游的CaMKⅡ[24]。本研究结果显示,与假手术组比较,模型组家兔EAD、Tdp的诱发率和心肌组织中CaMKⅡ、p-CaMKⅡ蛋白的相对表达量均显著升高;与模型组比较,CaMKⅡ蛋白抑制剂KN-93能显著降低模型家兔EAD、Tdp的诱发率。由此可见,CaMKⅡ是肥厚心肌中Ca2+稳态失调与易感心律失常的主要信号分子。
右美托咪定作为临床常用的麻醉辅助药,是一种高效的α2肾上腺素能受体激动剂,能够有效地抑制交感神经兴奋,具有镇痛、催眠的效果,还可有效抑制患者插管时的应激反应,是临床麻醉和加强监护病房(ICU)镇静的常用药[25]。近年来研究表明,右美托咪定具有一定的抗炎作用,可以通过抑制Toll样受体信号通路而缓解心肌缺血损伤,该药的心肌保护作用可能与其调控Ca2+通道相关[26]。另有研究证实,右美托咪定可以通过上调Cx43的表达、抑制炎症反应和心肌纤维化而对心肌缺血模型大鼠发挥抗心律失常的作用[27]。临床资料也证明,手术中使用右美托咪定可以减少患者发生心律失常的风险[28]。基于此,本研究将右美托咪定应用于心肌肥厚模型家兔,探索其对心肌肥厚易感心律失常以及对CaMKⅡ蛋白表达的影响。结果显示,与模型组比较,右美托咪定可显著下调模型家兔心肌组织中CaMKⅡ、p-CaMKⅡ蛋白的表达,并可显著降低家兔的LVEF、FS、HW/BW、LVT,缩短QT间期和内、外膜APD90,减小TDR,降低EAD和Tdp的誘发率,且有剂量依赖性;右美托咪定高剂量+KN-93组上述指标改善效果均普遍优于右美托咪定高剂量组和KN-93组。这些数据证明右美托咪定逆转心肌肥厚并且减少心律失常的发生与抑制CaMKⅡ的表达相关。
研究表明,CaMKⅡ可以通过自身磷酸化来发挥对Ca2+电流的易化作用,引起“钙依赖性加强”现象,从而触发室性心律失常[29]。Lai等[30]通过模拟拉伸激活通道电流诱导心肌细胞异常冲动,在心肌细胞中观察到稳定的EAD,其中肌浆网Ca2+下降,钙电流和APD持续上升。CaMKⅡ抑制肽可以通过平衡CaMKⅡ转录和开放LTCC通道来消除EAD[31]。因此本课题组推测,右美托咪定可能是通过抑制CaMKⅡ磷酸化、减少LTCC开放、抑制Ca2+内流和内向电流增加,从而抑制EAD增加、降低心肌肥厚发生心律失常的诱发率,但还需要更多的研究去证实。
综上所述,右美托咪定可降低心肌肥厚模型家兔心律失常的诱发率,改善其心肌肥厚,其机制可能与下调CaMKⅡ的表达有关。
参考文献
[ 1 ] BURCHFIELD J S,XIE M,HILL J A. Pathological ventricular remodeling:mechanisms:part 1 of 2[J]. Circulation,2013,128(4):388-400.
[ 2 ] GROSSMAN W,JONES D,MCLAURIN L P. Wall stress and patterns of hypertrophy in the human left ventricle[J]. J Clin Invest,1975,56(1):56-64.
[ 3 ] ROSEN M R. Blunderbuss to mickey mouse:the evolution of antiarrhythmic targets[J]. Circulation,2002,106(10):1180-1182.
[ 4 ] SUFU-SHIMIZU Y,OKUDA S,KATO T,et al. Stabili- zing cardiac ryanodine receptor prevents the development of cardiac dysfunction and lethal arrhythmia in Ca2+/calmodulin-dependent protein kinase Ⅱδc transgenic mice[J]. Biochem Biophys Res Commun,2020,524(2):431-438.
[ 5 ] BERRIDGE M J,BOOTMAN M D,RODERICK H L. Calcium signalling:dynamics,homeostasis and remodelling[J]. Nat Rev Mol Cell Biol,2003,4(7):517-529.
[ 6 ] ZHAO J,ZHOU C L,XIA Z Y,et al. Effects of dexmedetomidine on L-type calcium current in rat ventricular myocytes[J]. Acta Cardiol Sin,2013,29(2):175-180.
[ 7 ] EL-SHMAA N S,EL AMROUSY D,EL FEKY W. The efficacy of preemptive dexmedetomidine versus amiodarone in preventing postoperative junctional ectopic tachycardia in pediatric cardiac surgery[J]. Ann Card Anaesth,2016,19(4):614-620.
[ 8 ] TURAN A,BASHOUR C A,YOU J,et al. Dexmedetomidine sedation after cardiac surgery decreases atrial arrhythmias[J]. J Clin Anesth,2014,26(8):634-642.
[ 9 ] GILLIS A M,GEONZON R A,MATHISON H J,et al. The effects of barium,dofetilide and 4-aminopyridine(4-AP)on ventricular repolarization in normal and hypertrophied rabbit heart[J]. J Pharmacol Exp Ther,1998,285(1):262-270.
[10] WU S J,LIN Z H,LIN Y Z,et al. Dexmedetomidine exer- ted anti-arrhythmic effects in rat with ischemic cardio- myopathy via upregulation of connexin 43 and reduction of fibrosis and inflammation[J]. Front Physiol,2020,11:1-17.
[11] 馮英.抑制心肌肥厚小鼠CaMKⅡ活性对ISO诱导的心律失常的影响[D].武汉:武汉大学,2015.
[12] LIU Y,SHAO Q,CHENG H J,et al. Chronic Ca2+/calmodulin-dependent protein kinase Ⅱ inhibition rescues advanced heart failure[J]. J Pharmacol Exp Ther,2021,377(3):316-325.
[13] SATRIANO A,AFZAL Y,AFZAL M S,et al. Neural-network-based diagnosis using 3-dimensional myocardial architecture and deformation:demonstration for the differentiation of hypertrophic cardiomyopathy[J]. Front Cardiovasc Med,2020,7:584727.
[14] XUAN L,ZHU Y,LIU Y,et al. Up-regulation of miR-195 contributes to cardiac hypertrophy-induced arrhythmia by targeting calcium and potassium channels[J]. J Cell Mol Med,2020,24(14):7991-8005.
[15] LI W,GAO H,GAO J,et al. Upregulation of MMP-9 and CaMKⅡ prompts cardiac electrophysiological changes that predispose denervated transplanted hearts to arrhythmogenesis after prolonged cold ischemic storage[J]. Biomed Pharmacother,2019,112(3):108641.
[16] DIEKMAN C O,WEI N. Circadian rhythms of early afterdepolarizations and ventricular arrhythmias in a cardiomyocyte model[J]. Biophys J,2020,16(5):71-80.
[17] DAVID J T,MICHAELJ A. Genetics of long QT syndrome[J]. Methodist Debakey Cardiovasc J,2014,10(1):29-33.
[18] 胡硕强.肥厚心肌电生理学特性及其离子机制的研究进展[J].中国心脏起搏与心电生理杂志,2003,17(4):75- 78.
[19] 倪明科.缝隙连接的改变在药物诱导的室性心律失常发生中的作用[D].武汉:华中科技大学,2010.
[20] ZHANG C,LI Y,LU Z,et al. Relationship between the U wave on electrocardiogram and the midmyocardium of the left ventricular wall[J]. Chin Med J,2002,115(4):509-512.
[21] 张水馨.基于Ca2+-CaM-CaMKⅡ信号传导通路的麻黄附子细辛汤对CaM/CaMKⅡ的影响[D].北京:北京中医药大学,2014.
[22] 葛广全,赵峰,陈道虎,等.钙离子/钙调素依赖性蛋白激酶Ⅱ调控压力负荷心力衰竭小鼠心肌细胞肥大和凋亡的作用及机制[J].第二军医大学学报,2020,41(12):1314-1321.
[23] GAO H I,WANG F,WANG W,et al. Ca2+ influx through L-type Ca2+ channels and transient receptor potential channels activates pathological hypertrophy signaling[J]. J Mol Cell Cardiol,2012,53(5):657-667.
[24] ANDERSON M E. Calmodulin kinase and L-type calcium channels;a recipe for arrhythmias?[J]. Trends Cardiovasc Med,2004,14(4):152-161.
[25] 聂卫平,黄彬.右美托咪定对全身麻醉手术患者应激反应及苏醒时间的影响[J].临床合理用药杂志,2020,13(34):82-83.
[26] WU Y,COLBRAN R J,ANDERSON M E. Calmodulin kinase is a molecular switch for cardiac excitation-contraction coupling[J]. Proc Natl Acad Sci U S A,2001,98(5):2877-2881.
[27] SUN Z,ZHAO TN,LV S,et al. Dexmedetomidine atte- nuates spinal cord ischemia-reperfusion injury through both anti-inflammation and anti-apoptosis mechanisms in rabbits[J]. J Transl Med,2018,16(1):209.
[28] LIU J,ZHANG S,FAN X,et al. Dexmedetomidine preconditioning ameliorates inflammation and blood-spinal cord barrier damage after spinal cord ischemia-reperfusion injury by down-regulation high mobility group box 1-Toll-like receptor 4-nuclear factor κB signaling pathway[J]. Spine,2019,44(2):E74-E81.
[29] 钟鹏. CaMKⅡ在肥胖诱导的心肌重构以及心律失常中的作用及机制研究[D].武汉:武汉大学,2018.
[30] LAI D,XU L,CHENG J,et al. Stretch current-induced abnormal impulses in CaMKⅡδ knockout mouse ventricular myocytes[J]. J Cardiovasc Electrophysiol,2013,24(4):457-463.
[31] WU Y J,TEMPLE J,ZHANG R,et al. Calmodulin kinase Ⅱ and arrhythmias in a mouse model of cardiac hypertrophy[J]. Circulation,2002,106(10):1288-1293.
(收稿日期:2021-06-09 修回日期:2021-08-23)
(编辑:邹丽娟)
