大规模哺乳动物细胞培养工程的现状与展望
2021-09-28朱紫瑜王冠庄英萍
朱紫瑜,王冠,庄英萍
(华东理工大学生物工程学院,国家生化工程技术研究中心,生物反应器工程国家重点实验室,上海 200237)
几十年来,哺乳动物细胞一直被用作生产治疗性蛋白的载体。治疗性蛋白广泛应用于疾病的诊断和治疗等方面,形成了巨大的市场[1]。2018年全球生物制药市场价值2372 亿美元,预计到2024 年将达到3890 亿美元,在2019—2024 年的预测期内,复合年增长率将达到8.59%[2]。2006—2010 年间,大约55%的生物药品是哺乳动物细胞表达,2010—2014 年间,60%的重组治疗蛋白也是基于哺乳动物细胞表达[2]。其中,单抗类药物数量最多,2019 年全球单克隆抗体市场规模达到1640 亿美元左右,在全球生物制品中份额占比达到50%以上,是全球生物制品行业中最大的子行业[3]。因此,通过哺乳动物细胞生产蛋白质产品的需求量日益提高,使得动物细胞大规模培养技术的研究与开发成为生物制药领域的重要任务。
自1907 年Harrison 等以淋巴液作为培养基在体外培养蛙胚神经组织建立体外培养技术以来,细胞培养技术已经经历了近一个世纪的发展,并逐步走向规模化、自动化和多样化[4]。体外培养过程中营养物质是一个关键因素,1951 年Eagle 等开发了促进细胞体外培养的合成培养基(MEM),成为培养基配方开发划时代的里程碑事件,为之后无血清培养基的开发奠定了基础[5]。血清中含有上千种不同成分,为细胞体外培养提供广泛而丰富的营养和各种细胞因子,但动物血清的使用存在引入外源病毒的风险,不同批次差异很大,并且成本昂贵。因此减少血清浓度或完全去除血清对细胞培养有着重大意义。到了20 世纪80 年代,Sato 等[6]在替代血清方面取得了突破性进展,通过在基础培养基中添加蛋白(如胰岛素、转铁蛋白和白蛋白)可以很大程度上替代血清。在培养基的发展进程中,细胞培养技术也逐步走向规模化。1957 年Graff 用灌注培养法培养悬浮细胞,细胞密度达到1×1010~2×1010cells/L,标志着灌注培养法的诞生[7];1962年Capstick成功大规模培养小鼠肾细胞(BHK),标志着动物大规模培养技术的起步[8]。随后1967 年,Van Wezel 等[9]用DEAE-Sephadex A50为载体培养细胞,建立了微载体培养技术,这一技术的应用为贴壁依赖性哺乳动物细胞的大规模培养开辟了新的途径。70—80 年代,利用动物细胞培养获得治疗性蛋白等生物制品发展迅速,在医学领域发挥了巨大作用。1975 年Kohler 和Milstein[10]将产生抗体的淋巴细胞与肿瘤细胞融合,获得了既能在体外无限繁殖,又能产生特异性抗体的杂交瘤细胞,成功建立了单克隆抗体技术,并因此获得了1984 年诺贝尔医学和生理学奖。1986 年Demo Biotech 公司首次利用微囊化技术培养杂交瘤细胞生产单克隆抗体,从此单抗的生产实现工业化,开始广泛应用于生物医学研究和临床治疗等多个领域[11]。在大规模培养过程中,保证产品的产量和质量至关重要,1989 年,Konstantinov 首次提出了大规模培养过程中的生理状态控制,为细胞培养工艺中优化控制理论奠定了基础[12];随后张嗣良[13]提出基于生物过程多尺度参数相关分析理论,并结合PAT 技术,实现生物过程的优化与放大。2004 年美国食品和药物管理局(FDA)正式发布了过程分析技术(PAT)工业指南,通过在线过程监测从严格的质量测试转向了灵活的质量设计方法。如今正处于大数据时代,基于大数据的智能生物制造顺应时代发展。2019 年美国工程生物学会联盟提出“基于多组学数据的机器学习的DBTL 循环支持系统”理论,从多尺度逐步发展为数据科学及智能化,将成为我国生物工程领域进步的一项重要内容[14]。在基因治疗方面,Yang 等[15]利用合成生物学方法开发出一种简单、稳定的光调控基因表达系统(light on),可以精确定位、定量、定时控制功能基因的表达,在生物治疗领域具有非常广阔的前景;2014 年Karl和Outi 等[16]开发一种方法使来自八细胞胚胎的单细胞培育成为可能,意味着可以用一个细胞大规模地生成干细胞,为干细胞治疗带来了希望。随后,广州生物医药与健康研究院开发了“全自动干细胞诱导培养设备”,首次实现了以机器学习以及人工智能算法为判定的细胞自动化诱导[17],为我国智能生物制造提供了上游细胞来源的培养设备(图1)。
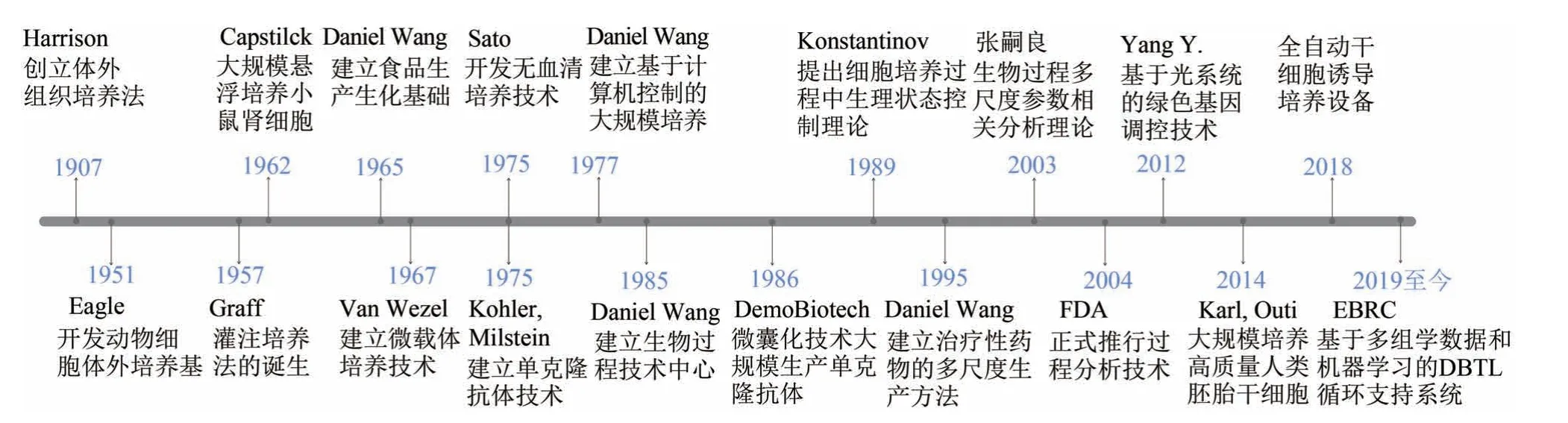
图1 动物细胞大规模培养技术发展史以及细胞培养技术发展的里程碑事件(从1907年体外组织培养法的建立,发展至今基于多组学数据和机器学习的智能生物制造,列出了动物大规模培养技术的发展过程以及细胞培养技术发展的突破性事件;EBRC—美国工程生物学会联盟)Fig.1 History of large-scale animal cell culture technology and milestone events in the development of biotechnology(From the establishment of in vitro tissue culture in 1907 to the development of intelligent biomanufacturing based on multi-omics data and machine learning,the chronological development of large-scale animal culture technology and the breakthrough events in the process are highlighted;EBRC—The Engineering Biology Research Consortium)
动物细胞大规模培养体系建立过程涉及的主要技术包括优良细胞系的构建、培养基的优化与开发、培养过程工艺优化与放大策略制定、目的产物的分离纯化等。目前,大规模细胞培养的技术已经非常成熟,在生物医药的生产中已经得到了广泛的应用。在生物制药中,细胞是病毒、蛋白的表达载体,细胞质量直接影响蛋白的表达量或者病毒的滴度,因此构建与筛选优质细胞是关键。采用高产细胞株(高抗体蛋白表达、高病毒产率)可以提高目的产品的产量并且降低成本,是产业化的首要选择。同时,安全性也是生产中需要考虑的一个重要因素。中国仓鼠卵巢(CHO)细胞一直是生产重组蛋白的首选[18],主要是由于:①CHO 细胞具有准确的转录后修饰功能,表达的糖基化治疗蛋白在分子结构、理化特性和生物学功能方面最接近天然蛋白分子;②它的产物分泌在细胞外,而且很少分泌自身的内源蛋白,便于下游产物分离纯化;③具有重组基因的高效扩增和表达能力;④CHO 细胞通常贴壁生长,也可悬浮生长,具有较高的耐受剪切力和渗透压能力,并且贴壁生长的CHO 细胞可以在微载体上进行悬浮培养[19]。因此,以CHO 细胞为基础的单克隆抗体生产工艺已经非常成熟,通常可达到很高的抗体效价,传统的分批培养7~14 天通常效价为1 g/L,补料分批培养约为10 g/L[20]。如今采用一种灌流培养的方式,随着培养基的连续供给而不间断地生产单克隆抗体,这种方式为细胞提供了更合适的生长环境,因此在细胞培养过程中可以获得更高的细胞密度和活力[21]。
在动物细胞培养过程中,培养基为细胞生长、维持提供营养,满足其物质与能量需求。含血清培养基是目前最常用的培养基之一,血清提供很多的生物活性成分,包括蛋白质、维生素、生长因子和激素,为细胞提供所有必要的营养,促进细胞增殖和改善特定细胞功能[22]。但是由于血清成分复杂,不仅会增加产品分离纯化的成本,还容易引起病原体污染[23]。血清替代品种类多样,包括激素、生长因子、贴壁因子和结合蛋白等物质,不同类型的细胞对于这些因子的种类和浓度需求不同,因此需要对这些成分进行筛选和优化,以满足细胞生长需求[24]。此外,一些新的方法也进入了培养基优化领域,包括多种“组学技术”,如蛋白质组、代谢组、转录组,这些技术能够更好地帮助理解细胞生理特性,有助于改进细胞生产过程[25]。Chong 等[26]使用高效液相色谱(HPLC)和质谱(MS)相结合的方法表征培养基成分、胞内和胞外的氨基酸浓度以及影响细胞增殖和生长的相关代谢途径。
细胞大规模培养过程中,监测和控制策略的进步提高了细胞生产性能和稳健性。通常对生物过程涉及的物理、化学和生物学参数进行监测,以过程产生的数据为基础结合细胞特性,并运用生物反应动力学将一些变量控制在合适的范围内,以满足细胞生长需求。这些变量,如温度、溶氧、pH 值等环境因素以及营养物质浓度和代谢副产物浓度,决定了细胞生长和代谢特征。同时还包括一些反映细胞生长和代谢特征的软测量指标,如细胞比生长速率、营养物质的比消耗速率、代谢副产物的比生成速率、摄氧率以及二氧化碳释放速率等。随着在线生物传感器的不断发展,生物反应器参数的在线监测和控制技术也得到飞速发展。例如,活细胞传感仪依靠介电常数和介电谱可更加准确地确定活细胞浓度[27],由于正常活细胞具有完整的细胞膜,胞内的带电荷离子在特定频率下的交变电场可以产生极化现象,使得活细胞可以被看作是极小的电容器。通过检测电容信号,再经过一定的信号处理,可以得到相应的电容值,其大小与环境中的活细胞量成正相关,因此电容值就可以用于测量活细胞浓度[28]。利用基于近红外和中红外的光谱探针,可以对复杂的细胞培养液成分进行评估,如营养物质、副产品、活力以及细胞和重组产物的浓度[29]。
生物反应器是动物细胞培养的核心设备,其结构的优化与设计一直是生物过程优化中非常关键的环节。搅拌式生物反应器由于其机械结构简单、易于操作,是目前应用最广泛的一种生物反应器。一般搅拌式生物反应器体积在1.5~25 L 不等。虽然反应器的结构简单,但反应器内部形成的流场环境却非常复杂,如反应器内部流体的混合、剪切环境等,这些因素使得对生物反应器操作条件进行优化和放大非常困难[30]。因此,研究人员通过研究生物反应器流场特性,包括混合、相间传质、剪切等,将其与细胞生理代谢特性相结合进行生物过程的优化和放大。Liu 等[31]通过对红花细胞进行放大培养,发现随着反应器规模的增加,搅拌器内的剪切力也随之增加,会导致培养过程放大失败。为了深入研究反应器内细胞生长与剪切力的关系,利用定向剪切试验拟合了细胞在剪切作用下的死亡动力学,并将死亡动力学整合到流场模型中,根据细胞在流场中的运动轨迹和细胞所经历的剪切力的大小,成功模拟了细胞在15 L 反应器内剪切对细胞生长的影响,为生物反应器的设计提供了很好的依据。
1965 年因全球粮食和饲料资源分布不佳,Daniel I.C.Wang 建立食品生产生化基础平台,解决了粮食和饲料短缺的问题。同一时期能源危机出现,为了大规模生产各种液体燃料以及生物制品,Daniel I.C.Wang 等引入计算机技术促进和理解大规模生产过程以提高产量。到1980 年,重组脱氧核糖核酸技术被视为一个变革性事件,许多新的人类治疗产品的生产潜力正在成为现实,Daniel I.C.Wang 对动物细胞培养的兴趣持续发展,并建立生物技术过程工程中心(BPEC)开始着手研究动物细胞培养技术[32]。从20 世纪80 年代开始,Daniel I.C.Wang 通过微载体技术、生长培养基设计、过程监测和控制以及新颖的生物反应器设计来改进细胞培养,大大改善了操作条件。到90 年代中期,Daniel I.C.Wang 课题组的研究转向由分子尺度理解生物过程,从反应器到细胞,再到代谢途径,最后到蛋白质本身,致力于阐明过程操作是如何影响蛋白质的翻译后修饰以及细胞行为,并于1995 年建立治疗性药物的多尺度方法。Daniel I.C.Wang 课题组通过这些研究改善了治疗性蛋白的生产过程,推动了生物制药行业的进步[33]。
本文作者将结合实际案例对动物细胞大规模培养在细胞株的构建、培养基的开发以及培养过程的优化与放大等方面取得的突破与进展进行系统的总结。在此基础上,对细胞大规模培养过程实现智能生物制造进行展望。
1 优良细胞株的构建
合成生物学作为一种新兴的、汇聚性的学科,随着基因工程技术的进步和合成生物学理念的深入,已经成为生物学最有发展潜力的领域之一[34]。基因工程技术使人们不再受自然变异和选择的限制,通过对目的基因的改造可以大幅度提高细胞株的性能。将其结合代谢工程,在代谢网络中对酶基因引入、敲除或调控可以创造新的细胞类型。细胞代谢网络非常复杂,从细胞到产品往往包括几十步反应,因此,目前一些比较常用的代谢工程改造策略就是过表达产物合成途径中的关键酶,解除产物合成抑制或敲除副产物生成途径[35]。通过这种代谢工程与合成生物学相结合的方法,人们可以获得大量的工程细胞株来生产生物制品(如单克隆抗体)[36]。
1.1 单克隆抗体生产过程中的“产品质量”
单克隆抗体制造的目的是产生具有与体内情况尽可能接近微观异质性的蛋白质。单克隆抗体的主要序列由基因决定,但决定重组蛋白微观异质性的是翻译后修饰[37]。糖基化是细胞进行的翻译后修饰过程,它是通过某些氨基酸共有序列将各种糖基添加到蛋白质骨架上,含有这些糖基的蛋白质被称为糖蛋白。蛋白质糖基化修饰可以增加重组蛋白的溶解性、稳定性以及生物活性[38]。
糖蛋白中众多糖(如半乳糖、岩藻糖、N-乙酰氨基葡萄糖)的末端唾液酸化尤为重要。唾液酸是一种酸性九碳单糖,以糖苷形式与其他糖的不同位置相连,最常与半乳糖或N-乙酰半乳糖胺相连[39]。末端糖唾液酸的存在会增加体内糖蛋白的循环半衰期,即延长糖蛋白的存在时间,使重组蛋白在人体内发挥更大的效力[40]。核苷酸糖底物的使用和糖蛋白通过内质网和高尔基体的运输也是决定蛋白质糖基化的重要因素,其中大多数核苷酸糖都是在胞浆中合成的,通过核苷酸转运蛋白将胞浆中的核苷酸糖转移到高尔基体腔内。CMP-唾液酸的激活发生在细胞核中,因此限制CMP-唾液酸向高尔基体的运输可能是重组糖蛋白唾液酸化不能进一步增加的原因[38]。Daniel I.C.Wang 课题组[41]构建了CMP-唾液酸转运蛋白(CMP-SAT)表达载体,将其导入CHO 细胞中过表达并观察干扰素-γ(IFN-γ)的唾液酸化水平,发现与未经过表达的CHO 细胞相比,在转录水平和蛋白水平上的CMP-SAT 总表达水平分别提高了2~20 倍和1.8~2.8 倍,并且IFN-γ 的唾液酸化水平提高了4%~16%,这种策略可使我们最大限度地提高糖蛋白唾液酸化水平。
糖蛋白中唾液酸含量同样受到酶的影响,唾液酸转移酶在细胞内的表达可以增加唾液酸,或者唾液酸裂解酶的表达可以去除唾液酸。因此需要找到一种方法在整个细胞培养过程中抑制唾液酸酶的活性,目前比较通用的技术是在胞浆内唾液酸酶被释放到培养基前对其进行基因灭活,如RNA 干扰技术。RNA 干扰技术是将与mRNA 对应的正义RNA 和反义RNA 组成的双链RNA 导入细胞中,可使mRNA 发生特异性的降解,导致相应的基因沉默。Daniel I.C.Wang课题组[42]利用RNA干扰技术沉默唾液酸酶的活性,首先确定了一个降低唾液酸酶mRNA 和蛋白水平的21nt 双链siRNA,并通过实时RT-PCR 和唾液酸酶活性测定比较每个siRNA 序列的效果,接下来将选定的siRNA 序列整合到CHO 细胞中进行生产,筛选出稳定的细胞系。理论上IFN-γ 的最大唾液酸含量为4 mol唾液酸/mol IFN-γ,他们的结果表明利用该种方法可以使唾液酸酶活性显著降低,并将唾液酸酶含量维持在3.1 mol唾液酸/mol IFN-γ,进一步提高了糖蛋白的性能。Zhang 等[43]同样利用RNA 干扰技术使用短干扰RNA(siRNA)和短发夹RNA(shRNA)处理CHO 细胞,以减少两个唾液酸酶Neu1 和Neu3 的基因表达。通过敲低Neu3 的表达,发现CHO 细胞中唾液酸酶功能降低了98%,分泌的IFN-γ含量增加了33%。
1.2 单克隆抗体生产过程中“产品产量”
在满足产品质量要求的条件下,获得高产量的单克隆抗体同样重要。目前,细胞系构建中常用的筛选体系为二氢叶酸还原酶(DHFR)和谷氨酰胺合成酶(GS)系统,基于此将带有目的基因和筛选标记(DHFR、GS 基因等)的质粒转染至宿主细胞后,使用相应的条件培养基筛选出重组细胞。为提高重组蛋白的表达水平,可以采用加压甲氨蝶呤(MTX)、蛋氨酸亚氨基代砜(MSX)等多轮筛选的策略,通过增加目的基因的拷贝数,从而增加重组蛋白的产量[36]。
哺乳动物表达系统一般是使用MTX 扩增缺乏DHFR 的CHO 细胞,由于无法自身合成四氢叶酸,这种DHFR缺陷细胞需要甘氨酸、次黄嘌呤等的存在才能存活。因此可以将DHFR和目的基因同时转染DHFR缺陷型细胞后,通过能够从上清液中提取次黄嘌呤等物质筛选出成功转染的细胞。MTX 是DHFR 的竞争性抑制剂,在MTX 浓度选择压力下DHFR 必须扩增出很多的拷贝数才能存活,从而得到抗MTX 的细胞系。这样与DHFR 基因共同转染的目的基因随着DHFR的扩增而扩增,从而重组蛋白的产量逐渐增加。为了进一步提高重组蛋白的产量,还可以弱化选择标记,在重组蛋白基因后添加弱化的选择标记基因,这样转基因细胞需要更强的转录位点或转录和翻译机制才能生存下来,从而大量生产重组蛋白。ARE 是一段可以破坏mRNA稳定的序列,而MODC PEST是在蛋白质上发现的提供不稳定性的降解信号的一个区域,二者协同作用可以降低细胞中目的基因的表达[44]。Daniel I.C.Wang 课题组将富含AU 的元件(ARE)和小鼠鸟氨酸脱羧酶(MODC PEST)区域应用于表达载体中的选择标记,他们验证了ARE、MODC PEST、ARE 与MODC PEST 两个区域相结合,分别使IFN-γ 的产量提高到4.0 pg/(103cell·d)、15.8 pg/(103cell·d)和31.9 pg/(103cell·d),提高了1.7 倍、6.6 倍和13.3 倍。这些结果证实了将不稳定序列用于选择标记可以提高重组蛋白的产量[45]。随后,他们又将MTX 提高到50 nmol/L,与扩增前相比,转染含有不稳定选择标记载体的细胞中IFN-γ 的产量提高到了104.3 pg/(103cell·d)、167.2 pg/(103cell·d)和1051.7 pg/(103cell·d),证明了MTX 与不稳定序列结合使用以提高重组蛋白产量的可行性[45]。细胞培养过程中乳酸和氨的积累可能会抑制细胞生长,同时抑制特定产物的合成速率导致抗体产量降低。Chen等[46]通过基因操作(同源重组技术)将杂交瘤细胞中的乳酸脱氢酶基因(LDH-A)阻断,之后筛选出LDH 缺陷型细胞(LDH-NE21),这种细胞的乳酸比合成速率比正常的细胞低50%。在细胞密度和细胞活力方面,改造后的杂交瘤细胞总密度可达5×106cells/mL,比亲本细胞提高了30%。
研究人员发现哺乳动物细胞的分泌能力不足限制了重组蛋白产量的提高[47],因此赵建兵等[48]试图将与蛋白分泌相关的基因XBP1 过量表达来提高重组CHO 细胞中乙肝表面抗原(HBsAg)的分泌。首先他们添加了DMSO(促进二硫键的形成)使HBsAg 总量提高了9 倍,但大多数HBsAg 积累在胞内,胞外的分泌量仅提高了80%,说明这条分泌途径已经处于饱和,胞内的HBsAg 不能分泌到胞外。在此基础上他们过表达XBP1 基因,并不能促进HBsAg 的分泌。随后他们添加了二硫苏糖醇(DTT,形成内质网压力)。在DTT 诱导下蛋白无法运输出内质网,这时过表达XBP1 基因使HBsAg 的分泌能力增强,说明在选择过表达蛋白分泌相关基因时需要了解到其相对应的分泌限制部位。
2 培养环境
2.1 生长培养基
在动物细胞培养中,最重要的因素之一是培养基的组分。动物细胞对其培养环境非常敏感,培养基中包含许多必需的营养物质,如葡萄糖、氨基酸、维生素、无机盐和血清成分,才能维持生存和生长。细胞培养过程中培养环境会发生变化,因此设计一个最优的培养环境,并将其控制在一个最佳区域内,以最大限度地提高生产效率是至关重要的。这就要求将影响培养环境(营养物质浓度、副产物积累)和细胞生长的因素综合到动物细胞培养基的设计中。
常规培养基的设计主要包含以下几个因素:第一,通过在培养基中添加各种营养物质满足细胞的生长需求;第二,动物细胞培养除了产生重组蛋白以外,还会产生氨和乳酸等有毒副产品,因此,在培养基设计中需要考虑影响氨和乳酸形成的因素,以减少这些有毒副产物的形成;第三,为了避免血清的不同批次以及不明组分对细胞培养的影响,最大限度地提高工艺的稳定性,需要开发一种完全化学合成培养基。
2.1.1 基于化学计量模型约束的培养基设计
营养物质不仅影响细胞的生长速度,而且营养物质水平降低到一定浓度可能会从化学计量上限制培养过程中所能获得的最大细胞密度。因此,了解细胞对营养的需求可以对培养基进行定量设计,避免或减少营养的消耗和积累。基于此,Daniel I.C.Wang课题组[49]按照动物细胞生长的化学计量营养需求来制定培养基设计策略,将复杂的细胞新陈代谢归为“黑匣子”,细胞生长被表述为单个参数,得到了一个简化的化学计量模型。细胞生长需要葡萄糖、氨基酸、维生素、无机盐和血清等成分,但由于细胞中无机盐很少,达到化学计量比限制的可能性很小;而血清则是细胞生长所必需的,因此忽略这两种成分。以葡萄糖、20 种氨基酸和10 种维生素作为反应物,细胞量(包括蛋白质、脂质、DNA、RNA等混合物)、产物和消耗的ATP作为反应的产物列出化学计量方程,其中葡萄糖作为唯一的能量来源,并且简化谷氨酰胺的代谢,其他营养元素的化学计量系数根据细胞组成确定[50](图2)。这个模型可以用来设计补充培养基,传统补料分批方式是将葡萄糖和谷氨酰胺等关键的营养元素维持在一定水平上,可能会消除这两种营养元素的化学计量限制,但细胞的生长也会受到其他营养元素的化学计量限制。这个模型通过化学计量分析,根据细胞的生长需要确定补充培养基的组成,可以确保细胞最佳和稳定地生长。然而,氨和乳酸等有毒副产物的积累,使得细胞密度和产物浓度往往较低。乳酸的积累是由于大量葡萄糖的转化,氨的积累则是谷氨酰胺大量消耗合成非必需氨基酸造成的,因此需要进一步探究合适的葡萄糖、谷氨酰胺和非必需氨基酸的浓度。随后,他们在补料培养基的设计中采用了该模型,并考虑了葡萄糖、谷氨酰胺以及非必需氨基酸代谢的主要途径对模型进行修正。在2 L 的生物反应器中使用优化的补充培养基自动补料,使得乳酸生成量(4.2 mmol/L)比生物反应器分批培养(34.5 mmol/L)降低7.2 倍,比T 瓶补料分批培养(30.9 mmol/L)降低6.3 倍,同时氨的生成也减少了。最重要的是,其产物的抗体浓度达到900 mg/L,分别比分批(52 mg/L)和补料分批(551 mg/L)培养提高了16倍和63%[51]。但是,他们得到的最大活细胞密度仅为7.5×106cells/mL,比总细胞密度(14.5×106cells/mL)低得多。为了探究限制最大活细胞密度的因素,他们对补充培养基的化学计量模型做了进一步优化。在之前的补料培养基的基础上将胎牛血清、无机盐和微量金属(Fe2+,SeO32-,Li+,Zn2+,Cu2+,PO43-)周期性地加入到生物反应器中,不仅使得最大活细胞密度为1.7×107cells/mL,比以前的补料分批培养(6.3×106cells/mL)提高了1.7 倍,而且证实了最大活细胞密度的显著提高是由于添加了血清和微量盐来设计新的补料策略。乳酸比合成速率降至0.36 mmol/(107cell·h),比以前的补料分批培养低30%;氨比合成速率降至0.28 mmol/(107cell·h),比以前的补料分批培养低60%,最终的抗体效价也有所提高[52]。这个化学计量模型同样可以用于CHO 细胞补料分批培养,添加化学计量平衡的补充培养基显着增加了活细胞密度,并减少了有毒副产物的形成,如乳酸比合成速率从分批培养的0.15 mmol/(109cell·h)降低到补料分批培养的0.024 mmol/(109cell·h)。与分批培养相比,分批补料培养的IFN-γ产量提高从7.6 mg/L升高到30 mg/L,提高了3 倍,并且IFN-γ 糖基化水平也略有提高。蛋白质的糖基化受到葡萄糖浓度的影响,由于在补料分批培养过程中营养物质的浓度保持恒定,因此IFN-γ的糖基化在整个补料分批培养过程中保持稳定[53]。

图2 基于化学计量模型约束的培养基设计[以葡萄糖、20种氨基酸和10种维生素作为反应物,细胞量(包括蛋白质、脂质、DNA、RNA等混合物)、产物和ATP作为反应的产物列出化学计量方程]Fig.2 Media design guided by stoichiometric and the constraint-based model(Taking glucose,20 amino acids and 10 vitamins as reactants,cell mass including the mixtures of protein,lipid,DNA,RNA,etc.,products and ATP as reaction products to develop stoichiometric equations)
2.1.2 代谢废物的脱除
营养限制和细胞废物积累是限制哺乳动物细胞培养中细胞生长和蛋白质生产的两个主要因素,因此细胞废物去除也是必不可少的一个步骤。
氨和乳酸是哺乳动物细胞培养中的主要抑制废物。上述2.1.1 中已经描述过,在细胞株的构建方面,通过基因工程手段敲除或敲低乳酸和氨合成途径中关键酶的基因,以降低两种代谢废物的产生;而在细胞培养过程中代谢废物的积累不仅会影响细胞的生长,而且还会影响重组蛋白的性质,因此过程中代谢废物的去除尤为重要。氨由谷氨酰胺分解和谷氨酰胺的非酶降解产生,在2~10 mmol/L 的氨浓度范围内细胞生长受到50%的限制。乳酸主要由糖酵解产生,但也可由谷氨酰胺代谢产生,20~40 mmol/L 的乳酸会使细胞的生长减少50%[54]。动物细胞培养中代谢废物的浓度取决于营养物质浓度、细胞类型和生物反应器的操作方式。为了减少细胞培养中的代谢废物积累,Daniel I.C.Wang 课题组率先采用电渗析法,通过施加直流电场使乳酸根离子和铵根离子定向迁移进而去除培养基中的乳酸根和铵根离子。他们在一个带有两端隔室的矩形培养室中培养悬浮细胞,并使用磁性搅拌棒使细胞保持悬浮状态,培养室两端连接一个内盐桥(保持培养基恒定状态),内盐桥的另一端插入培养基中,同时两端培养基各连接一个外盐桥(隔离有毒的产物,防止其进入培养室内),外盐桥的另一端插入到含有0.5 mol/L NaCl/20 mmol/L NaHCO3的溶液中,将铂片浸泡在外电极槽中以传递直流电场。连续增加直流电场使培养基中带电荷的乳酸根离子和铵根离子通过盐桥迁移至负极培养基中,同时从正极培养基迁移相同电荷的离子以维持培养室内电荷量的恒定,通过这种方法可以有效去除培养室内的乳酸根离子和铵根离子。在电流密度为50 A/m2的无细胞条件下,成功去除了10 mmol/L 氨和45 mmol/L 乳酸;在杂交瘤培养开始时,加入7.5~12.5 mmol/L的外源氨,外加直流电场能够完全去除这些添加的物质。最后,将该电动技术应用于杂交瘤细胞的分批和谷氨酰胺补料分批培养中乳酸和氨的去除。在外加电流密度为50 A/m2时,去除细胞产生的氨,使细胞生长和抗体效价提高了约50%,分别达到3.9×106cells/mL 和204 mg/L,并且他们验证了这种动电学技术对细胞功能、葡萄糖和谷氨酰胺的消耗没有影响[55]。之后,他们又将培养基中所有的营养物质,包括氨基酸和维生素提高到正常浓度的4倍,同时应用直流电场去除细胞培养基中的氨和乳酸,进一步使得杂交瘤细胞的生长从3.7×106cells/mL 增加到9.1×106cells/mL,抗体产量从170 mg/L 增加到550 mg/L。直流电场配合高浓度营养物质显著提高了细胞的增长和抗体的产生[56]。然而,由于细胞株的特异性以及培养环境的限制,这种动电学技术并没有被广泛使用。随着灌流培养技术的进步与发展,可以通过不断流入新鲜培养液并流出部分旧培养液减少代谢废物的积累,成功地提高了细胞总体生长率和抗体效价[57]。Hiller 等[58]开发了一种由pH 控制葡萄糖输送的泵,细胞对乳酸的消耗增加以及随后培养基pH 的升高激活了泵,将更多葡萄糖输送到培养基被细胞消耗产生乳酸,从而平衡pH 值,这种方法显著提高了细胞增殖以及抗体产量。Lu等[59]基于在线活细胞传感器以及葡萄糖在线监测计算出特定的比消耗速率,采用灌注的方式流入培养基使细胞的效价提高了6~9 g/L。
2.1.3 无血清培养基的开发
血清在动物细胞培养中可以提供多种营养成分,如激素和各种生长因子,促进细胞增殖。此外,它还含有几种载体介质,如白蛋白和转铁蛋白,它们能将各种维生素、激素和亲脂分子输送到细胞内[60]。然而,血清的主要缺点是由于批次之间的差异而缺乏重复性,其非标准化和复杂的成分是培养基可变性的一个重要原因,这降低了生物过程的结果和稳定性,因此人们致力于开发一种血清替代品,可以添加从大豆、小麦和酵母中提取的不含动物成分的蛋白水解物来支持细胞生长和生产力[61]。
Gu 等[62]探究了动物组织水解物Primatone RL作为血清替代品在500 mL 转瓶中分批培养对CHO细胞的影响,随着Primatone RL浓度的升高,与不添加相比,活细胞密度从2×106cells/mL 升高到4×106cells/mL,但其浓度达到20 g/L 时可能会抑制细胞的生长。IFN-γ 的产量没有显著变化,然而唾液酸化程度与正常培养相比非常低,因此,在寻找血清替代物时,不仅要提高治疗蛋白的产量,也要考虑到产品质量。Chen等[63]对奇努克鲑鱼胚胎细胞(CHSE)进行低血清培养,使用新生牛血清(NCS,10%)代替5%的胎牛血清(FBS),发现细胞在两种培养基血清中的生长速度相同但在NCS 中培养的细胞存在颗粒和气泡,因此为了改善细胞状况,逐步降低NCS 的浓度到2%,同时补充Primatone RL,得到的细胞密度达到1.4×106cells/mL,与添加5%FBS 的情况相同。之后将CHSE细胞以6.5×105cells/mL接种到5 L生物反应器中,22 d后最大活细胞密度达到5.9×106cells/mL。为了进一步去除培养基中的血清,张芳等[64]建立了一个适用于重组CHO-GS 细胞生长和外源蛋白表达的无谷氨酰胺无血清培养基(SFMB)。谷氨酰胺代谢会产生大量的氨进而抑制细胞生长,通过在CHO 细胞中引入谷氨酰胺合成酶基因(GS),可以不用额外添加谷氨酰胺,而是以谷氨酸和氨为底物合成谷氨酰胺来减少氨的生成。他们又采用DoE 统计方法优化了胰岛素和转铁蛋白这两种无血清培养基添加蛋白的最佳浓度,分别在5~6 mg/L 和5~10 mg/L,以及Hadamard 统计方法对乙醇胺和肌醇等6种变量进行优化分析,其中乙醇胺和肌醇对细胞生长有很好的促进作用,浓度分别为1.25 mg/L 和10 mg/L,但其余因素作用不明显。该培养基用于在100 mL 转瓶中培养CHO-GS细胞,最大活细胞密度达到1.5×106cells/mL、蛋白表达达到0.48 mg/L。同样用谷氨酸代替谷氨酰胺的方法却不适用于Vero细胞,可能是由于缺少氨基氮导致细胞产量下降。Huang等[65]在含有谷氨酸的培养基中额外添加NH4Cl提供氮源,使细胞生长显著增加,其最大细胞密度仅次于添加谷氨酰胺的培养基。但NH4Cl本身有毒性,因此选用富含氨基氮的天冬酰胺作为替代,与谷氨酰胺相比,添加4 mmol/L的天冬酰胺使细胞密度达到2.1×106cells/mL。易小萍等[66]在之前优化的SFMB 的基础上,通过反相高效液相色谱检测CHO-GS 细胞培养96 h 前后氨基酸的浓度,优化了氨基酸添加量,补充了缬氨酸、蛋氨酸和苏氨酸3种氨基酸;又分别筛选了不同浓度的胰岛素、转铁蛋白等蛋白类激素,3 种激素其最佳浓度均为5 mg/L;并加入了0.15% 的Primatone RL 的蛋白水解物作为血清替代物,通过上述优化的无血清低蛋白培养基(SFMC)与之前的SFMB相比,在1.5 L生物反应器中的活细胞密度从2.9×106cells/mL提高到3.5×106cells/mL,并且重组CHO 细胞分泌的HBsAg 的表达量也从1.2 mg/L提高到1.5 mg/L[66]。
由于上述的培养基仍含有动物源成分,其成分尚不清楚,可能会造成潜在的污染。张大鹏等[67]在1.4 L 生物反应器中以16 mmol/L 的柠檬酸铁、1 mg/L 的硫辛酸和0.5 g/L 的酵母水解物替代SFMC 中的转铁蛋白、胰岛素和动物组织水解物,用经过优化后的培养基培养的活细胞密度可以达到9.3×106cells/mL,证实SFMC中的动物源、蛋白成分可以被一些微量金属元素替代,其对细胞生长的作用可能高于蛋白质。
2.2 以过程分析技术(PAT)为核心的大规模细胞培养过程工艺优化与放大
为了满足质量需求的同时获得高产量的抗体,优化培养操作参数是至关重要的。物理参数(例如温度、转速)、化学参数(例如pH、渗透压、溶氧和二氧化碳以及代谢物水平)和生物参数(例如细胞浓度、活力、细胞周期、线粒体活性以及NADH 和LDH 水平)都能显著影响抗体的质量。2004 年,美国食品和药物管理局(FDA)提出了过程分析技术(PAT),旨在进行先进的工艺监控以及更好地理解关键工艺参数对关键质量属性的影响[68]。PAT 是一个通过实时测量原材料和过程本身的关键技术指标来实现过程设计、分析和控制制造的技术集成系统,目的是确保最终产品质量[69]。它控制的不仅仅是几个化学和物理参数,而是通过细胞生理代谢与最终产品的相关性来判断细胞的生理状态,以便在需要时进行控制[70]。PAT技术引导制药行业从严格的测试质量转向灵活的设计质量方法(QbD)[71],通过考虑生物、物理、化学等各种工艺参数对培养过程产生的影响,然后应用统计实验设计(DoE)、多元数据分析等技术寻找关键工艺参数与产品质量属性之间的关系,并应用传感器对关键过程变量进行实时监控,从而保证产品质量的一致性[72]。Daniel I.C.Wang为引导PAT走向现实和可持续的工业应用做出了重大贡献[73]。在20 世纪70 年代中期,Daniel I.C.Wang 等发起了一个关于计算机监测和控制的研究项目,在此之前人们认为除了对环境条件的简单反馈控制外,计算机对生物过程的控制并没有很大的作用。然而Daniel I.C.Wang 等[74]通过设定控制器在线控制单个反应器的变量(如酵母生物量或控制补料培养基添加),允许研究人员通过计算出的变量进行过程控制和优化。随后他的注意力从酵母生物量生产转移到生产单细胞蛋白(SCP),初次使用在线吸光度测量开发了用于从亚硫酸盐废液中连续生产SCP 的循环和进料速率的计算机控制。Daniel I.C.Wang在生物加工领域的巨大贡献为现在和未来进行的PAT奠定了坚实的基础。
如今用于监测生物过程的方法基本可分为两大类:在线检测(on-line)或近线检测(at-line)。on-line 测量技术通常基于在线生物传感器设备,例如直接放置在生物传感器内的侵入式探头(温度、溶氧、压力等)以及在生物过程附近使用的在线设备(尾气分析仪、光谱仪等),其中信号能够实时监控。而at-line在检测之前需要进行人工取样或是自动取样,再到附近的化学仪器上进行检验,如高效液相色谱对目标分子、副产物或培养基成分的分析(图3)。

图3 动物细胞培养过程检测技术[69](通过在线检测和离线检测动物细胞培养过程中的变量,并根据数据对系统进行反馈控制;DO—溶解氧)Fig.3 Detection technology for animal cell culture processes[69](Through online and offline detection of variables in the process of animal cell culture,and feedback control of the system based on the data;DO—dissolved oxygen)
2.2.1 在线检测(on-line)
(1)活细胞传感仪
细胞浓度是哺乳动物细胞培养过程中最重要的过程变量。目前细胞浓度的测量可以分为在线和离线两大类。在离线测量中,研究人员通常在给定体积中进行细胞计数来计算细胞密度,但这种方法费时费力,容易受到外界因素的影响,不能反映培养过程中活细胞密度的变化[75]。作为在线测量,目前主要有近红外光谱法、荧光分析法、电容法等。其中电容法在测量时受细胞组成形式、气泡、颗粒等因素的影响较小,已经成功应用于细胞培养过程中[70]。活细胞传感仪通过在样品上施加周期性交变电场来测量细胞悬液的电容,根据电容值估算细胞存活的浓度。基于PAT的优化工艺相比于传统的方法更高效,Li 等[76]在植物细胞低温保藏中采用活细胞传感器快速定量冻存后细胞的活性与密度,其细胞活性与采用活细胞传感仪测定的电容值具有很好的一致性,证实了活细胞传感仪的可靠性。在疫苗生产方面,化磊召等[77]在昆虫细胞-杆状病毒载体表达系统(BEVS)上生产病毒样颗粒亚单位疫苗(VLPs),结合PAT技术利用活细胞传感器表征培养过程中的活细胞密度。由于细胞的代谢是细胞培养过程中重要的变量,而细胞线粒体的功能活性,细胞的葡萄糖比消耗速率和比氧消耗速率在测量时存在一定的滞后性,因此他们引入了活细胞电极的在线特征频率f值进行分析,该值与比氧消耗速率成正相关,实现了细胞代谢活性状态的在线监测。以f值的变化为依据确定最佳补料操作时间,可以使最高活细胞密度达到2.1×107cells/mL,相比于分批培养的最高活细胞密度1.2×107cells/mL提高了75%。
(2)光谱传感器
光谱学和传感器与适当的分析工具相结合,对于生物过程的监控尤为重要,目前使用的光谱方法主要有紫外-可见光、荧光光谱、红外光谱(近红外和中红外)以及拉曼光谱。
长期以来,红外光谱一直被用于固体、液体或气体样品中化合物的表征。对于细胞培养液,通常采用透射式测量。基于红外的测量是无损的,可用于实时监控培养过程中的培养基成分的改变[78]。大多数基于红外光谱的传感器可以制作成原位探头,如蒸汽灭菌的pH 或DO 探头,并直接插入到生物反应器中,实时监控生物过程[38]。一些人已经报道了在CHO-K1培养过程中使用大量的数据对红外光谱校准,可以很好地估计葡萄糖和乳酸浓度[79]。另外为了改进校准方法,并将校准模型扩展到更广泛的工艺中去,M.Milligan 等使用不同的细胞系对不同的细胞代谢参数(细胞浓度、葡萄糖和乳酸浓度)进行修正[80]。
虽然近红外(NIR)和中红外(MIR)光谱采样简单快捷,但近红外光谱产生的峰宽且重叠,使光谱的解释变得困难。中红外光谱的吸收较强,产生的光谱特征明显,然而水的干扰会使液相系统中样品的制备变得困难[81]。拉曼光谱是通过分子振动测量在不同频率上非弹性散射的光量,具有很高的化学特异性,可以检测出低于近红外光谱所能检测到的化学物质,而且拉曼光谱不需要样品制备就可以很容易地应用于各种水体系,因此,拉曼光谱被认为是最有前途的复杂细胞培养系统在线分析的光谱方法[82]。拉曼数据与化学计量模型相结合,来解释与测量的过程(Y变量)相关的光谱峰值(X变量),偏最小二乘法(PLS)建模经常被用作化学计量模型的选择,因为它通常在与拉曼光谱集成的化学计量学软件包中使用[83]。目前已经成功地使用原位拉曼探针测量葡萄糖、谷氨酰胺、谷氨酸、乳酸、氨以及细胞密度[81],并在小规模生物反应器中使用拉曼光谱为细胞代谢的参数(如葡萄糖浓度)建立偏最小二乘校准模型,将其应用于CHO 细胞大规模补料培养[84]。Eyster 等[85]基于拉曼光谱的营养控制策略,为了在生产单克隆抗体(mAb)的补料分批培养CHO 细胞过程中实现乳酸和葡萄糖的控制,建立拉曼光谱PLS 模型。通过实时预测葡萄糖和乳酸浓度,将葡萄糖浓度控制在4 g/L,乳酸浓度在2 g/L 时显著降低CHO 培养过程中的氨积累(68%),同时提高了mAb半乳糖化水平(50%)。
(3)尾气质谱仪
细胞培养过程中,细胞代谢状态可以通过检测培养过程中尾气中氧和二氧化碳浓度的变化进行表征;并且通过进一步的计算可以获得细胞代谢的关键参数,如氧气消耗速率(OUR)、二氧化碳生成速率(CER)和呼吸商(RQ)。为了监测尾气的成分,一般使用磁质谱仪来测量氧气,红外传感器来测量二氧化碳[86]。通过入口气体和出口气体之间含氧量的浓度差以及进出口气体的流量可以准确地估计氧气摄取率(OUR)。同样,通过测量二氧化碳浓度的差异来估计二氧化碳释放速率(CER)。耗氧量就是细胞代谢活动的一个关键指标,当细胞处于指数生长期,大部分的葡萄糖转化为乳酸时,耗氧速率(OUR)随着细胞浓度的增加而增加,由于大多数细胞培养过程都是以分批补料的培养方式进行的,补料的时间通常由细胞浓度决定,因此监测耗氧速率对控制补料时间非常有用[87]。
2.2.2 近线检测(at-line)
at-line 测量的样本需要从生物反应器中分离出去,并在接近反应器的地方进行分析,其中高效液相色谱对重组蛋白(如调节蛋白、疫苗、酶)的提纯或分析等方面已经取得了很大的成功。
治疗蛋白的生产过程较为复杂,主要是治疗蛋白需要复杂的翻译后修饰,如糖基化、磷酸化和二硫键的形成,而这些属性往往会受到细胞培养过程的影响,比如培养基中营养水平的不稳定可能会导致产品质量不均一,因此治疗性蛋白质的生产和提纯需要得到监控。Daniel I.C.Wang 课题组[88]考虑了无菌采样、分析中细胞处理、检测范围浓度、免疫球蛋白(IgG)的区分、时间等方面开发了一个自动监测杂交瘤细胞中IgG产生的系统。IgG 从杂交瘤细胞中分泌出来,在生长培养基中积累,因此取样时不需要破坏细胞。将样品从生物反应器中自动抽取到HPLC 系统的进样阀中,直接进入蛋白亲和柱上,立即对样品进行分析。该检测方法采用了蛋白亲和色谱法,具有很高的选择性,而且检测只需要3 min,实现了快速检测的目标。糖基化通常是治疗蛋白性质的关键决定因素,单一糖蛋白的不同糖型可以表现出不同的生物学特性,而且糖型异质性对培养环境敏感,因此糖基化模式的表征和检测至关重要。将重组免疫球蛋白经过提纯和纯化后,用LC/MS 进行分析,在线还原二硫键,可以快速确定糖型[89]。Daniel I.C.Wang 课题组建立了一种快速评价CHO来源的重组人IFN-γ两个潜在N-连接糖基化位点特异性的分析系统,用免疫亲和色谱从培养上清液中纯化目的蛋白,通过固定化胰蛋白酶柱快速进行在线蛋白水解,反相色谱分离代表潜在糖基化位点的两个糖肽。通过基质辅助激光解吸电离/时间离散质谱(MALDI/TOF)离线分析,以确定它们的寡糖结构。这种方法允许在2 h 内,仅使用0.5 µg(25 pmol)的产品来评估糖蛋白的微异质性[90]。糖蛋白的生物学功能同样高度依赖唾液酸含量,虽然之前的方法在MALDI 样品板上用唾液酸酶处理糖肽并用MALDI/TOF 定量估计去唾液酸聚糖的结构,但是由于唾液酸的糖苷键不稳定,可能破裂,这样就会对分析产生误差。Daniel I.C.Wang课题组[91]在此基础上进一步的优化,基于唾液酸分离特定位点的糖肽库,获得CHO 来源的IFN-γ 的位点和支链特异性唾液酸化的定量,通过这个系统对唾液酸含量的定量分析,发现细胞内唾液酸化不完全和细胞裂解过程决定了最终产品的唾液酸含量。
2.2.3 过程数据统计与分析
细胞培养过程是重组蛋白生产的关键环节之一[92],因此,在细胞培养过程中实时监测产品属性尤为重要。在线监测技术会产生大量的过程数据,一个大数据分析系统对于PAT的建立是非常重要的。因此,通过建立数学模型并使用模型进行数据分析后再对过程加以改进,可以进一步揭示细胞培养过程的规律,预测生物过程的发展并进行相应的调控,从而保证产品的质量和一致性。
(1)实验设计(design of experiments,DoE)
DoE 描述的是一种用于系统地筛选和评估关键工艺参数对过程响应影响的统计方法,当处理大量具有非线性的因素时,DoE 是一个非常实用的工具[72]。在鸡胚胎成纤维细胞(DF-1)生产禽流感疫苗过程中,Lin 等[93]为了提高感染传染性法氏囊病病毒(IBDV)的DF-1 细胞的增殖能力,通过代谢组学方法在GC/MS 和LC/MS 平台上分析DF-1 细胞在DMEM/F12(1∶1)和DMEM 两种培养基中细胞内代谢产物,得到的数据可以反映细胞培养过程中代谢途径的变化。他们使用这种方法鉴定出20 多种代谢物,推测氨基酸代谢和脂质代谢是影响细胞生长的主要因素,并通过DoE 方法优化了培养基的设计,最终促进了DF-1 细胞的增殖。之后,他们又采用同样的方法探究了感染IBDV 的DF-1 细胞与未感染对照组的差异以及对DF-1 细胞进行时序性分析,IBDV 通过中枢碳代谢、核苷代谢、脂质代谢等多种代谢途径影响DF-1 细胞的代谢。而通过时序性分析发现在长期培养过程中细胞生长的代谢物差异,确定是氨基酸、核苷和脂质相关代谢途径的改变。通过DoE 优化氨基酸和核苷的相关成分并给予补充,使得IBDV繁殖力大大增强,其滴度提高了20.7倍[94]。
(2)代谢通量与途径分析
代谢通量分析是一种良好的工具,分析中心碳代谢的碳通量来确定关键营养需求和控制生化反应的速率。代谢物质平衡模型已经可以快速有效确定代谢流和代谢流分布模式,可以进一步在连续培养系统这种更可控的环境下对其进行通量分析。
代谢通量分析模型可以用于分析细胞培养过程中,细胞营养需求和细胞生长、产物、能量之间的化学计量关系。Daniel I.C.Wang 课题组建立了一个动物细胞培养中营养平衡的化学计量模型,包含了葡萄糖和氨基酸在内的营养需求,并利用该模型设计了一种补料培养基,可以很好地预测细胞生长对营养物质的化学计量需要。但这个模型忽略了细胞生长的复杂的代谢网络,因此在这个基础上,他们利用之前所做的分批培养和补料分批培养的数据建立了化学计量平衡模型,计算ATP的总产量进行能量代谢相关的研究。大多数细胞代谢途径涉及ATP 和与ATP 相关的辅助因子,如NADH、FADH 和GTP。NADH 和FADH 的氧化磷酸化产生了细胞生长所需的大量ATP,NADH产生的ATP 由NADH 乘以其P/O 计算,FADH 同样由FADH 乘以其P/O 计算。通过计算不同营养物质对ATP 产量的贡献,发现大部分ATP(60%~76%)是由葡萄糖代谢产生的。约30%的ATP 来自谷氨酰胺,11%来自其他必需氨基酸;糖酵解途径在分批培养中(41%)比在补料分批培养中(27%)产生更多的ATP。TCA 循环提供了ATP 总产量的51%~68%,表明与生长无关的ATP 需求可能包含生物合成以外的需要,同时证明了能量代谢分析对细胞生长的重要性[95]。
能量代谢分析模型通过分析细胞能量与细胞生长之间的关系,鉴定出优良的细胞群体。Daniel I.C.Wang课题组[96]在对杂交瘤细胞培养过程中代谢通量进行分析发现,细胞凋亡的开始与细胞的能量之间有很强的相关性,其中线粒体对培养环境中细胞凋亡的启动起着重要作用。同时,他们发现一个细胞群体可以包含不同的亚群,通过罗丹明123(Rh123)染色和荧光激活细胞分选将杂交瘤细胞分离成不同线粒体膜电位(MMP)的亚群,线粒体膜电位的高低通过Rh123染色后的荧光值来衡量,低亚群的荧光值与染色的野生型未分选细胞相似,而高亚群的荧光值则都高于未分选的野生型。将它们置于两种凋亡诱导剂鱼藤酮和星形孢菌素作用下,发现了不同亚群对凋亡的抵抗力各不相同,高线粒体膜电位的细胞对凋亡有更强的抵抗力,即动物细胞群体在线粒体生理学方面存在异质性。后续可以利用这一特点将线粒体膜电位的高低作为分选标准,鉴定出性能更好的细胞。因此,他们又进行进一步的验证,利用线粒体膜电位将杂交瘤细胞分成不同的亚群后,对这些细胞进行补料分批培养,发现与接种低MMP 亚群的补料批次相比,接种高MMP 亚群的补料批次获得了更高的活细胞浓度和存活率,并能维持较长时间[97]。这些结果强调了杂交瘤细胞培养的异质性,并表明线粒体生理学是决定培养性能的关键参数。
代谢途径分析可以用于优化培养基的设计。前文中Zhang等优化了重组CHO-GS细胞的无血清培养基,由于添加了GS基因,使谷氨酸和NH4+合成谷氨酰胺从而减少了氨的生成,他们又从胞内水平考察了CHO-GS细胞在无血清培养基中代谢途径的变化。在无血清无谷氨酰胺的培养基中氨浓度为1.42 mmol/L时,细胞最高密度达到1.5×106cells/mL,氨浓度增加到12.65 mmol/L 时,细胞密度仍可以达到8.9×105cells/mL;但在含有谷氨酰胺培养基中,高浓度的氨浓度就会抑制细胞生长。随着氨浓度的增加,糖代谢途径中的己糖激酶、丙酮酸激酶和乳酸脱氢酶酶活增加,表明氨可以促进细胞的糖酵解过程。而在谷氨酰胺代谢途径中,高浓度的氨激活了谷丙转氨酶的活性,促进了α-酮戊二酸生成谷氨酸;另一方面,细胞内的异柠檬酸脱氢酶活性也有所增加[98],促进了α-酮戊二酸的生成。谷氨酸与氨反应生成谷氨酰胺,从而满足了细胞的生长需求[99]。
2.3 生物反应器中的流场环境
2.3.1 微载体技术的应用
微载体培养技术是一种动物细胞大规模培养技术。利用固体小颗粒为载体,贴壁细胞在载体表面附着,通过连续搅拌悬浮于培养液中进行生长繁殖[100]。与悬浮细胞相比,贴壁细胞对附着在固体基质上的要求大大增加了培养这些细胞类型的成本和难度。一些市售的固体基质比如DEAESephadex A-50有明显的毒性,细胞接种量损失大,以及悬浮培养时的搅拌导致培养细胞生长不良。因此,Daniel I.C.Wang课题组[101]开发了一种带正电荷的葡聚糖微球作为替代微载体,它不需要培养添加剂,用标准细胞培养液培养鸡胚成纤维细胞或正常二倍体人成纤维细胞,其饱和细胞浓度可达4×106cells/mL 以上,使用这种微载体可以显著提高生长效率。Smiley 等[102]在微载体上培养重组中国仓鼠卵巢(rCHO)细胞以生产IFN-γ,同时考察了血清浓度、基础培养基和pH 等环境参数对IFN-γ产量的影响,IFN-γ的生产在整个1个月期间保持不变,证实了使用微载体培养物通过哺乳动物细胞长期生产重组产物是技术上可实现的。
2.3.2 微载体浓度对细胞生长的影响
哺乳动物细胞在微载体上的培养受到微载体上细胞分布的影响。对于在微载体上培养哺乳动物细胞,启动培养时需要满足一定的接种量。随着接种量的降低,生长速率也会降低[103]。Daniel I.C.Wang课题组[104]提出了一个临界细胞数模型来解释接种量需求的机理。在该模型中,在给定的细胞浓度下,细胞的平均数目和单位体积的微载体数成反比,提供相同生长表面积所需要的微载体的数量取决于微载体的直径,因此可以通过选择不同的微载体直径来改善细胞在微载体上的分布。接种在微载体上的细胞需要达到临界的细胞数量才能正常生长,如果不能获得足够的细胞,将阻碍细胞生长。他们假设每一个微载体需要一个临界细胞数才能生长,如果接种后微载体上的初始细胞数大于临界细胞数,细胞就会生长,直到融合;另一方面,如果初始细胞数不大于临界细胞数,细胞将无法繁殖。通过这个模型确定每个微载体的临界细胞数,如FS-4 细胞的临界细胞数为每微载体6个细胞。之后他们采用一种更好的培养基支持细胞的低密度生长以减少临界数量。采用改进的培养基以及使用选定直径的微载体,FS-4 细胞的增殖提高了15~16 倍[104]。谭文松等[105]在低血清贴壁培养基和DMEM+10%FBS 两种培养基条件下,考察细胞接种密度对细胞生长的影响。在1~7 g/L微载体用量范围内接种相同密度的ST 细胞,发现随着微载体浓度的上升,最大细胞密度不升反降。主要是由于每个微载体接种细胞数目过少,培养基不能很好地支持ST 细胞在微载体表面良好的增殖和延伸。
2.3.3 流体剪切对细胞生长的影响
微载体上的动物细胞特别容易受到过度搅拌的损伤,虽然流体剪切力可能是有害的,但适度的流体剪切是可取的,因为它可以使细胞通透性增加和细胞胞外蛋白分泌增加。为了最大限度地促进细胞生长,实现充分的传质,同时减少或消除流体剪切的有害影响,第一个目标是识别和模拟一些微载体培养中的动力学效应,第二个目标是将这些效应与流体动力学进行定量关联。
一般来说,如果细胞的生长受到任何类型的流体动力学机制的影响,那么影响它生长的原因可能是一个基本流体动力学变量(如搅拌功率、流体黏度或微载体浓度)的改变。微载体浓度影响生物反应器的流体环境,在温和搅拌的情况下,细胞的生长不受微载体浓度或液体黏度的增加的影响,但在较高的搅拌水平下,微载体浓度对于细胞生长的影响很大。比如FS-4 细胞,在较低的接种浓度下生长速度最大,而接种浓度过高可能会导致细胞生长速率降低[106]。这种生长的减少主要是由两个原因导致:①流体剪切力过高导致的细胞死亡;②被流体剪切力杀死的细胞从微载体上被移除,这种移除是不可逆的,因为贴壁细胞悬浮培养不能存活,不能附着生长[107]。因此,过度搅拌主要导致了细胞死亡和细胞从微载体表面不可逆的移除。Daniel I.C.Wang 课题组认为较高的搅拌水平下,流体动力损伤既发生在涉及微载体-微载体相互作用中,它们彼此间的碰撞可能会发生细胞损伤,也发生在微载体-液体相互作用中,微载体上的细胞容易受到小而强烈的涡流的损伤,当湍流产生的涡流小于90~130 μm,会对细胞产生明显的损伤[108]。因此,他们进行了黏度影响的实验,通过在不同搅拌速度下添加右旋糖酐作为增稠剂,发现在大多数高搅拌条件下的微载体生物反应器中,黏度的增加会减少湍流引起的细胞死亡。黏度增加3倍通常会导致流体动力细胞死亡率降低10 倍以上,黏度的适度增加使得湍流中细胞死亡的显著减少[109]。谭文松等通过调整转瓶中转速改变涡流尺度的大小,发现当生物反应器中湍流产生的涡流尺度与细胞大小相当时,加入Pluronic F68 和血清不能对细胞起到保护作用,考虑到是搅拌产生的大量气泡造成了细胞损伤,他们采用鼓泡柱消除搅拌剪切的影响,并加入血清以及1 g/L 的Pluronic F68。通过这种方法改变了细胞在气泡表面的吸附特性,降低了细胞损伤[110]。
在动物细胞大规模培养中,生物反应器的操作参数改变会影响细胞的代谢过程。搅拌不仅可以使反应器内部流体充分混合,增加反应器内物质与能量交换,搅拌转速的改变也会导致剪切力的改变,从而影响细胞的生长与代谢。因此,通过对哺乳动物细胞大规模培养的流体动力学的了解,可以实现动物细胞培养放大工艺的开发以及生物反应器的设计和优化。
3 未来大规模细胞培养平台:从“多尺度”到“智能化”
细胞大规模生物反应过程中,细胞生命代谢过程是一个复杂的系统过程,尽管保持完全一致的操作条件,但最后的结果差异较大。其原因就是由于细胞代谢特性没有完全掌控,因此在工业生物制造过程中,需要对细胞生理代谢过程进行在线监测。生物制造过程中形成了大量的数据,包括在线过程数据、代谢组学数据、转录组学数据和蛋白质组学数据等。这些数据的大量积累为探究细胞的生理调控规律、实现生物过程的智能化提供了大数据的基础[111]。
3.1 基于多尺度参数相关分析的细胞培养过程优化与放大
在过去的20 年中,生物制造行业在过程控制方面有了很大的提高。主要在搅拌式生物反应器上采用计算机的在线控制,配置了pH 电极、溶氧电极、尾气质谱仪、活细胞传感仪等在线传感器,实现活细胞量、葡萄糖、乳酸、氨和谷氨酰胺等胞外代谢物的浓度等多种参数的采集。随着PAT 过程控制技术日益成熟,将在线传感器与细胞生理状态的系统模型相结合,并引入组学技术,通过建立过程数据处理方法,对数据进行分类和深入分析,可以实现数据驱动下引导过程控制并保证产品质量。张嗣良等[112]经过多年研究,提出了一套基于基因、细胞和反应器多尺度相关参数分析的理论。将生物反应器中复杂的生物过程分为基因尺度、细胞尺度与生物反应器尺度,不同尺度之间存在信息流、物质流和能量流。通过研究它们之间的非线性关系,以及对整个系统的影响,从而找出解决过程优化放大的方法。
参数相关分析是指生物过程中的环境参数和生理参数、状态参数和过程参数、直接参数和间接参数、在线参数和离线参数之间的耦合相关性[113]。实施多尺度参数相关分析包括几个重要步骤:
①进行系统简化,通过数据采集系统采集培养过程中的变量,之后进行数据驱动的研究,分析各个参数之间的关系并跨尺度观察[114]。这些步骤是实现细胞代谢分析与以控制为核心的多尺度研究方法。由此可见,进行生物过程的在线监测并获得大量在线参数是实现多尺度相关分析的重要步骤。然而,这些参数表现出离散、复杂、非线性等特征,主要是由于复杂的细胞代谢以及对环境的响应综合作用的结果。一些细微的差异伴随着生物过程的进行可能会在结果中产生巨大差异,表现出系统的不稳定性。为此必须将从宏观生理代谢(不同尺度参数之间的相关性)转向微观生理代谢(基因组、转录组、蛋白组、代谢组),才能更好地进行生物过程的优化与放大。化磊召等人基于昆虫细胞-杆状病毒载体表达系统,通过对昆虫Sf9 细胞的分批和补料悬浮培养,发现细胞代谢活性和活细胞传感器的在线特征频率(fc)之间存在相关性、培养体系S 期细胞比例与比电容增长率(μ)存在相关性,最高疫苗产量与在线检测参数电容之间存在相关性。相比于批培养,基于PAT 的优化工艺使疫苗单位体积产量提高76%,生产周期缩短了24 h,大大缩短了工艺优化周期,保证了生产工艺的可控性和重复性[77]。
②通过细胞生理代谢特性与生物反应器流场特性相关联进一步实现生物过程的优化与放大。生物过程的放大在于从实验室规模的生物反应器过渡到大规模的生物反应器中,并再现细胞最优的生理状态。因此,取得小规模反应器中关键参数的变化可以加强过程放大的成功率。在这个过程中需要对生物反应器的流场特性进行研究。龚迪等[115]首先在5 L 反应器中对犬肾上皮细胞系(MDCK)进行培养,通过计算细胞的比生长速率、葡萄糖比消耗速率、乳酸比合成速率和氨比合成速率确定细胞的生理代谢参数。随后将其放大至25 L 反应器,使活细胞密度从6×105cells/mL 增长到3.55×106cells/mL,并且保持细胞生理代谢参数一致,成功实现了生物过程的放大。
3.2 大规模细胞培养过程智能制造
我国提出“中国制造2025”计划,以应对新一轮科技革命和产业变革,围绕创新驱动、智能转型、绿色发展等理念,拓展“智能+”的重大战略任务和重大政策举措[116]。生物制造也走向自动化、信息化和智能化发展,利用计算机网络人工智能技术结合智能制造装备,构建高效节能、质量可靠的智慧工厂,实现智能生产。
在动物细胞大规模培养中,活细胞的生物反应过程具有复杂的生理代谢特性,因此对生物反应器中细胞培养过程实行多尺度相关参数分析至关重要。然而,该理论在大数据时代的应用仍存在一些局限性。在实际生产过程中,对于细胞多尺度参数分析时产生的海量数据以及反应过程中获得各种传感器数据处理起来极为困难,在这些数据中寻找出关键的因果关系,并提出相应的过程优化策略,对于人工处理来说是一项费时、费力的工作。因此,需要将机器学习应用于生物过程大数据的分析与决策[113]。Li 等通过四元隔膜泵、计算机、可编程逻辑控制器(PLC),耦联在线传感器,对疫苗产品纯化色谱中pH 值和电导率实现自动化精准控制[117]。Esmonde 等利用拉曼光谱耦联非线性模型预测控制器(NMPC),对CHO细胞培养过程中葡萄糖浓度等营养物质参数进行实时监控与预测[83],未来可以从实验研究向GMP生产应用上发展。
面对动物细胞系的规模化、多样化培养,可以通过开发各种新型动物细胞反应器,制定个性化、并行化的培养策略,实现培养过程的智能化控制。生物反应器耦联在线传感器,尤其是光谱传感器,如在线拉曼分析仪、在线中红外分析仪、在线荧光分析仪等正在逐渐被应用于工业过程分析[118]。在实施多尺度生物过程优化中通过在线拉曼光谱、在线荧光光谱以及在线中红外光谱会产生大量数据,尤其是在线数据中含有大量的过程相关信息,未来可以利用文献数据、组学数据形成知识图谱,并通过机器深度学习,指导细胞培养过程(图4)。2018 年“全自动干细胞诱导培养设备”研制成功,首次实现了以机器学习以及人工智能算法为判定的细胞自动化诱导,建立了从细胞培养、显微在线观测、移液换液、算法识别、克隆挑取以及设备控制的装备技术,实现了诱导多功能干细胞自动化诱导培养、扩增、成像、下游分化等功能,在降低干细胞生产成本的同时提高了细胞制备质量,为大规模生物制品的生产奠定了基础[17]。
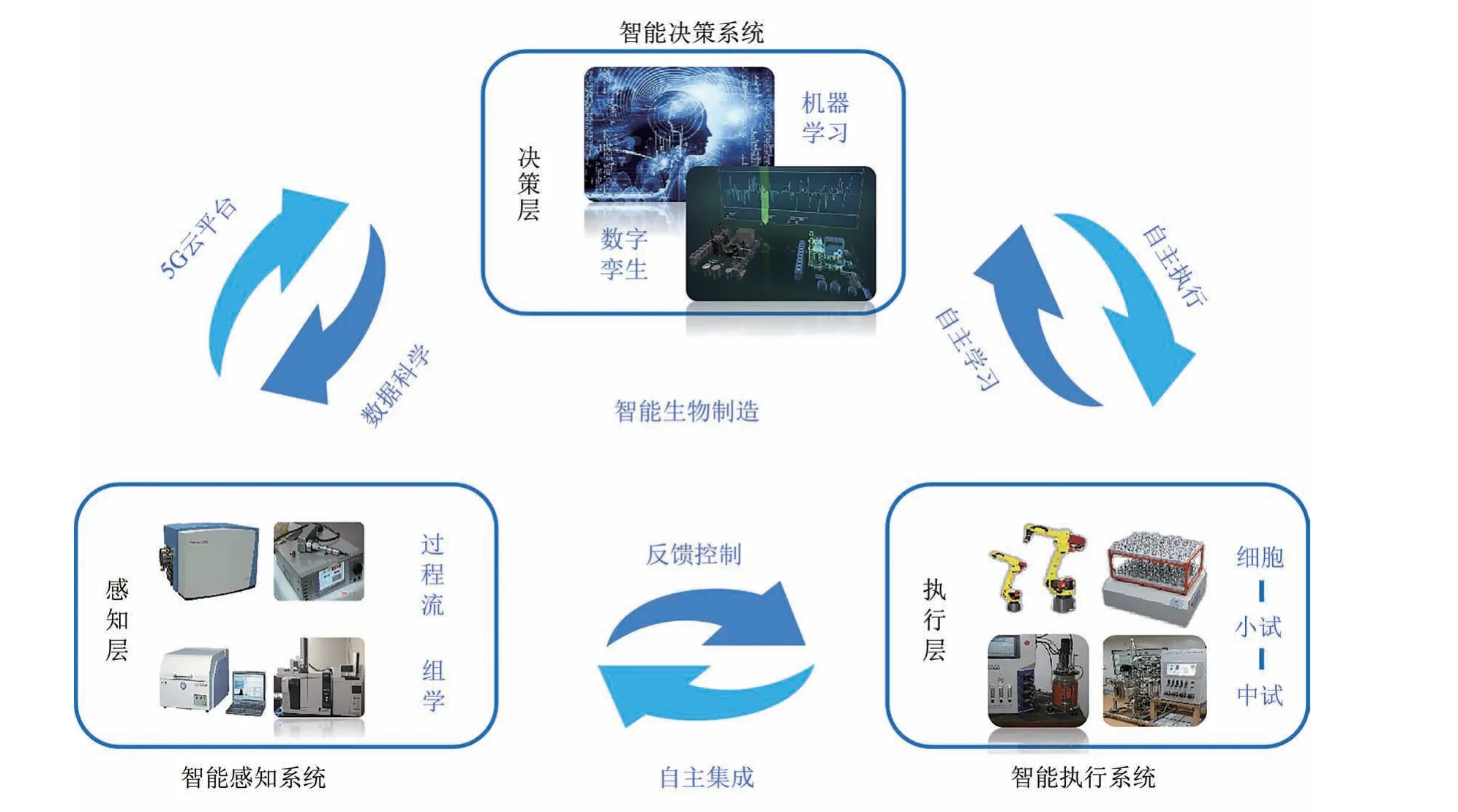
图4 基于大数据的工业生物过程智能制造系统(通过智能感知系统挖掘大数据,实现对生物培养过程的智能控制,同时利用文献数据、组学数据形成知识图谱并通过机器深度学习,进而指导智能感知系统,实现真正的智能生物制造)Fig.4 Intelligent manufacturing systems developed based on big data for industrial processes(Mining big data through the intelligent perception system to realize the intelligent control of the biological training process.On the other hand,using literature and omics data to form a knowledge map for machine deep learning,the intelligent perception system can guide to realize the real intelligent biological manufacturing)
大数据时代已经到来,基于大数据的智能生物制造是顺应生物制造行业发展的趋势所向,随着生物传感技术的不断发展,可以获得越来越多的生物过程数据。通过人工智能的处理从数据中挖掘出不同尺度信息流之间的关系,从而实现真正的智能生物制造。
4 总结与展望
如今,动物大规模培养技术已经达到相当的规模和技术水平。本文详细综述了哺乳动物细胞在细胞株的构建、培养基设计与无血清培养基的开发、基于PAT培养工艺的优化与放大等方面的研究进展。而为了更好地满足生物制药产业发展的需求,动物细胞培养需要向大规模、自动化、低成本、高目的产物质量与产量发展。因此,哺乳动物细胞大规模培养仍有许多不足之处需要改进和完善。
随着基因组学的最新进展和基因编辑工具的发展,可以构建支持高密度生长,分泌大量治疗性蛋白的优良细胞系。细胞系含有放大的目的基因或选择性标记,能够保持对特定治疗性蛋白的表达。其次,动物细胞培养基的设计已经得到了越来越深入的研究,尤其是无血清培养基的开发。通过对细胞生长与代谢等方面机理的深入,以及代谢组学和蛋白质组学技术的成熟,可以为细胞无血清培养基的设计提供便捷的方法,实现低成本和更广泛的应用。最后,哺乳动物细胞培养过程中最重要的是通过连续的生产以提高产品产量和质量,在这个过程中系统监测生物过程中的实际需求,特别是确定最关键的质量参数至关重要。未来开发非侵入性的、实时监测的分析技术以及适用于不同生产系统中标准工艺的在线传感设备,促进PAT技术与连续制造过程的同步成熟,可以更好地符合生物制药过程的发展和需求。基于PAT的细胞培养过程中产生海量的在线数据,通过大数据实时计算系统,运用复杂的机器学习、数据挖掘、智能推荐等在计算机和细胞之间实时数据交互,掀起一场“智能生物制造”的生物技术革命。顺应大数据时代发展的需求,占领科技竞争高峰,努力提升我国工业生物过程自动化、数字化和智能化水平。
