白藜芦醇保护三氧化二砷的心脏毒性研究进展
2021-09-27吴梦婷张文君张国锋陈泳霖
吴梦婷,张文君*,张国锋,杨 硕,陈泳霖
(1.哈尔滨商业大学药学院,黑龙江 哈尔滨150076; 2.黑龙江生物科技职业学院,黑龙江 哈尔滨 150025)
三氧化二砷(arsenic trioxide,As2O3,ATO),俗称砒霜,是一种古老的毒物也是一味传统的中药。自上世纪70年代中国科学家首次发现ATO 具有治疗急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)的作用以来,三氧化二砷以其对癌症和白血病较高的治愈率,颇受医药研究者的关注[1]。但因其治疗过程中产生严重的心脏毒性而限制了应用。白藜芦醇(resveratrol,Res)分子式C14H12O3,是一种天然含有芪类结构的非黄酮类多酚化合物,主要来源于中药材虎杖中,也广泛存在于葡萄、桑葚、花生等植物中[2]。除抗氧化、抗糖尿病、抗肿瘤等药理作用外,Res还被认为是一种潜在的心脏毒性保护药物[3]。有研究表明,Res 在降低ATO 治疗时产生的心脏毒性方面具有一定的潜力[4]。本文介绍了关于ATO 的药理作用和导致心脏毒性的机制、Res 在治疗心血管疾病方面的作用机制,并对近年来二者的联合应用进行了综述,以期为后续的临床研究提供借鉴。
1 ATO 药理作用
ATO 在胃癌、肺癌、乳腺癌等多种恶性肿瘤中均发现具有一定的治疗作用,在治疗APL 方面效果较好[5]。研究发现ATO 可通过抑制不同的细胞时期肿瘤细胞增殖,下调肿瘤细胞端粒酶的活性改变细胞周期蛋白和凋亡蛋白的表达诱导肿瘤细胞的凋亡,调控多种肿瘤基因,抑制肿瘤细胞侵袭转移等机制治疗多种肿瘤疾病。此外,ATO 可通过诱导肿瘤细胞产生活性氧物质(reactive oxygen species,ROS),下调血管内皮生长因子(vascular endothelial growth factor,VEGF)表达抑制肿瘤细胞的生长和转移,同时,ATO 活化Caspase 并下调线粒体膜电位诱导肿瘤细胞凋亡[6⁃9]。
APL 发病机制主要由于早幼粒细胞白血病蛋白(promyelocytic leukemia protein,PML)基因和维甲酸受体α基因(retinoic acid receptor alpha gene,RARα)异位、断裂、互换产生PML⁃RARα 融合基因抑制转录使髓系细胞异常分化且停留在早幼粒细胞阶段[10]。ATO 可与PML 基因上“锌指结构”中的半胱氨酸残基结合,使融合基因寡聚化,再通过泛素⁃蛋白酶体途径(UPP)促进融合蛋白SUMO 化修饰并降解。PML⁃RARα 的降解解除了早幼粒细胞的分化阻滞,最终导致APL 细胞的凋亡[11]。
2 ATO 诱导心脏毒性机制
ATO 在治疗期间发现可致患者多种脏器损伤,其中以心脏毒性尤为严重[12],主要包括(亚)急性心脏毒性和慢性心脏毒性两种,前者包括改变心室复极期、QT 持续时间延长、心律不齐、急性心力衰竭、心肌炎⁃心包炎样综合征等症状;后者主要为无症状的左心室功能障碍、收缩或舒张功能障碍、扩张型心肌病,严重者甚至发生心源性猝死[13⁃14]。目前,ATO 可能诱导心脏毒性的机制诸多,主要包括氧化应激损伤、细胞内Ca2+稳态的破坏和干扰多条信号通路等[15⁃16]。
2.1 氧化应激反应 心肌细胞在正常生理条件下会产生非常低浓度的ROS,并通过正常细胞清除机制排出。随着浓度增加,ROS 不再通过细胞清除机制排出而经链式反应扩散,使细胞中ROS 浓度过高导致氧化应激反应。在ATO 治疗期间过度生成的ROS 会破坏心脏细胞内源性抗氧化系统,并导致DNA 损伤[17]。ROS 包括多种(非)自由基如超氧基、羟基自由基和过氧化氢,会破坏DNA、脂质、蛋白质等细胞成分并最终导致细胞凋亡[18]。Hemmati 等[19]在探究鞣花酸预防三氧化二砷对大鼠的心脏毒性时,经实验发现给予ATO 48 h 后,与对照组相比,用ATO 处理的大鼠心脏组织匀浆中的谷胱甘肽(glutathione,GSH)水平无性变化,但使用比色法确定心脏组织匀浆中的谷胱甘肽过氧化物酶(GPx)水平时发现,GPx 水平增加。由此可说明ATO 可以造成心肌细胞氧化应激反应引发心脏毒性。
2.2 Ca2+稳态的破坏 细胞内Ca2+的积累是ATO 治疗时产生ROS 的主要原因之一,ATO 会增加心脏Ca2+电流,改变心脏动作电位的平稳期[20]。细胞内Ca2+浓度增加的机制之一是人钙调素依赖蛋白激酶(CaMKII)的活性增强,SERCA 蛋白是心肌肌浆网Ca2+⁃ATP 酶,可调节心肌细胞钙稳态。ATO 增强CaMKII 活性,致使SERCA 蛋白功能受损;同时,CaMKII 通过激活L 型Ca2+通道来增加Ca2+向细胞质的迁移,激活caspase⁃2 并诱导心肌细胞凋亡。此外,细胞质Ca2+的增加会改变线粒体通透性,从而将细胞色素C 释放到溶质 中引起心肌细 胞凋亡[21]。Zhang 等[22]围绕ATO 对成年大鼠心室肌细胞心脏收缩的作用及其对Ca2+瞬变的影响进行探究,与对照组相比,ATO 增加了静息Ca2+比率,增加了肌节缩短的幅度、最大驰豫速度和缩短速度,并降低了Ca2+瞬变衰减率(该值代表Ca2+通过SECRA 从细胞质中去除的速度),即ATO 抑制了SECRA 的活性。此外ATO 同时上调CaMKII 表达,并激活内质网(ER)应激反应,最终诱发剂量依赖性和时间依赖性的异常心肌细胞收缩,引起心肌损伤。Chen 等[23]在探究ATO 诱导大鼠QT 延长的原因时发现,与对照组相比,全细胞膜片钳记录的动作电位持续时间(APD)和离子电流数据显示,经ATO 处理后的L 型ICa2+上调,稳态活化曲线更趋于负电位,同时,内向整流IK1 下调并由负电位向正电位转移;ATO 组心电图显示QT 显着延长约36.4%,APD、APD50 和APD90 分别延长近74.4%、41.8%、74.8%;由此说明,Ca2+的积累以及L 型ICa2+、内向整流IK1 的改变可能是导致QT 和APD 延长的原因之一。
2.3 干扰信号通路 砷化物作用时产生的ROS 与NO 结合形成过氧化氢亚硝酸盐,上调有关炎症因子如NF⁃κB、白介素6(IL⁃6)等诱发动脉粥样硬化。此外亚砷酸盐会降低内皮型一氧化氮合酶(eNOS)和蛋白激酶B(AKT)的活性,从而降低NO 的生物利用度,诱发血管内皮功能障碍和心血管并发症[24]。众所周知,hERG 基因编码K+通道的α 亚基,当阻滞hERG 基因表达时,心脏APD 延长并最终导致QT 延长。研究表明,使用ATO 会阻碍hEGR 功能并导致miR⁃21 表达增加;此外,NF⁃κB 也在炎症过程中破坏hEGR 功能进而增加miR⁃21 的表达,二者均可因miR⁃21 表达增加最终引起心脏毒性,但也可由此考虑通过维持NF⁃κB 途径抑制心脏毒性[25]。另有研究发现,在ATO 治疗的豚鼠体内施用转化生长因子(TGF⁃b)信号传导拮抗剂后很大程度上抑制了间质纤维化和QT 间期延长,并消除了ATO 治疗的豚鼠中TGF⁃b1、hERG 的异常表达,由此说明调节TGF⁃b 信号传导也可能是治疗ATO 诱导的QT 间期延长的手段之一[26]。
3 Res 抗心血管疾病的作用机制
Res 抗心血管疾病的作用的最早发现源于法国悖论现象的启发,红葡萄酒中的Res 具有抗氧化作用,可抑制低密度脂蛋白的氧化[27⁃28]。研究发现,Res 主要通过调节各种信号通路如AMPK 通路、SIRT1 通路、Nrf2 通路、NF⁃κB通路来增强内源性抗氧剂系统中的抗氧化酶如血红素加氧酶1(heme oxygenase⁃1,HO⁃1)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)和超氧化物歧化酶(superoxide dismutase,SOD)的表达,发挥抗氧化应激损伤、抗血小板聚集、调节脂质代谢等药理活性,从而实现抗心肌细胞凋亡保护心脏的作用[29⁃30],见图1。
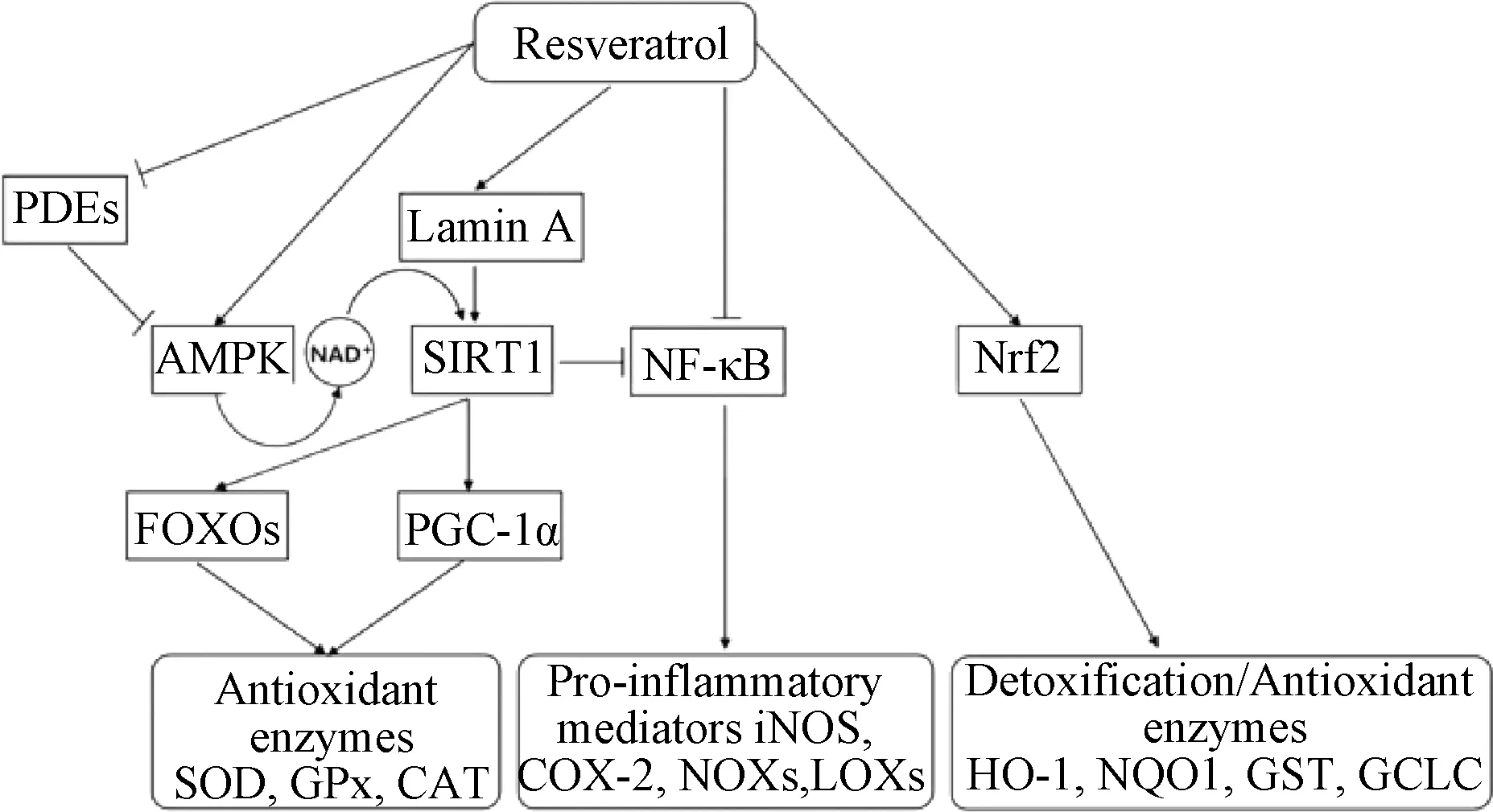
图1 白藜芦醇通过调节信号通路的抗氧化机制
首先,Res 可直接抑制环磷酸二酯酶,增加环腺苷酸水平,也可刺激AMPK 介导的磷酸核糖转移酶表达,增加SIRT1 辅基的辅基NAD+水平从而增加SIRT1 活性;其次,Res 作为一种抗氧化剂,可通过上调细胞防御基因的表达或直接清除多种ROS / RNS 保护细胞,也可通过Nrf2/ARE和SIRT1 通路促进内皮细胞产生eNOS 抑制细胞生成ROS;此外,Res 可在AMPK 通路中抑制p38 MAPK 活化的同时直接阻断NF⁃κB 信号通路共同发挥抗炎的作用,避免因炎症反应造成的心血管损伤[31⁃32]。Ma 等[33]研究发现,Res抑制了小鼠单核细胞巨噬细胞白血病细胞(RAW264.7)中NO 的产生和IL⁃6 的分泌,同时还能抑制IκBα 的磷酸化和NF⁃κB 从细胞质到细胞核的转运,最终发挥抗炎作用。Guo 等[34]将新生大鼠心肌细胞分别于无葡萄糖、含有或不含Res 的30 mmol/L 高葡萄糖环境中培养,并用荧光探针DHE 估计心肌细胞内ROS 的细胞内水平,与空白组相比,暴露于高葡萄糖的心肌细胞中红色荧光的强度显着增强且强于对照组,说明Res 可抑制细胞内ROS 的产生进而保护心肌细胞。
4 Res 与ATO 的联合应用
近几十年来,ATO 被认为是急性早幼粒细胞白血病治疗的突破,尽管ATO 在治疗APL、ANPL、抗肿瘤方面有一定的治疗效果,但其诱发的心脏毒性始终是亟待解决的问题。有临床数据显示,半数使用ATO 的患者出现QT 间期延长的不良反应,部分患者出现尖端扭转型心动过速症状[35]。近年来,科学家发现Res 与ATO 联合使用时可通过促进细胞凋亡来增强ATO 的抗肿瘤效果,同时,还可以通过维持GSH 的还原态抑制自由基的形成等途径在一定程度上抑制正常细胞凋亡,进而减轻ATO 所产生的心脏毒性[36]。
4.1 Res 增强ATO 抗肿瘤效果 Res 对多种肿瘤细胞具有的抑制活性且具有杀伤作用,可对肿瘤的起始、促进、发展3 个阶段均有抑制作用,可作为天然的化学防癌剂[37]。目前有研究发现,Res 可通过促进肿瘤细胞凋亡作用协同ATO 抗肿瘤。Edward 等[38]将由BCR⁃ABL 表达的白血病细胞系K562、KT1 和急性髓性白血病细胞系U937 暴露于ATO 中,同时加入不同浓度的Res。结果发现且抗白血病的效果与Res 的浓度呈正比,Res 与ATO 的组合产生比单独使用二者均有更佳的作用效果。通过蛋白染色结果发现,ATO 通过诱导细胞凋亡机制可治疗白血病,当ATO 与Res联合使用时会增强诱导细胞凋亡的作用。Gu 等[39]在探究Res 和ATO 对人肺癌细胞A549 作用效果时发现,单独使用Res 时,随着其浓度的增加,A549 细胞的存活率逐渐下降;Res 与ATO 联合使用组较单独使用ATO 组的A549 细胞凋亡百分比增加、GSH 含量降低、ROS 含量增加以及线粒体膜电位下降;此外,经谷胱甘肽合成酶抑制剂BSO 处理后,二者联合使用所诱导的A549 细胞凋亡百分比由30%增至77%,且A549 细胞内GSH 含量降低而ROS 含量升高,由此认为Res 与ATO 联合使用,可降低A549 细胞内GSH 含量从而产生ROS,最终导致线粒体膜电位下降以及Cas⁃3 活化,诱导A549 细胞凋亡。
4.2 Res 降低ATO 引起的心脏毒性
4.2.1 Res 对正常细胞凋亡的抑制作用 和绝大多数抗肿瘤药物类似,ATO 治疗癌症的不良反应之一是导致正常细胞凋亡,其诱导细胞凋亡的途径主要包括DNA 的破坏、活性氧的产生、心肌离子通道的改变。NO 在增加心肌细胞的存活中起着至关重要的作用。还显示出NO 可以通过维持线粒体膜并调节功能来防止ROS 的产生和心肌细胞凋亡[40]。Res 可以通过对抗细胞中的氧化损伤来减轻ATO 诱导的心脏毒性,同时,其也通过抑制ATO 诱导的细胞凋亡来保护正常细胞免于细胞死亡。研究发现,对野生型小鼠灌注Res 后,心肌梗塞有所改善、缺血后心室功能改善以及心肌细胞凋亡减少;对iNOS基因敲除小鼠灌注Res 后,心脏中缺血性心室功能未到改善,心肌梗死面积和心肌细胞凋亡也未产生减小和降低;而对使用iNOS 抑制剂的野生型小鼠灌注Res 后,Res 保护心肌细胞的作用被抑制;由此说明,Res 的心脏保护作用与其能上调NO 的能力有关[41]。Chen 等[42]给予人支气管上皮细胞Res 24 h 后,因ATO 所产生的ROS 水平降低,并且对脂质过氧化反应、染色体及DNA 损伤、细胞凋亡等有所抑制。此外,Res 降低了含半胱氨酸的天冬氨酸蛋白水解酶caspase⁃8、caspase⁃9、caspase⁃3 的活性,抑制了ATO 引起的caspase⁃3 过表达,同时其可维持肺细胞中的GSH 平衡,最终实现抑制死亡受体(death receptor)和线粒体凋亡。
4.2.2 维持Nrf2⁃HO⁃1 途径的平衡 据报道,Nrf2 可以通过上调细胞保护因子即NADPH 来激活氧化还原酶1(NQO1)、HO⁃1 以及GSH 和CAT 来抑制细胞氧化[43]。早期已有研究发现Res 可通过维持Nrf2⁃HO⁃1 途径的平衡表达,促进细胞中的砷流出,从而改善ATO 治疗APL 时产生的心脏毒性[44]。Mondal 等[45]在乳腺上皮MCF10 A 细胞的研究中发现Res 在改善ATO 诱导的细胞毒性的同时,可与ATO 共同作用诱导表达信号蛋白Nrf2,从而进一步诱导NQO1 辅酶的表达,增强治疗效果。另有实验发现[46],与单独使用ATO 相比,Res 与ATO 联合使用可以通过维持Nrf2⁃HO⁃1 途径平衡而维持还原型谷胱甘肽与氧化型谷胱甘肽(GSH⁃GSSG)的比例以及Nrf2 与HO⁃1 的mRNA 表达,使得由于因ATO 治疗作用而释放的ROS 降低,同时Res 促进了心肌细胞中ATO 的外排,最终缓解了心肌细胞的损伤。
4.2.3 Res 对QT 间期延长的抑制作用 研究[47]表明,在小鼠模型中Res 缓解了由于给予ATO 造成的小鼠血浆中乳酸脱氢酶活性增加、SOD 和GPx 活性降低,以及ROS 水平和Ca2+通道异常等现象,最终抑制了ATO 诱导的QT 间期延长,增加了心肌细胞活力并抑制了细胞凋亡。为测试Res 是否可以减轻ATO 诱导的Ca2+电流增加,Yan 等[48]通过共聚焦激光扫描显微镜测量新生大鼠心室肌细胞(NRVMs)内的Ca2+电流,结果显示,经ATO 处理的心室心肌细胞Ca2+电流增加了95.46%,高于对照组,在Res 与ATO 联合使用后,降低了ATO 诱导的Ca2+累积,进而缩短了QT 间期。Hsp70 和Hsp90 是hERG 生化成熟所必需的蛋白,ATO 可抑制hERG 通路而降低hERG 电流[49]。研究发现[50],Res 缩短了ATO 引起的豚鼠心室肌细胞的动作电位持续时间,正常对照组豚鼠心室肌细胞APD 为429.1±26.5 ms,ATO 组豚鼠心室肌细胞APD 延长至(948.3±63.7)ms,ATO 与Res联用组相比ATO 组缩短APD 至(522.6±26.3)ms,此外,单独使用Res 对Hsp70 / Hsp90 蛋白几乎无作用,但与ATO联用时可下调ATO 引起的Hsp70 和Hsp90 过表达,使心室肌细胞的动作电位持续时间降低,减轻了ATO 引起的心脏毒性。
5 展望
ATO 在治疗急性早幼粒细胞白血病有良好的治疗效果,并在胃癌、肺癌等恶性肿瘤方面有一定的治疗作用。尽管ATO 有巨大的发展潜力,但由于严重的心脏毒性,限制其广泛应用。近年来,Res 以其良好的抗炎、抗氧化、抗血小板聚集等诸多药理活性在心脑血管疾病和抗肿瘤方面被广泛关注,Res 不仅可通过抗氧化、抗血小板聚集、维持Nrf2⁃HO⁃1 途径的平衡、缩短QT 间期以及促进细胞内的砷外排等途径保护由ATO 诱发的心肌细胞毒性;同时,二者的联合使用增强了抗肿瘤的作用效果,其作用机制可能由于Res 可抑制正常细胞凋亡的同时通过改变线粒体膜电位协同ATO 诱导肿瘤细胞凋亡,但具体的作用机制尚不明确,仍需在今后更深入的研究中发现。相信随着研究的不断深化,Res 与ATO 的联合使用应用于临床指日可待。
