知母皂苷B⁃Ⅱ抑制秀丽隐杆线虫Aβ 蛋白毒性作用及机制研究
2021-09-27宗茹敏王雅丽黄郑良超徐国兵吴德玲
宗茹敏王雅丽黄 琪 郑良超徐国兵吴德玲*
(1.安徽中医药大学药学院,安徽 合肥230012; 2.中药饮片制造新技术安徽省重点实验室,安徽 合肥230012; 3.安徽省食品药品检验研究院,安徽 合肥 230012)
阿尔茨海默病(Alzheimer disease,AD)是一种神经系统退行性疾病,表现为渐进性记忆减退、认知功能障碍,Aβ 的沉淀和聚集所形成的老年斑是AD 较明确 的致病因子。知母皂苷B⁃Ⅱ(timosaponin B⁃Ⅱ,TSB⁃Ⅱ)为百合科植物知母Anemarrhena asphodeloidesBge.的主要成分与活性物质,可改善痴呆大鼠的学习记忆能力[1⁃2],发挥抗痴呆作用。
秀丽隐杆线虫Caenorhabditis elegans属于线性动物门,具有生存周期短、易于培养操作等特点,已完成全基因组测序,约40%的基因与人类同源,而且神经细胞发达,有利于其用于神经方面的疾病研究。CL4176 线虫在肌肉细胞中表达人类β⁃淀粉样蛋白1⁃42(Aβ1⁃42),升高温度可诱导Aβ1⁃42表达量增加,导致线虫瘫痪,可通过线虫瘫痪表型变化判断药物的有效性[3]。daf⁃16 mRNA 是与寿命胰岛素daf⁃16/FOXO 信号通路相关基因,对线虫寿命的延长起正向调节作用;sod⁃3 作为daf⁃16 的靶基因,可通过催化O2⁃的去除来保护机体免受氧化应激;skn⁃1 mRNA 表达也能在一定程度上延缓氧化损伤;hsp⁃16.2 作为一种经Aβ 诱导产生的低分子量多肽,可减轻毒性蛋白质累计造成的损伤,其过度表达抑制瘫痪表型的作用也已被证明。目前,关于TSB⁃Ⅱ抑制转基因秀丽隐杆线虫体内Aβ 聚集作用及机制鲜有报道,故本实验以秀丽隐杆线虫CL4176 为模型,通过线虫瘫痪、寿命、体内活性氧水平、氧化应激、热应激等实验探讨TSB⁃Ⅱ抑制Aβ 蛋白毒性作用及可能的机制,以期为AD 治疗提供理论基础。
1 材料
野生型秀丽隐杆线虫N2、转基因秀丽隐杆线虫CL4176 {dvIs27 [pAF29(myo⁃3/A⁃Beta 1⁃42/Iet UTR)+pAF4(rol⁃6(su1006)]}购于美国线虫基因中心(CGC);大肠杆菌(Escherichia coliOP50 株)受赠于中国科技大学生命科学院光寿红教授。TSB⁃Ⅱ对照品(成都曼思特生物科技有限公司,批号100420,纯度>98%)。Aβ1⁃42(上海信裕生物工程有限公司,批号XY⁃E11405);ECL 化学发光检测试剂盒、BCA 试剂盒(上海碧云天生物技术有限公司,批号P0018AS、批号P0012S);细胞蛋白裂解液(福州飞净生物科技有限公司,批号PH0406);Trizol(美国Life Technogies 公司,批号15596018);DEPC⁃H2O(上海捷瑞生物工程有限公司,批号D1007);Novostart SYBR qPCR SuperMix Plus(美 国 Anovoprotein 公 司,批 号E096⁃01);RevertAidTM firsStrand cDNASynthesis Kit(批 号K1622)、荧光定量PCR 仪(型号PIKOREAL 96)(美国Thermo Scientific 公司;体式显微镜(宁波舜宇仪器有限公司,型号Motic K⁃400C);荧光酶标仪[美谷分子仪器(上海)有限公司,型号SpectraMax M4];普通PCR 仪(杭州晶格科学仪器有限公司,型号K960);引物合成由生工生物工程(上海)股份有限公司进行。
2 方法
2.1 NGM 固体培养基(线虫生长培养基)与M9溶液的制备及线虫同步化 参考文献[4⁃5] 报道的方法制备NGM 固体培养基与M9 溶液,对配置好的NGM 培养基进行铺板,凝固后倒置,在4 ℃冰箱中保存。对线虫进行同步化培养,然后将其转移至NGM 培养皿中,于20 ℃培养箱中恒温培养。
2.2 TSB⁃Ⅱ溶液制备 取适量TSB⁃Ⅱ,超纯水溶解成960 μg/mL 母液,除菌滤头过滤后加入大肠杆菌OP50 配置成质量浓度为640、160、40、10、2.5、0.625 μg/mL 的溶液,各取300 μL 铺在NGM 板中,每个质量浓度铺3 块板。
2.3 瘫痪实验 用M9 缓冲液将产卵期CL4176 线虫洗至离心管进行离心处理,弃去上清液,重复3次后加入与M9 等体积的裂解液,待线虫全部裂解后离心,弃去上清液,将虫卵铺在新的NGM 板中,于16 ℃下培养至孵化成蠕虫后,转移至TSB⁃Ⅱ的各给药浓度组,升温至25 ℃诱导Aβ1⁃42基因表达和线虫瘫痪。用挑针轻触线虫,线虫保持头动而身体不动,则判定为瘫痪[6]。
2.4 寿命实验 产卵期CL4176 线虫同步化后,将虫卵铺于NGM 板中16 ℃孵化12 h 后转移至TSB⁃Ⅱ的3 个最佳给药浓度组(TSB⁃Ⅱ⁃40、TSB⁃Ⅱ⁃10、TSB⁃Ⅱ⁃2.5)及空白组培养,每个浓度平行3 块板,每3 d 记录线虫存活情况,直至全部死亡为止,对其寿命做生长曲线,考察TSB⁃Ⅱ对转基因线虫是否有毒性作用[7]。用挑针轻触线虫头部和尾部,若30 s 内均无反应,则判定为死亡。
2.5 活性氧(ROS)检测 产卵期CL4176 线虫同步化后,将虫卵铺在NGM 板上孵化,转移至TSB⁃Ⅱ的3 个最佳给药浓度组(TSB⁃Ⅱ⁃40、TSB⁃Ⅱ⁃10、TSB⁃Ⅱ⁃2.5)及空白组,于16 ℃培养36 h,升温给药板至25 ℃培养36 h,将线虫于EP 管中用PBS 冲洗3 次后,在含H2DCF⁃DA 的PBS⁃T 中孵育3 h,每10 min 涡旋1 次,荧光酶标仪于温度37 ℃、激发光波长485 nm、发射光波长530 nm 下测定荧光强度[8],平行3 次。
2.6 Aβ 体外沉积实验 将适量Aβ1⁃42用六氟异丙醇(HFIP)冰浴超声10 min,溶解成质量浓度为1 mg/mL,吹去HFIP,将管内壁透明的肽层溶于DMSO 中,PBS 稀释成浓度为0.025 mmol/L 的溶液。取Aβ 淀粉样蛋白10 μL、不同浓度TSB⁃Ⅱ组20 μL,加到96 孔板中混合均匀后,于37 ℃下避光孵育,加入用0.1 mol/L 甘氨酸缓冲液200 μL(pH=8.9)配制的0.01 mmol/L 的ThT 混匀显色,采用荧光酶标仪,在激发光波长450 nm、发射光波长485 nm 下测量荧光强度[9],平行3 次。
2.7 氧化应激实验 挑取处于产卵期的N2 线虫,在NGM 平板上产卵3 h。将孵出的蠕虫转移到空白组与不同浓度TSB⁃Ⅱ组,在20 ℃下培养至3 d后,转移至含有胡桃醌(0.2 mmol/L)的NGM 板上,每隔1 h 观察蠕虫存活情况1 次,直至线虫全部死亡[10⁃11],平行3 次。
2.8 热应激实验 挑取处于产卵期的N2 线虫,在NGM 平板上产卵3 h。将产下的卵孵出的蠕虫转移到空白组与不同浓度TSB⁃Ⅱ组板上,在20 ℃培养箱中培养3 d 后升温至35 ℃,每隔1 h 观察线虫存活情况1 次,直至线虫全部死亡[12],平行3 次。
2.9 TSB⁃Ⅱ对过氧化氢酶的影响 线虫同步化后虫卵加到NGM 板上,置于16 ℃恒温培养箱中孵化12 h,将蠕虫转移至空白组与不同浓度TSB⁃Ⅱ组板上,置于16 ℃恒温培养箱中孵化24 h 后升温至25℃孵化36 h,以诱导Aβ 基因表达。M9 缓冲液收集各组线虫于EP 管内,蛋白裂解液(1 mmol/L PMSF)冰浴超声提取线虫体内总蛋白,BCA 法对蛋白进行定量分析,按照试剂盒操作步骤进行显色,最后通过紫外酶标仪检测,计算相应数值,平行3 次。
2.10 β 淀粉样蛋白寡聚体的点印记分析 对线虫体内各给药组总蛋白进行定量分析后,计算不同浓度组蛋白含量,再确定不同浓度给药组蛋白印迹分析时的上样量,蛋白定量点样在0.22 μm NC 膜上,自然挥干后在室温下用TBST 配置的5%脱脂奶粉封闭1 h,1×TBST 于摇床上洗3 次,每次5 min,4 ℃下与一抗A11 孵育摇床振摇过夜,1×TBST 于摇床上洗3 次,将膜与过氧化物酶偶联的二抗摇床振摇孵育1 h,1×TBST 于摇床上洗3 次,膜加入显影液后放入凝胶成像仪中避光显色并拍照,曝光时间根据膜曝光程度调整至最佳状态,通过凝胶图像处理系统分析光密度值。
2.11 实时荧光定量 重复“2.10”项下步骤诱导Aβ 基因表达,加M9 缓冲液冲洗2~3 次后离心,吸取上层缓冲液,虫体放入-80 ℃冰箱中冻存数小时后,采用Trizol 法提取线虫总RNA,取3 μg至EP 管中,按照试剂盒说明书使其进行逆转录反应,得到cDNA,于-80 ℃下保存备用。引物序列见表1。

表1 引物序列Tab.1 Primer sequences
2.12 统计学分析 分析方法为 Relative Quantification Study,计算方法为2-△△Ct。通 过GraphPad Prism 6.01 软件进行处理,Image J 软件分析荧光强度,重复3 次,取平均值。
3 结果
3.1 TSB⁃Ⅱ对线虫瘫痪、寿命、活性氧、氧化应激、热应激等实验的影响 如图1a 所示,相比空白组,不同浓度TSB⁃Ⅱ组均有一定的抗线虫瘫痪作用(P<0.05),其中TSB⁃Ⅱ⁃40 组效果最佳,后期选取TSB⁃Ⅱ⁃40、TSB⁃Ⅱ⁃10、TSB⁃Ⅱ⁃2.5 组作进一步考察。如图1b 所示,不同浓度TSB⁃Ⅱ组在一定程度上也可延长线虫寿命(P<0.05)。如图1c所示,模型组线虫体内ROS 高于不同浓度TSB⁃Ⅱ组、空白组,表明诱导Aβ基因表达后出现AD 表观症状时,线虫体内ROS 水平相比空白组是增加的;不同浓度TSB⁃Ⅱ组相比模型组,均能在一定程度上降低线虫体内ROS 产生(P<0.01)。如图1d 所示,不同浓度TSB⁃Ⅱ组相比空白组,能延长线虫死亡时间,以TSB⁃Ⅱ⁃40 作用最好(P<0.05)。如图1e~1f 所示,相比模型组,不同浓度TSB⁃Ⅱ组均能减弱线虫受到的热应激损伤作用(P<0.05),但对转基因线虫体内过氧化氢酶无明显影响(P>0.05)。TSB⁃Ⅱ对线虫瘫痪、寿命、氧化应激与热应激实验的影响见表2。
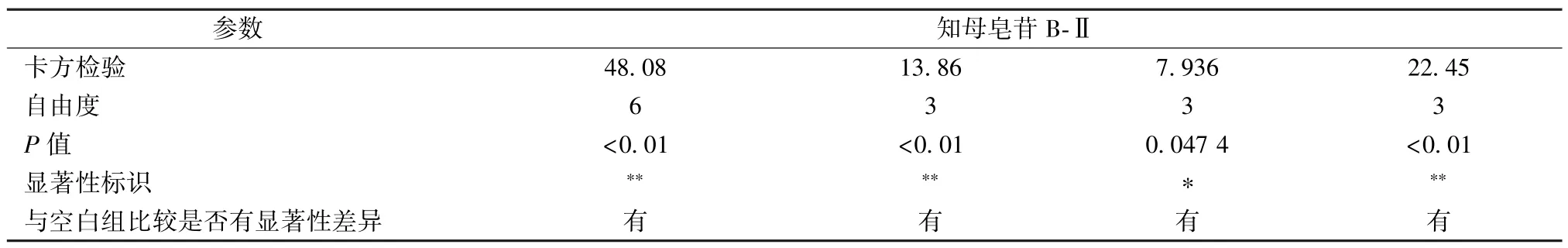
表2 TSB⁃Ⅱ数据秩和检验Tab.2 Kruskal⁃Wallis tests for TSB⁃Ⅱdata
3.2 TSB⁃Ⅱ对Aβ 体外聚集的影响 如图2 所示,相比空白组,不同浓度TSB⁃Ⅱ组均能在一定程度上降低β 淀粉样蛋白的聚集(P<0.01)。

图2 TSB⁃Ⅱ对Aβ 体外聚集的影响(, n=3)Fig.2 Effect of TSB⁃Ⅱon the in vitro aggregation of Aβ(, n=3)
3.3 TSB⁃Ⅱ对Aβ 体内聚集的影响 如图3 所示,升温诱导的线虫灰度值最高;相比模型组,不同浓度TSB⁃Ⅱ组均能降低线虫体内Aβ 聚集和沉积(P<0.01)。
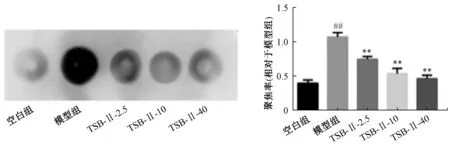
图3 TSB⁃Ⅱ对Aβ 体内聚集的影响(, n=3)Fig.3 Effect of TSB⁃Ⅱon the in vivo aggregation of Aβ(, n=3)
3.4 TSB⁃Ⅱ对AD 相关基因表达的影响 如图4所示,相比模型组,TSB⁃Ⅱ⁃40 组可上调sod⁃3、hsp⁃16.2、daf⁃16 mRNA 表达,下调skn⁃1、amy⁃1 mRNA 表达(P<0.05,P<0.01),而TSB⁃Ⅱ⁃2.5组sod⁃3 mRNA 表 达,TSB⁃Ⅱ⁃10、TSB⁃Ⅱ⁃2.5 组daf⁃16 mRNA 表达无明显变化(P>0.05)。

图4 TSB⁃Ⅱ对AD 相关基因表达的影响(, n=3)Fig.4 Effects of TSB⁃Ⅱon the expressions of AD⁃related genes(, n=3)
4 讨论
AD 的治疗与治愈是近年来研究的热点,其主要病理学特征为大脑皮质萎缩和Aβ 沉积形成的老年斑,表现为渐进性记忆减退、认知功能障碍。但其发病机制并未完全阐明,目前国内外公认的学说有Aβ 沉积学说。Aβ 是由一个跨膜糖蛋白淀粉样前体蛋白(APP)经β 和γ 分泌酶水解产生的一段中间肽链。有研究证明,Aβ 的过度产生以及促进Aβ 的聚集和沉积或抑制Aβ 沉积物的清除是导致阿尔茨海默病的主要原因之一。正常情况下Aβ的产生和消除处于动态平衡,当体内平衡遭到破坏时易引起Aβ 的沉淀和聚集,进而激发炎症级联反应,产生氧化应激作用于线粒体,影响能量代谢,加速Tau 蛋白磷酸化,神经纤维缠结的形成和降低兴奋性阈值等途径发挥神经毒性,因此调控Aβ 的形成与代谢对于AD 的预防和治疗具有重要作用。SOD 作为常见抗氧化酶之一,能一定程度抵御氧化应激与清除体内活性氧。胰岛素信号通路是重要的寿命调节通路,daf⁃16 mRNA 是调节衰老的下游组件,其大量表达能够延缓衰老,延长线虫寿命,sod⁃3 作为daf⁃16 的靶基因,可通过催化的去除保护机体免受氧化应激。小分子热休克蛋白hsp⁃16.2 是一种低分子量多肽,存在大部分机体中,该基因的表达可促进细胞对新生Aβ 蛋白的清除从而减缓Aβ 蛋白的毒性。skn⁃1 mRNA 是与氧化诱导反应的转录因子,基因的表达可以调控抗氧化应激反应,一定程度上延缓氧化损伤。amy⁃1 mRNA可能协调参与升温诱导后A 温基因的表达导致的瘫痪。
本研究以秀丽隐杆线虫CL4176 为模型,探讨了不同浓度TSB⁃Ⅱ对线虫瘫痪、寿命、活性氧、氧化损伤及热应激损伤和Aβ 的产生、聚集等方面的影响,结果表明TSB⁃Ⅱ不同浓度给药组均能一定程度上抗线虫瘫痪、延长线虫寿命、降低活性氧、减轻氧化损伤及热应激损伤。通过药物与Aβ1-42蛋白单体共孵育,发现药物不同浓度组均能一定程度上降低Aβ 的体外聚集。通过Aβ 寡聚体的点印记分析、实时荧光定量PCR 分析发现TSB⁃Ⅱ可上调线虫体内sod⁃3、hsp⁃16.2、daf⁃16 mRNA的表达和下调skn⁃1 和amy⁃1 mRNA 的表达,由此可知TSB⁃Ⅱ能够增强秀丽隐杆线虫CL4176 对于氧化应激和热应激的耐受性,降低Aβ 蛋白的聚集和沉积,具有保护神经元的作用,其对Aβ 的产生、聚集的抑制作用可能与寿命胰岛素信号通路相关。
