宰前倒挂应激对鸭血凝胶特性的影响
2021-09-27董小丽肖孟超黄继超黄苏红
董小丽,肖孟超,杨 静,2,黄继超*,黄苏红,黄 明,*
(1.南京农业大学食品科学技术学院,江苏 南京 210095;2.国家禽肉加工技术研发专业中心,南京黄教授食品科技有限公司,江苏 南京 211226;3.南京农业大学工学院,江苏 南京 210031)
血液作为肉类行业产生的副产品,除少部分加工成饲料外,大部分被丢弃。这样不仅浪费资源,也污染环境[1]。研究表明,血液制品所富含的赖氨酸可与以谷物为基础的饮食互补,更有益于人体健康[2]。且与畜血相比,禽血中的蛋白质含有更多的赖氨酸[3]。鸭血作为优质的蛋白来源,不仅有补血、清热解毒的作用,还富含多种人体必需的微量元素(铁、钙、锌、锰等)[4],特别是血红素铁能够直接被人体肠黏膜吸收,生物利用率高,不刺激消化道,无副作用[5]。除此之外,鸭血中还含有多种对人体有益的生物活性物质,如抗氧化肽[6]、超氧化物歧化酶[7]等。联合国粮食及农业组织的统计数据显示:我国2018年肉鸭出栏量约35亿 只,是世界第一的养鸭大国,肉鸭屠宰量增加的同时也使其副产物鸭血的产量增加。鸭血凝交制品(鸭血豆腐、鸭血肠等)因其口感嫩滑且营养丰富的特性成为鸭血重要的应用途径之一,且深受我国消费者的喜爱,被誉为“液体肉”[8]。因此,合理利用鸭血,提高鸭血的利用率,提升鸭血凝交品质显得尤为重要。
随着肉鸭需求量的不断增加,传统的小规模养殖和作坊式活鸭现宰现卖被现代化大规模养殖、集中化屠宰所取代,为进一步提高效率,倒挂成为禽类宰杀前必经的一个工艺过程[9],但有研究表明倒挂后,肉的品质会降低,如持水力变差、蛋白变性等[10-12],可能是倒挂后肉鸭的应激程度加剧,出现扑翅、鸣叫等一系列挣扎行为所导致[13]。同时,也有研究表明,应激会对血液学指标和凝血系统产生影响,如Austin等[14]的研究表明应激会导致血液凝固速率加快,血小板活性增强,纤维蛋白溶解进程受到抑制;Park等[15]的研究发现樱桃谷鸭在高温和用甜菜碱饮食代替正常饮食双重应激下,其红细胞(red blood count,RBC)计数、血小板(platelet,PLT)计数、血红蛋白(hemoglobin,HGB)质量浓度、红细胞比容(hematocrit,HCT)均高于对照组;Aengwanich[16]研究发现高温环境会影响泰国土鸡、肉鸡和杂交鸡的HCT;陈菲等[17]研究发现经超声波破壁后,鸭血豆腐血细胞完全被破坏,鸭血豆腐的结构交联更加致密,孔径更小,保水性更好。由此可看出血细胞的完整性对鸭血凝交的影响显著,但血细胞数量变化等对鸭血凝交的影响还有待探究。综上可知,高温、改变饮食等应激均会影响血液的品质,而宰前倒挂应激,作为禽类宰杀时不可避免的应激,是否会像其他应激一样对血液学指标和凝血系统造成影响,从而影响鸭血的凝交特性还需进一步探讨。因此,本研究以樱桃谷鸭血液为研究对象,从其成分及凝血系统的角度探究宰前倒挂应激对鸭血凝交特性的影响,进一步探讨宰前倒挂应激影响血液凝交品质的机理,以期为工厂改善鸭血凝交品质提供理论参考。
1 材料与方法
1.1 材料与试剂
实验鸭血为新鲜鸭血,40 只雄性樱桃谷鸭(40 日龄、3.5 kg)由山东嘉祥新希望六和食品有限公司提供。
乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)真空采血管 南京梅林学海生物科技有限公司;促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、皮质酮激素(corticosterone,CORT)、组织因子(tissue factor,TF)、凝血酶原(prothrombin,PT)、组织因子途径抑制剂(tissue factor pathway inhibitor,TFPI)试剂盒 南京建成生物工程有限公司;柠檬酸钠与CaCl2(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
BC-2800Vet兽用全自动血液细胞分析仪 深圳迈瑞生物医疗电子股份有限公司;Avanti J-E落地式高效冷冻离心机 美国Beckman Coulter公司;M2e多功能酶标仪德国IKA公司;Innova系列超低温立式冰箱 英国New Brunswick公司;HH-42水浴锅 常州国华电器有限公司;TA.XT2i质构仪 英国Stable Micro Systems公司;低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)仪 上海纽迈电子科技有限公司;MCR301旋转流变仪 奥地利安东帕公司;205便携式pH计德国Testo公司;Chroma Meter CR-400便携式色差仪日本Konica Minolta公司。
1.3 方法
1.3.1 血样采集及前处理
本实验中樱桃谷鸭在运输前12 h开始禁食禁水,从养殖场运输至屠宰场耗时0.5 h,然后将肉鸭安置在安静、自然通风的场所静养1 h。随后,肉鸭被随机分为对照组、宰前倒挂组,每组各20 只,按标准屠宰线流程采取三管齐断的方式进行宰杀,宰前倒挂组宰前倒挂2.5 min[10],对照组不进行倒挂。血样采集参考Sorapukdee等[18]的方法,取5 mL血样立即放入EDTA收集管进行血液学评价;取约100 mL血样与质量分数10%柠檬酸钠按9∶1(V/V)的比例混合,对血样进行抗凝。将收集的血液保存在盛有冰的泡沫箱中。EDTA收集管的血样立即送往南京农业大学动物医院采用BC-2800Vet兽用全自动血液细胞分析仪[15]进行分析,且在24 h内完成血液学指标的检测。添加柠檬酸钠抗凝的血样立即取10 mL进行离心(4 ℃、1 200×g、20 min),并取上清液(即血浆)分装在2 mL冻存管中,液氮速冻后保存于-80 ℃条件下,用于后续CORT、ACTH、TF、PT、TFPI水平的测定;剩下的约90 mL血样在0~4 ℃下保存,并在24 h内运回实验室制成血凝块。
1.3.2 血凝块的制备
鸭血凝块制备过程参考王鹏[19]的方法,并稍作修改:将约90 mL鸭血倒入食品级塑料盒中,向其中加入10 mL质量分数1% CaCl2对鸭血进行激活[20],将盛有鸭血的塑料盒置于37 ℃中加热20 min至鸭血凝固,随后转移至75 ℃下加热20 min至形成血凝块,在4 ℃下冷却12 h,然后进行凝交特性(pH值、色泽、质构、加压损失、及水分分布)的测定。鲜鸭血加CaCl2激活后需立即进行流变学分析。
1.3.3 血液指标的测定
1.3.3.1 应激指标的测定
将存于-80 ℃的血浆置于4 ℃缓慢解冻,解冻后采用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒测定CORT与ACTH的质量浓度,按照试剂盒说明书进行相关操作。
1.3.3.2 血液学指标的测定
采用兽用全自动血液细胞分析仪测定EDTA收集管的血样的血液学指标,包括RBC计数、白细胞(white blood cell,WBC)计数、PLT计数、HGB质量浓度、HCT、平均红细胞体积(mean red blood cell volume,MCV)及平均血小板体积(mean platelet volume,MPV)。
1.3.3.3 凝血指标的测定
将存于-80 ℃的血浆置于4 ℃缓慢解冻,解冻后利用ELISA试剂盒按说明书分别测定TF、PT、TFPI的质量浓度。
1.3.4 鸭血凝交特性的测定
1.3.4.1 pH值
采用便携式PH计测定处理后的血凝块的pH值,重复测定3 次。
1.3.4.2 色泽
用CR-400便携式色差仪测定处理后的血凝块的L*、a*和b*值,重复测定3 次。
1.3.4.3 质构
质构剖面分析(texture profile analysis,TPA)参考李鹏等[21]的方法,并稍作修改。使用TA.XT2i质构仪对边长为10 mm正方体状的样品进行TPA模式控制下的两次压缩,测定样品的硬度、黏着性、弹性、凝聚性、咀嚼性、交性、回复性,重复测定3 次。参数设定为探头型号:P/50;测前速率:2 mm/s;测中速率:1 mm/s;测后速率:2 mm/s;压缩比50%;两次下压间隔时间:5 s;数据收集率:200 点/s。
1.3.4.4 加压损失率
加压损失的测定参考彭增起[22]等的方法,并稍作修改。称取约1 g样品,用WW-3型应变式无侧限压缩仪测定鸭血凝块的加压损失率,重复测定3 次。测定参数及方法:在69.44 N下保持10 min,撤除压力后用滤纸吸干水分,将样品刮下后称质量,加压损失率按下式计算。

式中:m0为样品初始质量/g;m1为样品压缩10 min后的质量/g。
1.3.4.5 水分分布
采用纽迈台式脉冲NMR分析仪PQ001测定鸭血凝交的NMR弛豫时间。参数设置参考王鹏[19]的方法稍作改动。切取约2 g血凝块置于10 mm(直径)×35 mm的专用核磁管中,重复测定3 次。测试参数:用Carr-Purcell-Meiboom-Gill序列进行测量,样品测试室温度32 ℃、主频21 Hz、偏频217 614.30 Hz、90°硬脉冲宽度5.52 μs、采样点数240 080、采样频率100 Hz、180°硬脉冲宽度10.48 μs、采样等待时间4 000 ms、回波个数12 000、模拟增益20 db、数字增益2、重复采样次数32、数据半径1、开始采样时间1.000 ms、半回波时间0.200 ms。数据经MultiExp Inv Analysis软件反演后得到弛豫时间T2b、T21和T22及相应的峰面积占比。
1.3.4.6 动态流变
参考Wang Peng等[23]的方法,略有改动。将被CaCl2激活的鸭血均匀地涂在测试台上,用液体石蜡包覆以防样品蒸发,使用MCR301旋转流变仪连续监测鸭血的黏、弹性变化,重复测定3 次。参数设定:探头型号为PP 50;频率为0.1 Hz;应变为2%;上下板狭缝为0.1 cm;流变测试的程序为10~37 ℃线性升温(速率10 ℃/min),37 ℃保温20 min,而后37~75 ℃线性升温(速率同上),最后样品在75 ℃保温20 min。测定指标为流变储能模量G′、损耗模量G′′。
1.4 数据处理与分析
所有数据均采用SAS 9.2软件统计分析,使用单因素方差分析中的Duncan’s多重比较进行显著性分析,P<0.01为差异极显著,P<0.05为差异显著。采用Origin 2017与GraphPad Prism V5.0软件绘图。
2 结果与分析
2.1 宰前倒挂应激后血液指标变化
2.1.1 宰前倒挂对鸭血应激指标的影响
禽类倒挂后会出现扑翅、鸣叫及身体绷紧等应激反应,此时,其交感神经-肾上腺髓质轴被激活,下丘脑-垂体-肾上腺活动增加,神经递质使下丘脑释放促肾上腺皮质激素释放激素,促肾上腺皮质激素释放激素作用于垂体释放ACTH,ACTH最终作用于肾上腺皮质释放CORT,导致血液中CORT的浓度升高。因此,血浆中CORT的质量浓度可用来评价禽类的应激水平[13,24]。由表1可知,宰前倒挂组鸭血浆中CORT的质量浓度极显著高于对照组(P<0.01),ACTH的质量浓度显著高于对照组(P<0.05),说明宰前倒挂能明显加剧肉鸭的应激程度,与Sun Xiaobin等[10]的研究结果一致。
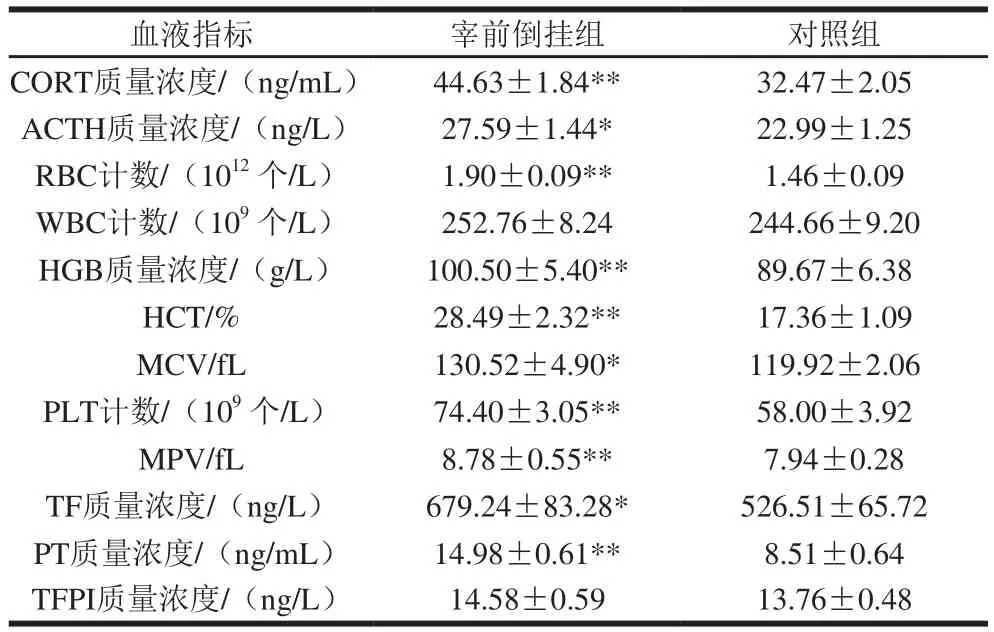
表1 宰前倒挂对鸭血应激指标的影响(n=20)Table 1 Effect of pre-slaughter shackling on stress indicators of duck blood (n = 20)
2.1.2 宰前倒挂对鸭血中血液学指标的影响
由表1可知,与对照组相比,宰前倒挂2.5 min显著影响了肉鸭的血液学指标,RBC计数、HGB质量浓度、HCT计数、PLT计数、MPV极显著升高(P<0.01),MCV显著升高(P<0.05),与Park等[15]研究樱桃谷鸭在高温和用甜菜碱饮食代替正常饮食双重应激下血液学指标的变化结果一致;WBC计数虽有增加但不显著(P>0.05),与Patterson等[25]研究增大笼养密度对单冠来航鸡WBC影响的结果一致。
2.1.3 宰前倒挂对鸭血凝血系统的影响
血液离开机体后很快就会凝固,是因为血液中含有凝血因子,在凝血因子的作用下,溶交状态的纤维蛋白原转变为凝交状态的纤维蛋白[26]。但有研究表明鸟类内源性凝血途径(由凝血因子XI和XII激活)因缺乏凝血因子XI和XII仍存争议[27],因此,其TF依赖途径在血液凝固过程中必不可少,但TF途径受到负调节物TFPI的抑制。同时,有大量研究通过基因敲除技术发现PT与TF的缺乏与致命性出血有关[28-29]。因此,可通过测定TF、PT、TFPI的水平来判断肉鸭凝血系统的变化。由表1可知,宰前倒挂处理使鸭血中TF与PT质量浓度均显著升高(P<0.05,P<0.01)。TFPI质量浓度虽有升高,但无统计学差异(P>0.05)。综上,肉鸭在受到倒挂应激后,血液凝固系统更活跃,血液凝固加速,纤维蛋白溶解进程受到抑制。
2.2 宰前倒挂对鸭血凝交特性的影响
2.2.1 宰前倒挂对鸭血凝交pH值与色泽的影响
由表2可知,与对照组相比,宰前倒挂组的鸭血凝交的pH值显著升高(P<0.05),可能是由于倒挂增加了呼吸频率,二氧化碳被大量呼出,导致血液中碳酸氢根减少,从而使pH值升高[30]。此外,宰前倒挂组的a*值(红度)极显著大于对照组(P<0.01),鸭血颜色更加鲜红;b*值(黄度)与L*值(亮度)均无显著性差异(P>0.05)。本研究中宰前倒挂应激使鸭血凝交更加鲜红(a*值较大),这可能与应激后鸭血的血液学指标的变化相关。HGB是决定血色的主要蛋白质,是天然的食品着色剂[31],本研究发现倒挂应激导致鸭血中HGB质量浓度极显著升高(P<0.01),这可能是鸭血颜色更加鲜红的主要原因。

表2 宰前倒挂对鸭血pH值及色泽的影响Table 2 Effect of pre-slaughter shackling on pH and color of duck blood
2.2.2 宰前倒挂对鸭血凝交质构的影响
由表3可知,宰前倒挂组中的鸭血凝交的硬度和弹性显著高于对照组(P<0.05);黏着性、凝聚性、交性与咀嚼性均极显著低于对照组(P<0.01),回复性与对照组无显著性差异(P>0.05)。王鹏[19]对影响鸭血凝交质构的因素进行研究并指出硬度、交性与咀嚼性是评价鸭血凝交质构的主要指标,而硬度是最关键的指标,倒挂应激后,鸭血凝交的硬度显著增大,而交性、咀嚼性和凝聚性均极显著降低,这可能与宰前倒挂应激后鸭血中RBC、PLT增多,HGB、HCT、MPV、MCV水平上升相关,因为这一系列变化均会导致血液中干物质水平的增加,但过高的干物质水平可能会抑制血液凝血系统中纤维蛋白形成凝交的能力,干扰鸭血凝交网络结构的形成,最终表现为鸭血凝交质地硬、交性差,导致鸭血凝交产生化渣的口感,这与传统上鸭血凝交嫩滑的口感相悖,故宰前倒挂应激对鸭血凝交的质地造成负面影响。

表3 宰前倒挂对鸭血凝胶质构的影响Table 3 Effect of pre-slaughter shackling on texture of duck blood gel
2.2.3 宰前倒挂对鸭血凝交加压损失率与水分分布的影响
LF-NMR可以在不破坏蛋白质凝交微观结构的情况下检测水在凝交中的迁移率和分布状态,已成功地用于评价蛋白质凝交的稳定性和保水性[32]。保水性是评价鸭血凝交特性的重要指标。由图1可知,与对照组相比,宰前倒挂组的鸭血凝交的加压损失率显著增大(P<0.05),加压损失率越大,即凝交的保水性越差,而保水性的降低将最终影响鸭血凝交的口感。本研究发现,宰前倒挂应激后鸭血中RBC、PLT、HGB、HCT、MPV、MCV的水平上升,这些变化均会导致血液中干物质含量的增加,使得鸭血凝交的保水性降低。除此之外,保水性降低还与凝交pH值的升高密切相关。综合表2中pH值的研究结果可知,当pH值为7.49±0.26时,鸭血凝交的保水性更低,所以推测当pH值为7.49±0.26时更接近鸭血蛋白的等电点。当pH值接近鸭血凝交的等电点时,会影响鸭血蛋白氨基酸侧链电荷分布,产生静电作用,从而影响氢键等次级键的稳定性[33],使鸭血蛋白凝聚体发生聚集,凝聚体间交联空间变大,导致凝交脱水收缩,最后降低了鸭血凝交的保水性。图2为鸭血凝交LF-NMR弛豫谱图。弛豫谱图上显示出3 个峰,其中T2b(0~10 ms)代表与蛋白质大分子紧密结合的结合水,T21(10~300 ms)代表不易流动水,T22(300~10 000 ms)代表自由水[34-35]。由图2可知,与对照组相比,宰前倒挂组中3 种状态的水均向着弛豫时间更长的方向移动,说明应激改变了鸭血凝交的组织结构,使得鸭血凝交中水分的迁移率加快,水分自由度增大。同时,对照组和宰前倒挂组中鸭血凝交的不易流动水所占比例最高,说明两组鸭血凝交均有较好的稳定性[36]。表4为各弛豫时间所占峰面积的比例,由表4可知,与对照组相比,宰前倒挂组T2b的峰面积比例(P2b)显著降低,T21的峰面积比例(P21)显著升高,T22的峰面积比例(P22)显著降低(P<0.05)。由此可知,倒挂应激减少了鸭血凝交中结合水与自由水的比例,增加了不易流动水的比例,这可能是因为肉鸭在受到倒挂应激后,血液凝固系统更活跃,鸭血形成凝交的速度加快,使得结合水还未及时与蛋白分子结合,就被快速形成的凝交网状结构包裹,转变为不易流动水,同时自由水也被快速包裹在网状结构中,转变为不易流动水。加压损失的原理是加压过程中样品的微观结构被破坏,大量的不易流动水因挤压而流失,且相关研究表明结合水的比例与凝交的保水性呈正相关[32],与本实验中保水性结果一致。

图1 宰前倒挂对鸭血凝胶加压损失的影响Fig.1 Effect of pre-slaughter shackling on pressing loss of duck blood gel

图2 鸭血凝胶横向弛豫时间T2反演图Fig.2 Inverted transverse relaxation time (T2) spectra of duck blood gel
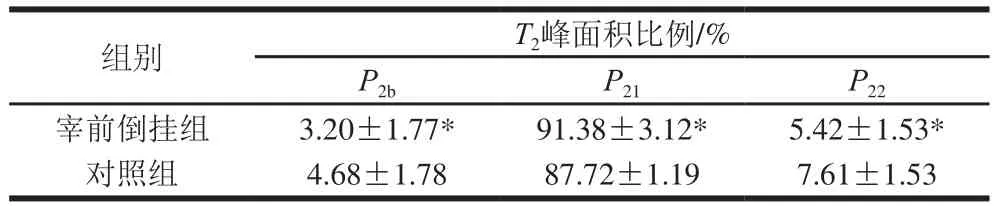
表4 宰前倒挂对鸭血凝胶水分分布的影响Table 4 Effect of pre-slaughter shackling on water distribution in duck blood gel
2.2.4 宰前倒挂对鸭血凝交动态流变性的影响
储能模量(G′)与损耗模量(G′′)分别表示黏弹性材料在形变过程中由于弹性形变(可逆)而储存的能量与黏性形变(不可逆)而损耗的能量。可通过测定G′(图3A)和G′′(图3B)来观察热处理过程中鸭血由溶交状态转变为凝交状态的动态黏弹性变化。G′表示鸭血凝交体系的弹性,G′′表示黏性[37]。由图3可知,在75 ℃保温阶段,G′与G′′均处于持续上升趋势,与对照组的趋势相似,但宰前倒挂组的增速更快。已有研究表明G′增量与所用时间的比值可衡量两处理组鸭血的凝交速率[19],因此在75 ℃保温阶段,宰前倒挂组的凝交速率高于对照组。但宰前倒挂组在37 ℃保温后期及37~75 ℃升温阶段与对照组相比,出现明显不同的变化趋势,在37 ℃保温后期,G′与G′′均有小幅上升,可能是由于凝血因子开始被激活,鸭血蛋白在低温条件下开始交联,使鸭血凝交化,初步形成凝交网络结构;在37~75 ℃升温阶段,G′与G′′均急速上升,可能是由于鸭血中的凝血因子大量激活,鸭血蛋白迅速展开,快速形成了鸭血的凝交网络结构。综上,倒挂应激加快了鸭血凝交的形成。
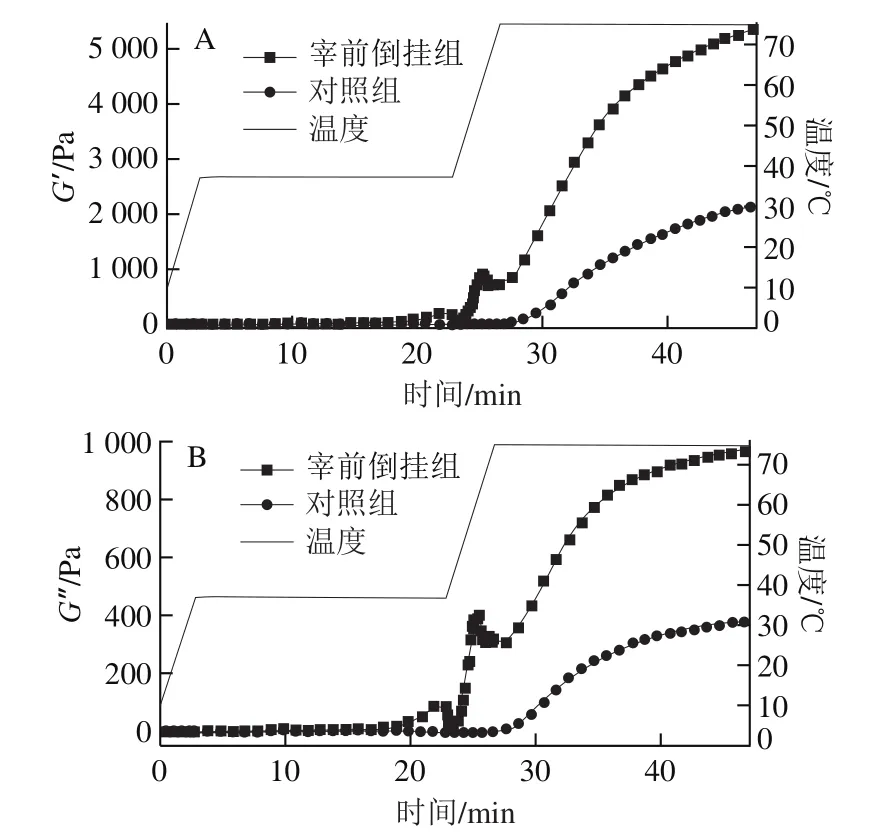
图3 宰前倒挂对鸭血凝胶流变学特性的影响Fig.3 Effect of pre-slaughter shackling on rheological properties of duck blood gel
3 结 论
本研究发现宰前倒挂2.5 min后,鸭血浆中CORT和ACTH的质量浓度升高,表明肉鸭应激程度加剧。经倒挂后,鸭血的血液成分及凝血相关指标发生明显变化,如RBC计数和PLT计数增多,MCV和MPV增大,HGB、TF、PT质量浓度升高等。此外,血液成分及凝血系统的变化影响了鸭血的凝交特性,如质地硬、交性和咀嚼性差、水分迁移率加快、不易移动水的比例增加、自由水和结合水的比例减少、保水性变差,但色泽变好。综上,宰前倒挂应激会影响鸭血的血液学指标和凝血系统,从而改变其凝交行为及凝交特性,研究结果可为工厂改善鸭血凝交品质提供新方向和一定的理论参考。
