投喂配合饲料和冰鱼对中华绒螯蟹生长、氨基酸代谢和胺类物质沉积的影响
2021-09-27华皓坤刘文斌刘婷燕毛晶戴永军米海峰黄洋洋吴业阳蒋广震
华皓坤,刘文斌,刘婷燕,毛晶,戴永军,米海峰,黄洋洋,吴业阳,蒋广震*
(1.南京农业大学动物科技学院/江苏省水产动物营养重点实验室,江苏 南京 210095;2.通威股份有限公司,四川 成都 610041)
中华绒螯蟹(Eriocheirsinensis),也称河蟹,是东亚特别是中国最受欢迎的淡水水产品之一,因其独特的鲜味和良好的营养价值而广受消费者喜爱。近年来,中华绒螯蟹养殖规模逐年扩大,市场需求稳步增加,到2019年,中国成蟹的养殖产量达到77.87万t[1]。然而,在饲料使用方面,却不尽如人意,目前主要采用投喂冰鱼和饲料原料(小麦、玉米、黄豆和饼粕类等)的养殖方式[2]。这些传统饲料来源不稳定,质量不可控,易携带致病菌,恶化池塘水质,导致病害爆发、成蟹品质不稳定和养殖效益低等问题,严重制约了中华绒螯蟹养殖产业的健康可持续发展[3]。但是,很多养殖者认为投喂冰鱼养殖的河蟹味道更鲜美,并以此误导消费者,给产业发展带来了巨大的隐患。目前,虽然关于投喂配合饲料和冰鱼对河蟹生长、品质和风味影响的研究已有报道[4],但针对不同投喂对河蟹生长、氨基酸代谢和胺类物质沉积的研究仍较少。
哺乳动物雷帕霉素靶蛋白(mTOR)是蛋白激酶家族成员之一,mTOR通路是调节蛋白转录的重要通路[5-6]。mTOR可形成mTORC1(mTOR complex 1)和mTORC2(mTOR complex 2)2种复合物,其中,磷酸化后的AKT能使mTORC2在Ser473位点磷酸化从而活化,促进蛋白质合成,而mTOR磷酸化下游的4E-BP则可释放出翻译起始因子,并与其他翻译起始因子结合启动5′cap-mRNA的翻译[7-8]。周群兰[5]对团头鲂研究发现,向植物蛋白源中添加氨基酸可以上调mTOR基因的表达量,并下调4E-BP基因的表达量。
胺类物质,也称生物胺,常被作为水产品安全的重要监测指标,同时也是水产品重要的呈味物质和神经递质,肌肉中胺类物质的种类和数量与中华绒螯蟹风味息息相关。胺类物质按其化学结构可分为脂肪族(腐胺、尸胺、精胺和亚精胺等)、芳香族(酪胺、苯甲胺等)和杂环族(组胺、色胺等)。根据其组成成分又可分为单胺(组胺、酪胺、苯甲胺等)和多胺(尸胺、腐胺、精胺和亚精胺等)[9]。其中,单胺具有多种生理调节功能[10-12],多胺中的尸胺、精胺、亚精胺可有效阻止不饱和脂肪酸的氧化,清除自由基[9,11,13-14]。胺类物质在水产品肌肉中呈现出腥味等多种特殊风味,但是在不同水产品种类间,胺类物质沉积规律有很大的差异。一般来说,胺类物质广泛存在于鱼、虾、蟹等各种水产品体内,但是不同种类水产品肌肉中胺类物质的含量和种类不同,目前普遍接受的观点是海水水产品的胺类物质含量高于淡水产品[15-16]。这也导致关于水产品体内胺类物质沉积的研究集中在海水种类,而淡水种类的研究较少[17],食物中胺类物质是否在河蟹体内沉积尚少见报道[9]。在Tapia-Salazar等[18]对虾的研究中,饲料中添加组胺并不影响虾的饲料消耗、饲料转化率和存活率,且对虾的生长性能不会产生负面影响。鉴于此,本试验通过对比投喂配合饲料和冰鱼对中华绒螯蟹生长、氨基酸代谢和胺类物质沉积的影响,为胺类物质在中华绒螯蟹体内代谢规律提供基础数据,也为中华绒螯蟹的人工配合饲料开发提供试验依据。
1 材料与方法
1.1 试验饲料与试验设计
试验分为2组,分别为配合饲料组和冰鱼组,配合饲料组全程投喂人工配合饲料,冰鱼组全程投喂冰鱼(冷冻的海水杂鱼,以鲱科鱼为主,购自南京市浦口区星甸镇养殖区)。每个处理组设6个重复,每个重复8只中华绒螯蟹,6雄2雌。试验前蟹平均体重27.41 g,投喂56 d。配合饲料购自江苏兴化地区,主要营养成分和氨基酸含量见表1。
1.2 试验用蟹来源及养殖管理
试验蟹来源于南京农业大学水产教学科研基地,运输到养殖实验室后,驯化养殖14 d,投喂商品饲料。试验在循环养殖系统中开展,在每个桶中放置5个波纹塑料管(直径25 mm,长12 cm)。试验期间,桶内保持24 h充氧,每天更换30%~50%的水,保持水温(24±5)℃。每天投喂2次(07:00、17:00),日投喂量约为蟹总生物量的2%~3%。每天观察并记录螃蟹的采食、脱壳及死亡情况。

表1 冰鱼和配合饲料主要营养成分及氨基酸含量Table 1 Main biochemical composition and contents of amino acid in different feeds %
1.3 样品采集
养殖8周后,结束养殖试验,采集样本。具体方法:试验结束时,每个桶收集大小和健康状况相似的 6只螃蟹,冰上麻醉10 min(低温可降低螃蟹的活力),然后杀死螃蟹,在冰床上解剖,剥离肌肉,用 4 ℃预冷的生理盐水(0.89 g·L-1NaCl)彻底清洗,立即在液氮中冷冻,并在-80 ℃下保存供后续分析。
1.4 氨基酸和胺类物质含量测定
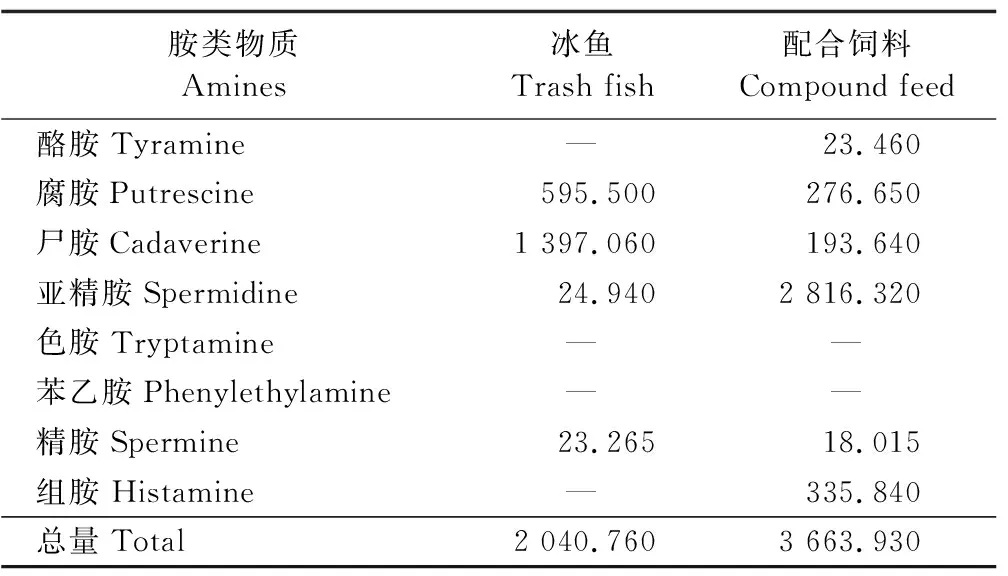
表2 不同饲料中胺类物质的含量(以鲜样计)
氨基酸测定采用酸水解法[19],利用氨基酸分析仪(日立L-8900)测定。
胺类物质采用高效液相色谱法。具体如下:称取2.0 g蟹肌肉或饲料样品于50 mL离心管中,加入10 mL 0.4 mol·L-1高氯酸溶液,均质,于3 000 r·min-1离心10 min,取上层清液移入 25 mL 棕色容量瓶中,再重复提取1次,合并上清液于容量瓶中,用0.4 mol·L-1高氯酸溶液定容至25 mL。衍生处理:1)标准品:取1.0 mL 8种胺混合标准品适当浓度的标准液,加入300 μL饱和碳酸氢钠溶液和 2 mL 丙酮配制的10 g·L-1丹酰氯溶液,在40 ℃的电热恒温培养箱中避光反应45 min后,加100 μL体积分数为25%的浓氨水,静置30 min,用乙腈定容到5 mL,振荡混匀,取1 mL过0.20 μm滤膜的有机相针式滤器后待测;2)样品:取1.0 mL提取液,依次加入100 μL 2 mol·L-1氢氧化钠溶液、300 μL饱和碳酸氢钠溶液和2 mL 10 g·L-1丹酰氯溶液,同标准品衍生后待测。液相色谱检测条件:流动相A为乙腈、B为超纯水、C为 0.1 mol·L-1乙酸铵。梯度淋洗:0~7 min,45% C→50% C;7~25 min,50% C→10% C;25~35 min,10% C→45% C;35~45 min,45% C。柱温40 ℃,流速1.0 m·min-1,进样量10 μL,检测波长254 nm。
1.5 生长性能指标及其计算方法
中华绒螯蟹增重率(WG)、特定生长率(SGR)、饵料系数(FCR)的计算公式如下:
WG=(Wt-W0)/W0×100%;SGR=(lnWt-lnW0)/T×100%;FCR=F/(Wt-W0),
式中:W0为中华绒螯蟹初始体重(g);Wt为试验结束时中华绒螯蟹的体重(g);T为养殖时间(d);F为摄食量(g)。
1.6 氨基酸代谢相关基因表达量的测定
RNA提取:取组织样0.1 g左右,加入盛有1 mL的Trizol液的EP管,4 ℃下充分匀浆,放置5 min后,加200 μL氯仿,剧烈振荡15 s左右,然后低温下12 000g离心10 min;取上清液300~500 μL,加入等体积的异丙酮,充分混匀后室温放置10 min,再次离心10 min。小心移去上清液,加入500 μL体积分数为75%的乙醇,混匀后,12 000g离心5 min。重复此操作2次。弃上清液,取沉淀室温下干燥10 min左右,加DEPC水40~100 μL溶解RNA,然后测定其浓度和质量后,稀释成相同浓度,进行RNA的反转录。
RNA的反转录:按照大连宝生物公司试剂盒说明书进行反转录。反应采用二步法:第1步42 ℃反应40 min;第2步90 ℃反应2 min,最后4 ℃保存。10倍稀释后,进行实时荧光定量PCR(RT-qPCR)。
RT-qPCR:1)引物设计:根据GenBank数据库中已知的中华绒螯蟹相关基因序列,使用Primer Premier 5.0软件设计内参基因S27和肌肉TOR、AKT、4E-BP等的引物,并由上海Invitrogen公司合成,其序列参见表3;2)qPCR:根据TaKaRa SYBR®PremixExTaqTMⅡ试剂盒说明书进行操作,结果用2-ΔΔCT方法进行分析。
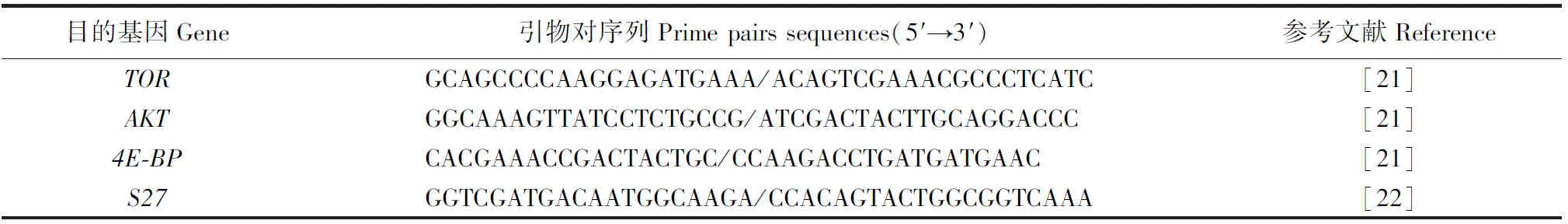
表3 本试验中RT-qPCR所用引物的序列Table 3 Nucleotide sequences of the primers used in RT-qPCR
1.7 数据统计及分析
2 结果与分析
2.1 冰鱼和配合饲料投喂对中华绒螯蟹生长的影响

表4 配合饲料和冰鱼投喂在中华绒螯蟹生长性能上的比较
由表4可知:配合饲料组和冰鱼组中华绒螯蟹的初均重、末均重、增重率、特定生长率均没有显著差异(P>0.05),其中配合饲料组中华绒螯蟹的增重率和特定生长率均略高于冰鱼组。配合饲料组的饵料系数显著低于冰鱼组(P<0.05)。
2.2 冰鱼和配合饲料投喂对中华绒螯蟹肌肉氨基酸组成的影响
由表5可知:投喂配合饲料组和冰鱼组中华绒螯蟹肌肉各种氨基酸、总必需氨基酸、总氨基酸均没有显著差异(P>0.05)。
2.3 冰鱼和配合饲料投喂对中华绒螯蟹肌肉胺类物质含量的影响
由表6可知:配合饲料组中华绒螯蟹的酪胺含量和腐胺含量显著高于冰鱼组(P<0.05),而尸胺含量和亚精胺含量显著低于冰鱼组(P<0.05)。2组精胺、组胺的差异不显著(P>0.05),但配合饲料组2者均略低于冰鱼组。冰鱼组中未检测到酪胺和腐胺。2组均未检测到色胺和苯乙胺。对比配合饲料与冰鱼中胺类物质含量,发现中华绒螯蟹肌肉中胺类物质沉积种类和沉积量与摄入的胺类物质种类和量密切相关。
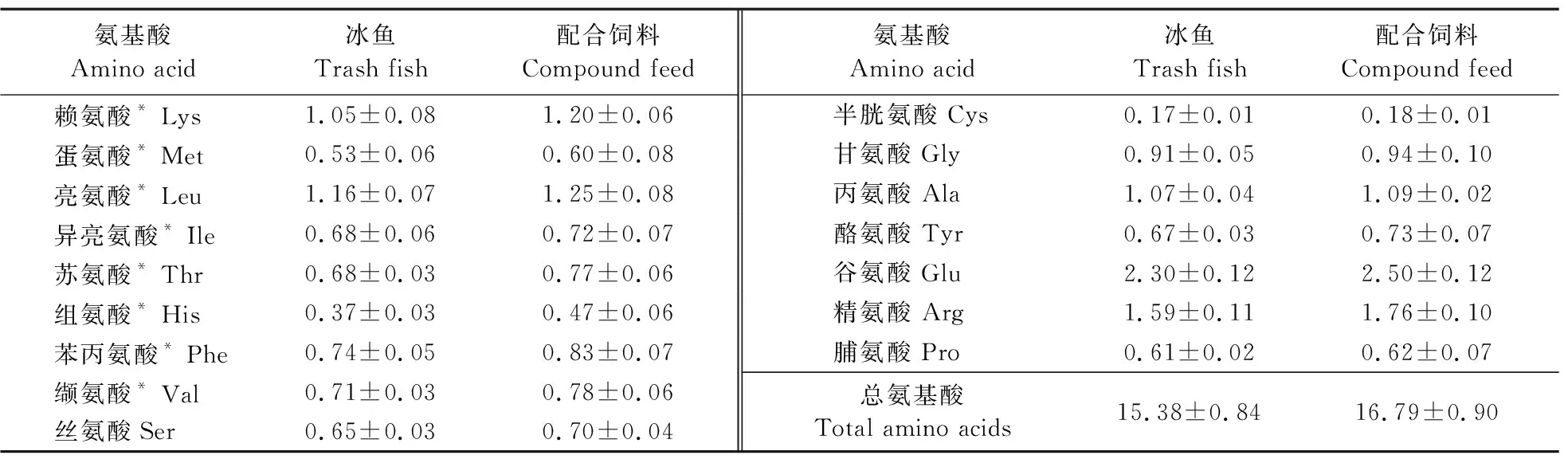
表5 冰鱼和配合饲料投喂在中华绒螯蟹肌肉氨基酸组成上的比较(以鲜样计)Table 5 Comparison of amino acid composition of Chinese mitten crabbetween trash fish and compound feed(fresh weight basic) mg·100 g-1

表6 冰鱼和配合饲料投喂在中华绒螯蟹肌肉胺类物质上的比较(以鲜样计)Table 6 Comparison of the amines of Chinese mitten crab between trash fishand compound feed(fresh weight basic) mg·100 g-1
2.4 冰鱼和配合饲料投喂对中华绒螯蟹AKT、4E-BP、mTOR基因表达量的影响

图1 冰鱼和配合饲料投喂在氨基酸代谢 相关基因表达量上的比较Fig.1 Comparison of expression level of amino acid metabolism related genes between trash fish and compound feed*P<0.05.
由图1可知:2组饲料对中华绒螯蟹氨基酸代谢相关基因表达量有明显的影响。配合饲料组的AKT、4E-BP基因的相对表达量显著低于冰鱼组(P<0.05);而冰鱼组的mTOR基因相对表达量显著低于配合饲料组(P<0.05)。
3 讨论
3.1 投喂配合饲料和冰鱼对中华绒螯蟹生长的影响
配合饲料具有来源稳定、质量可控、投喂方便等优点[2],其替代天然饵料饲养中华绒螯蟹已成产业发展的必然趋势[20-21]。而且配合饲料替代冰鱼对中华绒螯蟹生长发育没有显著影响[17]。从本试验结果来看,投喂配合饲料和冰鱼对中华绒螯蟹的初均重、末均重、增重率、特定生长率的影响均无显著差异,这一结果与杨志刚等[17]的研究结果相似,这表明配合饲料能替代冰鱼并满足中华绒螯蟹生长发育的需求。阙有清等[22]的研究也显示,全程投喂配合饲料替代冰鱼对中华绒螯蟹成蟹存活和生长发育等各项指标无显著影响。但本试验中,冰鱼组的饵料系数显著高于配合饲料组,是配合饲料组的2.34倍,这暗示,投喂配合饲料相比于冰鱼,可以提高饲料利用率,大幅度降低饵料系数,而不会影响生长性能。杨志刚等[17]对冰鱼和配合饲料成本的核算也证明了这一点。近年来,随着研究者对中华绒螯蟹营养需求、生理特点的深入研究,其营养需求数据已经较为全面,基本的配合饲料配方已经能够满足中华绒螯蟹生长需要[2]。但关于中华绒螯蟹对各种饲料原料消化率的研究仍未见报道。目前生产中配合饲料的使用率仍然较低,大多数养殖者仍然采用配合饲料和冰鱼间隔投喂的模式,这提示我们,需要在配合饲料标准制定、饲料原料消化率数据收集等方面开展进一步工作,加快配合饲料在中华绒螯蟹生产中的广泛应用。
3.2 投喂配合饲料和冰鱼对中华绒螯蟹肌肉氨基酸组成的影响
水产动物的体组成与饵料的营养成分相关[23-24]。其中,氨基酸组成一定程度上反映了水产动物对饲料中蛋白质的利用程度[25]。马林等[26]在对珍珠龙胆石斑鱼的研究中发现,在配合饲料与冰鲜饵料的蛋白含量无显著差异的情况下,摄食配合饲料的鱼体肌肉中的各项氨基酸均显著高于冰鲜饵料。本试验结果表明,配合饲料组的各必需氨基酸含量均略高于冰鱼组,且总氨基酸含量也略高于冰鱼组,与石婧等[4]的研究结果相似。而投喂的2种饲料中,配合饲料中大部分氨基酸含量均略低于冰鱼组,但养殖的中华绒螯蟹中各氨基酸含量略高于或与冰鱼组相当,这可能是由于配合饲料中的氨基酸的组成更符合中华绒螯蟹的需要,与冰鱼相比较为平衡,从而增加了中华绒螯蟹对氨基酸的利用率和沉积率,可以更经济地维持中华绒螯蟹肌肉营养品质。
3.3 投喂配合饲料和冰鱼对中华绒螯蟹肌肉胺类物质含量的影响
本试验结果显示,配合饲料组的酪胺和腐胺含量显著高于冰鱼组,而尸胺和亚精胺含量显著低于冰鱼组。Tapia-Salazar等[18]研究发现,饲料中组胺含量的不同可以影响虾体中其他胺类物质的浓度,如亚精胺含量会随着组胺含量在饲料中的增加而增加,且尸胺、腐胺、精胺等均在虾体中检测出。Seidel等[27]认为,组织中多胺的浓度与其代谢能力有关。在本试验中,尸胺与腐胺只有略微的沉积,这与张金彪[9]的研究结果相似,可能是因为中华绒螯蟹对尸胺、腐胺的代谢能力强,胺氧化酶将尸胺、腐胺氧化成醛类,再进一步氧化成羧酸,从而完成胺类物质的代谢[12]。配合饲料组中的酪胺含量显著高于冰鱼组,可能是由于投喂的配合饲料中含有一定的酪胺,而冰鱼中没有,由于酪胺的前体物质酪氨酸不是中华绒螯蟹的必需氨基酸,可能导致中华绒螯蟹对它的代谢能力不强。冰鱼组中的亚精胺含量显著高于配合饲料组,可能是由于腐胺、精胺转化为亚精胺[28]。Yang等[29]从组胺对虹鳟和蓝虾的不同影响中认为,水生动物对组胺的反应可能具有种特异性。Tapia-Salazar等[18]认为,在饲料中添加1 200~2 400 mg·kg-1的组胺,可提高虾的增重率,而本试验中,配合饲料含有一定组胺含量,投喂后中华绒螯蟹的配合饲料组饵料系数低于用不含有组胺的冰鱼投喂的冰鱼组,但增重率无显著差异,说明中华绒螯蟹的摄食量减少,这可能是由于组胺对中华绒螯蟹生长的促进作用引起的。
对于胺类物质的沉积情况来说,中华绒螯蟹肌肉中沉积的胺类物质的种类和沉积量,与摄入饲料中含有的胺类物质的种类和量有很强的相关性。这一结果暗示,胺类物质可在中华绒螯蟹肌肉中沉积。有研究显示,一些种类的水生生物不能沉积饲料中的胺类物质,如Opstvedt等[30]对大西洋鲑上的研究表明,饲料中的胺类物质不能沉积到大西洋鲑的肌肉中。也有一些水生生物肌肉中胺类物质的种类和数量与摄食食物相关,如蓝虾[18]、拟穴青蟹[31]。我们推测,以中华绒螯蟹为代表的甲壳类,可能对胺类物质的代谢能力差,更容易沉积。这一点提示我们可通过控制饲料中胺类物质的种类和比例,调控中华绒螯蟹风味。
3.4 投喂配合饲料和冰鱼对中华绒螯蟹AKT、4E-BP、mTOR基因表达的影响
一般认为,mTOR-AKT-4EBP信号通路在蛋白代谢中发挥重要作用。本试验中,配合饲料组的AKT和4E-BP基因相对表达量显著低于冰鱼组,而mTOR基因相对表达量显著高于冰鱼组,这可能是由于配合饲料中的氨基酸比例更加平衡,与冰鱼相比更加符合中华绒螯蟹的需要,mTOR基因表达量的上调使4E-BP和AKT基因表达量下降,从而促进蛋白质的转录。这一结果提示,摄食氨基酸更加合理的配合饲料可能通过激活TOR通路,增强蛋白代谢,降低了饵料系数。
