摩尔比法测定磺基水杨酸铜组成与稳定常数的研究
2021-09-26彭敏石建新王周李莲云
彭敏,石建新,王周,李莲云
中山大学化学学院,广州 510275
传统的配合物稳定常数测定方法[1]有pH电位法、分光光度法、电导滴定法、量热滴定法、极谱法、离子交换法、相平衡法等。基础无机实验——磺基水杨酸铜配合物组成与稳定常数的测定使用的是分光光度法。分光光度法分为等物质的量系列法和物质的量比法[2](又称摩尔比法、饱和法,以下统称摩尔比法),实验一般是采用等物质的量系列法进行。检索有关摩尔比法的中文文献,有高吉刚等[3]研究Cu和4-(5-氯-2-吡啶偶氮)-1,2-二氨基苯(5-Cl-PADAB)体系的稳定常数,张淑艳等[4]研究N-苯甲酰基-N′,N′-二苯代硫脲合铜(II)配合物组成,但未见有摩尔比法测定磺基水杨酸铜稳定常数的相关文献。本文通过实验研究摩尔比法测定磺基水杨酸铜组成与稳定常数的可行性,并对实验结果进行探讨。
1 实验部分
1.1 实验试剂与主要仪器
S22PC分光光度计电子分析天平(梅特勒‐托利多EL204),雷磁pHs-3C酸度计,电子秤(梅特勒‐托利多PL602-E),电磁搅拌器(IKA C-MAG HS7)。
NaOH (1.0 mol·L−1,0.05 mol·L−1),HNO3(0.05 mol·L−1)。
0.05000 mol·L−1硝酸铜溶液的配制:准确称取12.078 g三水合硝酸铜用水溶解,转移至1000 mL容量瓶中并用水定容。
0.10 mol·L−1硝酸钾溶液的配制:10.0 g硝酸钾溶于1 L水中。
0.2500 mol·L−15-磺基水杨酸(简写为H3L)溶液的配制:准确称取15.888 g二水合5-磺基水杨酸用水溶解,转移至250 mL容量瓶中并用水定容。
pH计校正用标准缓冲液(4.0,6.86):由厂家提供的雷磁pH缓冲剂粉包按要求配制。
所用试剂均为分析纯,实验用水为去离子水。
1.2 实验方案
1) 用0.05000 mol·L−1硝酸铜溶液和0.2500 mol·L−1H3L,在12个50 mL烧杯中按表1的要求配制系列混合溶液(硝酸铜溶液由10 mL移液管移取;1–7号溶液所需H3L采用2 mL吸量管移取,8–12号的H3L由25 mL酸式滴定管放液取得)。
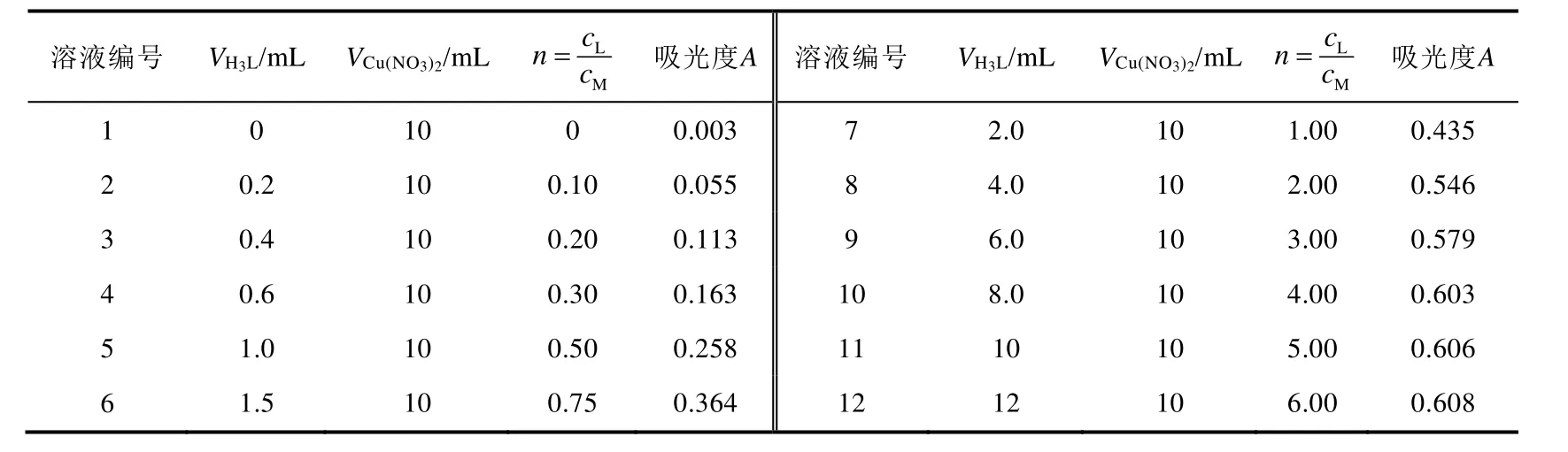
表1 摩尔比法系列混合溶液的配制及其吸光度测定
2) 在pH计及电磁搅拌器辅助下调节系列溶液pH为4.70。
3) 调好pH的溶液分别定量转移到50 mL容量瓶,并用已调好pH为4.70的0.1 mol·L−1硝酸钾定容。
4) 在S22PC分光光度计上选波长为440 nm,用1 cm比色皿,以0.1 mol·L−1硝酸钾作参比,分别测定各溶液的吸光度,结果见表1。
2 结果与讨论
2.1 摩尔比法作图确定磺基水杨酸铜的络合比
由表1所得数据作图,如图1所示。
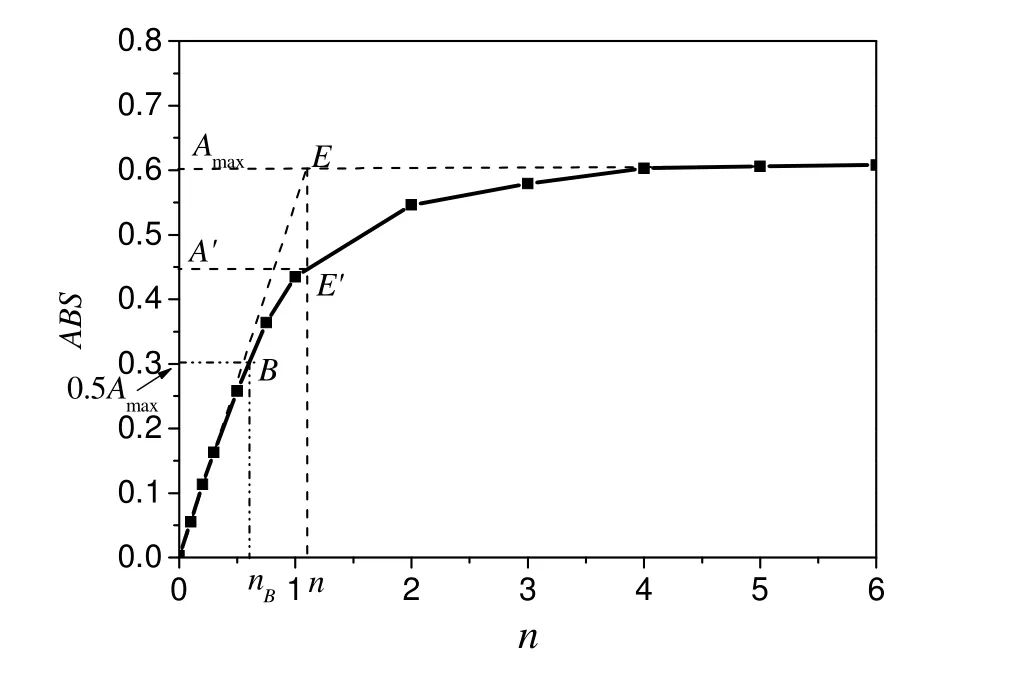
图1 摩尔比法测定磺基水杨酸铜的组成和稳定常数
分析表1数据可知,当n≥ 4时,溶液的吸光度基本保持不变,当n≤ 0.3时,随着n值增大,溶液吸光度也线性增大;根据摩尔比法原理作图[2],以图1前四个点、后三个点分别作直线,两者交于E点,E点对应的横坐标n即为配合物的络合比,其值见表2;对应纵坐标Amax为磺基水杨酸铜吸光度最大值,近似等于配合物未发生解离时的吸光度。

表2 由图1所得实验数据汇总
2.2 磺基水杨酸铜稳定常数的计算
对于配合物MLn,在溶液中有如下关系:
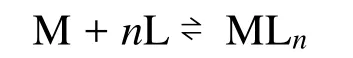
稳定常数表示为:

对式(1),当[M]= [MLn],则:

假设配合物总浓度为c,由于配合物不稳定,存在解离现象,其解离度为α,从而有:
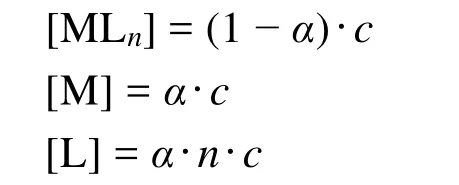
代入式(1)有:

假设配合物络合比n= 1,则式(3)可简化为:

根据式(2),当[Cu2+]= [CuL],即有A= 0.5Amax时,作水平线与曲线交于B点,B点对应横坐标为nB,从而可求得0.5Amax对应H3L浓度cL的值,相关数据见表2。将cL的值代入式(2)可求得配合物稳定常数K稳见表3。然而,谢远武[5]提到,在用式(2)计算K稳时应用配体的平衡浓度c[L](其值比总浓度cL小),而表3是用总浓度cL进行计算,因此会有较大误差(见表3);因平衡浓度c[L]难以根据现有条件求出,谢远武通过推导提出另一个计算K稳的公式,如下:


表3 通过不同公式计算稳定常数的差别
式(5)中A′可由E点引垂线与曲线的交点E′求得(图1),而ε为配合物的摩尔吸收系数,可由实验数据计算得到:
根据朗伯比尔定律A=εbc,已知Amax为磺基水杨酸铜未解离时的吸光度,从而有A=Amax= 0.606,光程即比色皿厚度为b= 1 cm,磺基水杨酸铜溶液浓度从而得到磺基水杨酸铜的摩尔吸收系数ε= 59.5。
由图1知磺基水杨酸铜络合比为1,结合之前的论述知,可分别通过式(2)、(4)、(5)来求出其表现稳定常数K稳,相关结果见表3。然而,K稳是和实验条件密切相关的,不能直接反映实验结果好坏,要判断此数值是否合理需要进一步计算出绝对稳定常数K,并与理论值进行比较。
相关计算公式如下:

[H+]为溶液氢离子浓度;H3L第一步是全部离解的,Ka2和Ka3分别是其第二和第三级离解常数,根据文献[7]知Ka3= 10−11.6,Ka2= 10−2.6。
与理论值相比知,根据式(2)得到的K稳误差较大,这是由于计算K稳时采用配体的总浓度cL而非平衡浓度c[L]所导致。根据式(4)、式(5)所得结果一致,也与理论值较为接近,表明摩尔比法可用这两个公式来计算K稳。
2.3 磺基水杨酸铜溶液定容前后pH差别与稳定常数的计算
由式(6)、式(7)可知,通过实验数据计算得到的CuL绝对稳定常数大小与溶液pH密切相关。实验中发现尽管溶液已调节到指定pH (例如4.70),定容所用的硝酸钾也是同样的pH,但在定容后,溶液的pH会发生升高的现象(例如7号溶液定容前是4.70,定容后测得5.00)。这是由于配合物溶液定容前后浓度变化导致其解离度也发生了变化,从而影响了溶液pH。由图1可知,稳定常数的计算所用数据是以E′数据为基础的,E′在图上很接近7号溶液对应的点,在此以7号溶液为例阐述配合物溶液pH在定容前后发生变化的原因:
H3L是一个三元酸,但它的第三级解离常数很小(Ka3= 10−11.6,用NaOH标准溶液滴定时,只能与前两级解离的H+反应形成一个突跃)[8],因此,它与铜离子在一定pH下发生反应如下:

在调节7号溶液pH到4.70后,烧杯中溶液总体积为12 mL左右,此时CuL浓度为c0,解离度为α0;将溶液定容于50 mL容量瓶后,CuL浓度被稀释为0.25c0,此时解离度变为α1。CuL浓度在定容后变小了,导致α1>α0,也就是定容后有更多的CuL发生了式(9)的逆反应,消耗了溶液中的部分氢离子,从而使得溶液pH从4.70上升为5.00。pH不同,计算得到的绝对稳定常数也有差别。从表4的lgK值与理论值9.52相比知,在计算绝对稳定常数的时候,应采用定容后的pH。

表4 通过定容前后pH计算绝对稳定常数的差别
3 结语
本文采用摩尔比法测定磺基水杨酸铜组成与稳定常数。通过实验发现,在铜离子浓度一定的前提下,5-磺基水杨酸浓度大于等于铜离子浓度四倍时,配合物溶液的吸光度达到最大值并基本维持不变。实验还发现配制系列配合物溶液过程中,由于定容前后体积发生变化,其解离度也发生变化,从而导致定容前后的配合物溶液pH不同,在计算绝对稳定常数时,应采用定容后的pH。
实验通过摩尔比法测得磺基水杨酸铜在pH为5时络合比为1,然而其表现稳定常数K稳不能通过式(2)计算,可由式(4)或式(5)求得。由式(4)求得其绝对稳定常数lgK= 9.63,与理论值9.52接近,表明本文设计的摩尔比法测定磺基水杨酸铜组成与稳定常数的实验方案可行。
