菊三七致大鼠肝毒性血清胆汁酸的靶向代谢组学研究
2021-09-26李云鹤苟小军王夏雷李修龙贾益群
李云鹤, 苟小军, 陈 龙, 王夏雷, 李修龙, 贾益群*
(1.上海中医药大学科技实验中心分析测试室,上海 201203;2.上海市宝山区中西医结合医院中心实验室,上海 201900)
菊三七又名土三七,为菊科菊三七属植物菊叶三七Gynurasegetum(Lour.) Merr.的根或全草,具有破血散瘀,消肿止血等功效,始载于《滇南本草》中,长期大量服用可引起肝小静脉损伤,近年来广受人们的关注与重视[1]。
胆汁酸(Bile acids)是以胆固醇为基本原料,在肝脏中通过一系列酶促反应合成的一类胆烷酸的总称,是胆汁的主要成分[2]。有研究表明,机体内胆汁酸代谢与肝、肠系统密切相关,胆汁酸在合成、排泄过程中,会经过肝脏的生物生化和生物物理这两大屏障[3],在其代谢和排泄受阻时,就会大量淤积于肝脏中,致使肝脏受损,进而导致线粒体受损及肝细胞凋亡和坏死[4]。因此研究胆汁酸代谢变化对肝毒性中药、肝损伤机制的研究有极其重要的意义。
代谢组学是运用多种技术手段探究生物体系中小分子代谢物的种类、数量和变化规律的一门科学[5-6],主要基于高通量分析仪器对机体代谢产物如血浆和尿液等进行定性和定量分析[7-9]。代谢组学分为靶向和非靶向代谢组学[10],在以往的研究中主要是以非靶向代谢轮廓分析为主,即应用各种分析技术对生物体内源性小分子代谢产物进行无歧视全扫描,以获得大量的多维的代谢组学数据信息,寻找生物体样本中各组分的动态变化规律;而靶向代谢组学是对特定的几个或几类代谢物群针对性的检测与分析,在经过非靶向代谢组学研究发现差异代谢物后,再以标准品作为参照,利用靶向代谢组学进一步进行验证与分析[11]。
根据课题组前期的研究,在基于LC-MS的基础上,通过分析菊三七致肝毒性大鼠血清、肝脏和尿液中的内源性代谢物,从而得出结论,菊三七致大鼠肝毒性的作用机制可能与甘油磷脂、胆汁酸等代谢紊乱有关[12-13]。本文将进一步深入探究菊三七致大鼠肝毒性与血清胆汁酸之间的联系。
1 材料
1.1 动物 健康雄性Sprague-Dawley(SD)大鼠,体质量150~170 g,采购于上海斯莱克实验动物有限公司,实验动物生产许可证号SCXK(沪)2017-0005,饲养于上海中医药大学实验动物中心,饲养室温度为22~25 ℃,相对湿度45%~70%,光照周期12 h/12 h,饲养期间可自由获取水和食物。18只SD大鼠随机分为空白组、高剂量组、低剂量组,每组6只,高剂量组和低剂量组分别给与15、7.5 g/(kg·d)的菊三七水煎剂,连续给药10 d。
1.2 药材 菊三七采摘于湖北省武汉市黄陂区木兰湖周家湾,经上海中医药大学中药学院崔亚君副教授鉴定为菊科植物菊三七的根块。根据文献[14-15],通过煎煮配制质量浓度为1.5 g/mL的菊三七水煎剂。
1.3 试剂 胆酸(CA,批号K1325088)、鹅去氧胆酸(CDCA,批号H1716012)、去氧胆酸(DCA,批号H1725076)、甘氨胆酸(GCA,批号H1520042)、甘氨脱氧胆酸(GDCA,批号1721065)、猪去氧胆酸(HDCA,批号K1715026)、石胆酸(LCA,批号D1712091)、牛磺胆酸(TCA,批号F1729023)、牛磺鹅去氧胆(TCDCA,批号SLBH9352)、牛磺脱氧胆酸(TUDCA,批号H1511086)、熊去氧胆酸(UDCA,批号E1715044)购自上海阿拉丁生化科技股份有限公司;甘氨鹅脱氧胆酸(GCDCA,批号F1 218 A,大连美仑生物技术有限公司);甘氨熊去氧胆酸(GUDCA,批号BCBM2974V,美国Sigma-Aldrich公司);牛磺猪去氧胆酸(THDCA,批号AZ1050,临沂艾泽拉斯生物科技有限公司)。甲醇(国药集团有限公司,批号M1203AS,色谱纯);甲酸(上海安普实验科技有限公司,批号3208k240,色谱纯);乙酸铵(美国霍尼韦尔有限公司,批号BCBR1129V,分析纯)。
1.4 仪器 超高相色谱仪(UPLC,美国Waters公司)-三重四级杆5500 LC-MS/MS(Triple Quad,美国AB SCIEX公司);TARGINTMVX-Ⅱ多管漩涡振荡器(北京踏锦科技有限公司);1730R冷冻高速离心机(德国Gene公司);TBA-40FR全自动生化分析仪(日本Toshiba公司);TP1020全自动脱水机、EG1160自动包埋机、RM2135切片机(德国Leica公司);FA2004N电子天平(上海精密科学仪器有限公司);Milli-Q纯水机(上海默瑞生物科技有限公司)。
2 方法
2.1 生物样品采集
2.1.1 血清 末次给药后于晚上开始禁食12 h,第二天进行大鼠腹主动脉取血4 mL,4 ℃静置1 h,3 500 r/min离心15 min后取上清液100 mL,于全自动生化检测仪上检测ALT、AST、ALB、TBIL水平。
2.1.2 肝脏组织 大鼠处死后取肝组织,分离得肝大叶立即置于10%福尔马林溶液中固定,制备石蜡切片后进行HE染色,光镜下观察肝组织形态学变化。
2.2 对照品溶液配制 精密称取各对照品5 mg,置于10 mL量瓶中,加甲醇溶液溶解至刻度线,摇匀,即得储备液,保存于4 ℃冰箱中备用。精密移取储备液,甲醇稀释成500、200、100、50、20、10、5、0.5 ng/mL,用于标准曲线绘制。
2.3 样品处理 取大鼠血清100 mL,加入300 mL甲醇,涡旋1 min后,12 000 r/min离心10 min,取上清于进样瓶中进样分析。
2.4 LC-MS/MS分析
2.4.1 色谱条件 Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);流动相0.1%甲酸(含10 mmol/L醋酸铵)(A)-甲醇(B),梯度洗脱(0~1.0 min,45% A;1~9 min,45%~20%A;9~11.4 min,20%~10%A;11.4~14.0 min,10%A;14.0~14.1 min,10%~45%A;14.1~17 min,45%A);体积流量0.3 mL/min;柱温45 ℃;进样量2 μL。
2.4.2 质谱条件 电喷雾电离(ESI),负离子模式,多级反应模式监测(MRM);毛细管电压2.8 kV;锥孔电压55.0 V;离子源温度120 ℃;去溶剂化温度350 ℃;去溶剂化气流600 L/h;锥孔气流5.0 L/h。

3 结果
3.1 菊三七对大鼠血清生化指标影响 如表1所示,与空白组比较,高、低剂量组TBA、ALT、AST、TBIL均升高(P<0.05),其中高剂量组ALT、TBIL均高于低剂量组(P<0.01);而高剂量组的TBA则低于低剂量组(P<0.01)。

表1 菊三七不同给药剂量对大鼠血清生化指标影响
3.2 肝组织病理切片 如图1所示,空白组肝细胞正常;高剂量组肝细胞呈现大面积出血性坏死;低剂量组肝细胞有炎细胞浸润,细胞间隙变大,有少部分出血性坏死;高剂量组肝损伤程度较低剂量组更大。
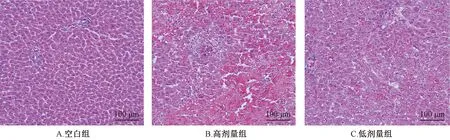
图1 大鼠肝组织HE染色病理切片(×200)
3.3 血清胆汁酸分析 在连续给药10 d后,高、低剂量组与空白组比较结果如表2所示。随着给药剂量的增加,部分胆汁酸的浓度有着明显的上升趋势,其中高、低剂量组的CA、CDCA、GCA、GUDCA、TCA、TCDCA、TUDCA、THDCA都升高(P<0.05);高剂量与低剂量比较,CA、CDCA、DCA、HDCA、TCDCA、TUDCA、THDCA均有差异(P<0.05),且低剂量组比高剂量组至少升高2到3倍以上。以上结果表明,在一定的天数内随着给药剂量的增加,高、低剂量组血清中部分胆汁酸都升高,但低剂量组血清胆汁酸水平更高,这与低剂量的TBA高于高剂量的结果一致,提示菊三七致肝毒性与以上胆汁酸水平有一定的相关性。
表2 菊三七不同给药量下14种血清胆汁酸水平
3.4 多元分析
3.4.1 PCA分析 采用非监督模式的PCA分析方法,将空白组和高、低剂量组进行比较分析,以胆汁酸浓度为X变量,组别为Y组,如图2所示。高、低剂量组和空白组经PCA分析能较完全分离,提示大鼠血清中14种胆汁酸已发生代谢紊乱。图2中空白组与低、高剂量组比较,R2X分别为0.605、0.627、0.659、0.612,说明该PCA模型能解释样本间代谢差异。
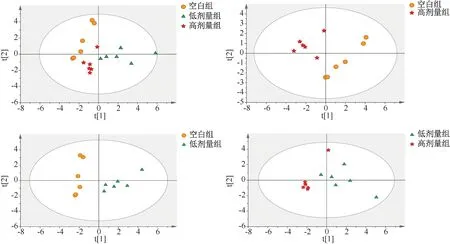
图2 大鼠血清胆汁酸样本PCA分析
3.4.2 OPLS-DA分析 为反应不同组别之间的差异关系,更好地对模型进行解释,进一步采用监督性的正交偏最小二乘法判别分析(OPLS-DA),本分析对模型进行200次置换检验,分别对大鼠血清胆汁酸样本构建OPLS-DA模型,对高、低剂量组和空白组之间进行模型分析,结果如图3所示,空白组与高、低剂量组在OPLS-DA图上能完全分离,方便下一步差异代谢物的寻找。根据计算结果显示,图3中R2Y分别为0.966、0.956、0929,Q2分别为0.874、0.899、0.504,表明该模型的拟合度和预测能力较好。

图3 大鼠血清胆汁酸样本OPLS-DA得分图及其置换检验
3.5 筛选差异代谢物 通过上述OPLS-DA的分析结果,根据变量权重值VIP>1的标准进行筛选,并结合P<0.05的标准,筛选差异代谢物。高剂量组与空白组比较,差异代谢物有5个,分别为DCA、TCA、TCDCA、TUDCA和THDCA;低剂量组与空白组比较,差异代谢物有7个,分别为CDCA、GCA、GUDCA、TCA、TCDCA、TUDCA和THDCA;高剂量组与低剂量组比较,差异代谢物有5个,分别是CDCA、DCA、HDCA、TUDCA和THDCA。
4 讨论
胆汁酸代谢在肝损伤疾病的发生与发展中有着越来越重要的作用,是用于诊断肝功能及肝脏疾病的一类敏感的标志物[16]。Márcia等[17]通过研究发现脂肪性肝炎患者体内的CA、CDCA和DCA水平显著性升高。而胆汁酸是一类双亲性分子,可分为疏水性和亲水性,其中疏水性胆汁酸主要有CA、CDCA、DCA、LCA和GCDCA[18]。有研究认为疏水性胆汁酸蓄积可促进肝细胞损伤、凋亡或坏死[19]。本实验通过检测大鼠血清中14种胆汁酸的水平,探究不同剂量下大鼠血清胆汁酸的变化。结果表明,在一定时间内,随着给药剂量升高,菊三七致肝毒性也逐渐增强,其中DCA、CDCA在大鼠血清中浓度显著增高,与文献报道结论一致。可推测菊三七给药已造成大鼠肝损伤,同时引起肝脏吸收和排泄功能障碍,最终使得血清中胆汁酸浓度升高。加上DCA、CDCA为疏水性胆汁酸会进一步加重肝损伤,从而导致肝细胞的凋亡或坏死。给药后大鼠血清胆汁酸升高,进一步推测菊三七致大鼠肝损可能是与胆汁酸在体内淤积有关,通过病理切片的观察,可知在一定的时间下,菊三七给药量和肝损伤严重程度成正比关系。
虽然高、低剂量组的胆汁酸浓度均高于空白组,但高剂量组的血清胆汁酸浓度均低于低剂量组,且生化指标TBA的检测中发现,高剂量组的TBA值同样比低剂量组的低,由此猜测可能是由于高剂量组对大鼠肝损伤较为严重,反而抑制了体内胆汁酸的合成,这与陈楚颖等[20]研究中发现当胆汁酸水平上升后会反馈性调控胆汁酸的合成、排泄基因的表达,进而维持胆汁酸的稳态的研究结果相印证。Jia[21]等人的研究中也同样表明胆汁酸合成会受到FXR的负反馈性调节机制的影响,正是通过这种负反馈性机制的调节从而限制了胆汁酸在肝脏中积累,提示高浓度肝毒性药物对肝脏损害较严重,进而激活了体内FXR,从而导致胆汁酸合成能力下降,虽然总胆汁酸合成能力有所下降,但是体内胆汁酸水平仍高于正常组,最终造成胆汁酸淤积。
综上所述,本文通过对大鼠血清中14种胆汁酸进行靶向代谢组学研究,发现在一定给药时间内,不同给药剂量的菊三七对大鼠血清中胆汁酸浓度有一定影响。应用t检验和多元统计分析,由结果发现CDCA、GCA、DCA、HDCA、GUDCA、TCA、TCDCA、TUDCA和THDCA在给药菊三七后会发生一定的变化,且随着给药剂量增加菊三七肝毒性也在增加,提示这些胆汁酸可作为菊三七致大鼠肝毒性的潜在标志物。
5 结论
本实验在前期研究基础上,采用菊三七水煎剂灌胃给药法建立大鼠肝损伤模型,应用LC-MS/MS对大鼠血清样本进行14种胆汁酸水平检测,利用代谢组学的研究方法对数据进行分析处理,找寻菊三七致肝损伤的潜在标志物。结论,菊三七致肝损伤可能与大鼠体内胆汁酸紊乱与淤积有关,通过数据分析发现大鼠给药菊三七后,体内CDCA、GCA、DCA、HDCA、GUDCA、TCA、TCDCA、TUDCA和THDCA受影响较大,这表明这些胆汁酸可作为菊三七致大鼠肝损伤的潜在标志物。同时,该研究为毒性中药的研究提供了新的研究思路与方法。
