P2X4受体介导小胶质细胞促进肠易激综合征内脏痛脊髓中枢敏化及大建中汤干预作用
2021-09-26李尧锋王俊霞杨莎莎
武 静, 王 慧, 杨 毅, 李尧锋, 王俊霞, 杨莎莎
(1.贵州中医药大学基础医学院,贵州 贵阳 550025;2.贵州中医药大学第一附属医院五官科,贵州 贵阳 550002)
肠易激综合征(irriTab.bowel syndrome,IBS)是以反复腹痛为主要发病特征的功能性胃肠道疾病[1]。以往学者对IBS内脏痛的研究多集中在神经元[2],而忽视了在神经系统中也发挥重要作用的小胶质细胞。课题组前期研究发现大建中汤可以降低内脏高敏感,从而减轻腹痛[3-4]。本次实验通过观察大鼠脊髓腰骶段BDNF蛋白,及ox42和P2X4受体表达情况,进而揭示大建中汤治疗IBS内脏痛的神经调剂机制,为IBS内脏痛的药物治疗提供新的作用靶点和治疗方向。
1 材料
1.1 药物 大建中汤中的蜀椒、干姜、人参由贵州中医药大学第一附属医院药剂科提供,经贵州中医药大学汪毅教授鉴定为正品。按《金匮要略》原方,蜀椒二两(6 g)、干姜四两(12 g)、人参二两(6 g),配伍后制成1.5 g/mL质量浓度的水浸液;匹维溴铵片(美国Mylan Laboratories SAS公司,批号H20160396,规格50 mg/片);佐剂液态铝(美国Pierce公司,批号QD218415A);卵清白蛋白(OVA,美国Sigma公司,批号052K1275)。
1.2 动物 SPF级SD大鼠,雌鼠12只,雄性6只,体质量150~170 g,由达硕生物科技有限公司提供,实验动物使用许可证号SYXK(川)2013-24。自由饮食1周后,为使雌鼠有效怀孕,分别将2只雌鼠和1只雄鼠放在一笼,雌鼠怀孕后再分开喂养。待乳鼠出生后,选择体质量为(6.42±0.57)g的48只雄性未断乳乳鼠作为实验对象。
1.3 试剂 注射用戊巴比妥钠(美国SCRC公司,批号WS20060401,规格0.5 g);ox42(英国Abcam公司),二步法免疫组化试剂盒(北京中杉金桥公司,PV-6001、PV-6002),DAB显色剂(北京博奥森有限公司);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号P0009);预染蛋白Marker(美国Thermofisher公司,批号26617);底物化学发光(ECL)试剂盒(美国Affinity公司,批号KF001);聚偏二氟乙烯(PVDF)膜(美国Hybond公司);聚丙烯酰胺电泳(PAGE)凝胶快速制备试剂盒(上海雅酶生物科技有限公司,批号PG112);大鼠P2X4、BDNF多克隆抗体和生物素化山羊抗鼠免疫球蛋白G(IgG)(H+L)[艾博抗(上海)贸易有限公司,批号ab59246、ab5079];兔抗甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体(上海研谨生物科技有限公司,批号GXP199629)。无水乙醇(江苏海兴化工有限公司,批号GB678-90),PBS磷酸盐缓冲液(北京中杉金桥生物技术有限公司,批号ZLI-9062);蒸馏水自制。
1.4 仪器 电热蒸馏水器(武汉格莱莫检测设备有限公司,型号HS.Z68.5);垂直电泳槽(北京君意东方电泳设备有限公司,型号JY-JX5L);电泳仪(北京六一生物科技有限公司,型号DYCZ-25E);石蜡切片机(德国莱卡公司,型号RM2135);恒温水浴锅(上海胜卫电子科技有限公司,型号J-HH-4A);光学显微镜(日本Nikon公司,型号80i);图片成像系统(美国Bio-Rad公司,型号MIAS2000)。
2 方法
2.1 分组与给药 将48只雄性未断乳乳鼠喂养第2天随机分为6组,每组8只,分别为正常对照组、模型组、匹维溴铵组(阳性对照,根据文献[5]方法设置剂量为0.045 g/kg)和大建中汤高、中、低剂量组(10.8、5.4、2.7 g/kg,分别根据人每千克体质量临床用量的14、7、3.5倍剂量)。造模成功后第2天,各组大鼠均按0.1 mL/10 g灌胃给药相应药物(溶剂均为纯净水),正常对照组和模型组大鼠灌胃等量纯净水,每天1次,连续14 d。
2.2 模型制备 除正常组母子同笼正常饮食外,其余各组根据文献[6]改良制备IBS内脏痛大鼠模型。从出生第2天起母婴分离3 h/d(8:00~11:00),期间不予哺乳;第8~21天增加0.5%乙酸直肠内刺激,每天1次,每隔2 d增加0.1 mL,直至0.5 mL为止,正常组等量生理盐水灌肠。至第22天起,正常饲养至第41天;第42、46天腹腔注射30 mg/mL OVA 1 mL,正常组注射等量PBS;第47~57天正常喂养,至此完成造模;第58天通过腹壁撤退反射(abdominal withdrawal reaction,AWR)评价肠道敏感度,以模型组AWR评分高于正常组(P<0.05)为造模成功。
2.3 腹壁撤退反射(AWR)检测 检测时分别给予各组大鼠80、60、40、20 mmHg压力,评价结肠扩张导致的大鼠反应情况。1次扩张时间为20 s,重复6次,每次间隔4 min,取6次平均值。给予刺激时评分标准参照文献[7],即0分,大鼠情绪稳定;1分,偶有扭动头部;2分,腹背部肌肉轻微收缩;3分,腹背肌肉收缩的基础上出现腹部抬离地面;4分,腹部高离地面致使腹部呈弓状。
2.4 取材 AWR检测完成后采用腹腔注射戊巴比妥钠(0.4%,10 mL/kg)麻醉各组大鼠,迅速切开腹腔,暴露脊髓段取腰骶段(L6~S2),置于4%甲醛溶液中4 ℃固定12 h。
2.5 免疫组化染色检测ox42表达 脊髓组织的石蜡切片经脱蜡、水化后用3%双氧水孵育10 min,PBS冲洗2 min×3次。滴加一抗兔抗鼠多克隆抗体ox42(1∶200)37 ℃孵育2 h,PBS冲洗2 min×3次。滴加二抗山羊抗兔IgG抗体-HR多聚体PV-6001和山羊抗小鼠IgG抗体-HR多聚体PV-6002,37 ℃孵育30 min,PBS冲洗2 min×3次。DAB显色,苏木素复染。常规脱水、透明、封片,各组取10张切片,应用软件采集分析图像。每张切片随机选取5个400倍视野,观察阳性细胞数。
2.6 Western blot检测P2X4、BDNF蛋白表达 将脊髓腰骶段剪成碎片裂解匀浆,离心(4 ℃、12 000 r/min,10 min)后提取上清液,用BCA蛋白定量试剂盒检测蛋白浓度,蛋白经变性、上样、电泳、转膜后,将PVDF膜加入适量封闭液,放入相应的一抗溶液,37 ℃恒温水浴摇床上封闭2 h,摇床上洗膜3次,将洗好的PVDF膜放于配制好的二抗溶液,摇床上孵育2 h再洗膜;采用ECL显色,并根据不同显影光强度调整曝光条件用图片分析软件进行扫描分析,以目的蛋白与β-actin密度比值作为待测目的蛋白相对表达量。

3 结果
3.1 大鼠一般状况 正常组大鼠进食正常,毛发光泽,行动灵活;造模大鼠毛发失去光泽,行动迟缓,喜好扎堆,收腹、舔舐腹部等现象;灌服大建中汤和匹维溴铵后,大鼠进食和毛发恢复正常,舔舐腹部现象消失。
3.2 大建中汤对IBS内脏痛大鼠模型腹痛的影响 与正常组比较,模型组AWR评分在60、40、20 mmHg压力下增加,肠道痛觉上升(P<0.05,P<0.01),证明成功造模;与模型组比较,AWR评分在40、20 mmHg压力下,匹维溴铵组,大建中汤高、中剂量组减少(P<0.05,P<0.01),降低模型大鼠肠道痛觉;与匹维溴铵组比较,在40 mmHg压力下的AWR评分,大建中汤高剂量组治疗效果要优于匹维溴铵组(P<0.05)。见表1。

表1 大建中汤对各组大鼠AWR评分的影响(分,
3.3 大建中汤对IBS内脏痛模型大鼠脊髓腰骶段ox42阳性表达的影响 ox42阳性出现棕黄色颗粒,主要定位在细胞胞质中,少量定位在细胞核中。与正常组比较,模型组ox42个数增加(P<0.01);与模型组比较,匹维溴铵组,大建中汤高、中剂量组ox42个数降低(P<0.01),大建中汤低剂量组ox42个数降低(P<0.05)。见表2、图1。
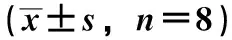
表2 大建中汤对各组大鼠ox42阳性表达的影响
图1 大建中汤对各组大鼠ox42阳性表达的影响(IHC,×400)Fig.1 Effects of Dajianzhong Decoction on positive expression of ox42 in rats of various groups (IHC,×400)
3.4 大建中汤对IBS内脏痛模型大鼠脊髓腰骶段P2X4、BDNF的影响 与正常组比较,模型组P2X4、BDNF蛋白水平增加(P<0.01);与模型组比较,匹维溴铵组,大建中汤高、中剂量组P2X4、BDNF蛋白水平降低(P<0.01),大建中汤低剂量组P2X4、BDNF蛋白水平降低(P<0.05)。见表3、图2。
表3 大建中汤对IBS内脏痛模型大鼠P2X4、BDNF蛋白的影响
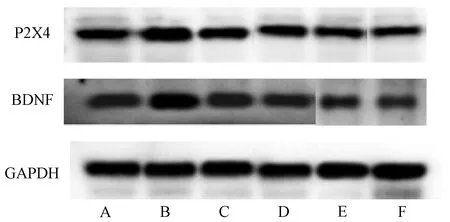
注:A为正常组,B为模型组,C为大建中汤低剂量组,D为大建中汤中剂量组,E为大建中汤高剂量组,F为匹维溴铵组。图2 大建中汤对IBS内脏痛模型大鼠P2X4、BDNF蛋白的影响Fig.2 Effects of Dajianzhong Decoction on P2X4 and BDNF proteins in IBS rat models with visceral pain
4 讨论
随着人们对IBS内脏痛的认识逐渐加深,有学者提出了神经-免疫-内分泌网络失调机制[8],但因发病机制仍未明确,临床尚未有特效药。中医学将IBS归纳为“腹痛”“泄泻”等范畴,虽病位在肠,但其本在脾,故证候类型多归纳为脾虚证或脾阳虚证[9]。中医学认为其病位在脾胃,病因有气滞、感寒、血凝、虫积等,病机为脾胃虚寒,运化乏力,气血不足“不荣则痛”及气机阻滞,气血经脉运行不畅“不通则痛”。《金匾要略》记载的大建中汤是治疗腹痛的经典方剂,针对腹痛病位在脾胃,脾胃虚寒之证。临床研究也表明大建中汤能够治疗多种急慢性内脏痛,疗效确切[10]。
因IBS病因复杂,所以本实验通过母婴分离方法造成新生期大鼠早期负性生活事件导致其成年后内脏痛觉敏化;采用乙酸刺激损伤结直肠黏膜造成大鼠内脏高敏感性;再利用卵清白蛋白腹腔注射方式使其侵入损伤的肠道致敏等,建立更符合IBS实际情况的综合性动物模型。本实验结果表明,造模大鼠出现行动迟缓、收腹、舔舐腹部、肛周污浊等IBS内脏痛症状。同时,IBS模型大鼠内脏敏感性增加(P<0.05,P<0.01),符合IBS临床特点。因而本实验模型具有较理想的临床实用意义。
AWR评分是IBS内脏痛的主要检测手段。本次研究结果表明,IBS内脏痛大鼠AWR评分在3个扩张压力均有升高,表明模型大鼠肠道在长期的伤害性刺激下形成IBS慢性内脏痛,由于中枢以及外周的双重疼痛敏化,大鼠痛阈降低,痛行为表现明显。与模型组比较,经大建中汤治疗后,大鼠AWR评分在3个扩张压力下均降低,趋于正常。表明大建中汤能够使IBS内脏痛大鼠痛阈升高,疼痛行为改善,提示大建中汤对内脏痛大鼠有明显的镇痛作用。实验中40 mmHg压力下AWR评分,大建中汤组优于匹维溴铵组,这可能与大建中汤的多靶点镇痛作用有关。前期研究中[11],课题组发现大建中汤可通过抑制神经递质五羟色胺(5-HT)产生和释放,下调神经递质5-HTP(5-羟基色氨酸)、5-HIAA(5-羟基吲哚酸)水平,从而达到镇痛作用,而匹维溴铵针对上述疼痛靶点的作用尚未相关报道。
腹腔内结直肠等器官均通过副交感盆神经投射至脊髓腰骶段[12],有学者研究发现,脊髓腰骶段传入神经纤维数目在IBS慢性内脏痛大鼠模型中明显增多,这提示脊髓腰骶段可能参加了IBS慢性内脏痛的中枢敏化过程[13]。因此,本实验选取IBS慢性内脏痛模型大鼠脊髓腰骶段(L6~S2)作为研究对象。
ox42是小胶质细胞的特异性免疫标记物,仅表达于该细胞表面上,既可以作为其活化的指标,又可以标记小胶质细胞[14-15]。本研究发现,模型组大鼠脊髓腰骶段ox42阳性表达较正常组增加(P<0.01),大建中汤高、中、低剂量组ox42阳性表达平与模型组比较降低(P<0.01),表明IBS内脏痛大鼠脊髓腰骶段小胶质细胞活化,大建中汤能够抑制模型组大鼠脊髓腰骶段小胶质细胞活化。研究发现在神经病理性疼痛中,小胶质细胞和P2X4受体在脊髓背角活化明显,这一过程很可能参与了痛敏异常的发生[16]。虽然神经病理性痛与慢性内脏痛发病机制有所不同,但这却为本实验研究IBS内脏痛提供了新的思路。本次实验研究发现模型组大鼠脊髓腰骶段P2X4受体比正常组表达升高(P<0.01),且大建中汤能够降低模型组P2X4受体表达。有研究发现,P2X4受体仅在小胶质细胞上表达[17]。由此推测,很可能P2X4受体介导了小胶质细胞参与IBS内脏异常痛觉的产生,其过度表达导致了IBS慢性内脏痛敏的发生。
有研究发现在P2X4受体被激活后,会诱发p38MAPK蛋白激酶(p38丝裂原活化蛋白激酶)活化,从而引发细胞释放大量的各种细胞因子,激活神经元引起中枢痛觉高敏状态[18]。本次实验结果与上述研究一致,本研究发现在IBS内脏痛大鼠腰骶段BDNF蛋白表达比正常组有升高(P<0.01),且大建中汤能够抑制模型组BDNF表达。由此推测,在IBS内脏痛时小胶质细胞活化后释放的BDNF很可能是上述生物活性因子之一。这与Long等[19]发现的外周损伤可能是通过活化小胶质细胞上P2X4受体,使BDNF合成增加进而诱发痛敏异常的研究结果一致。
本研究提示,在IBS内脏痛大鼠脊髓腰骶段小胶质细胞及其表面上P2X4受体均显著活化,使BDNF合成和释放增多,从而BDNF可能作用于神经元,最终导致了IBS内脏痛中枢痛觉高敏状态。大建中汤可能通过抑制P2X4受体介导小胶质细胞活化,进而阻止小胶质细胞合成和释放BDNF,降低内脏痛觉高敏状态。但是BDNF在IBS内脏痛中如何作用于神经元,其内脏中枢敏化机制还有待进一步研究。
