HPLC法同时测定赶黄草中4种成分
2021-09-26史鹏杰程嘉希黄豆豆董志颖孙连娜
史鹏杰, 程嘉希, 黄豆豆, 董志颖, 孙连娜
(上海中医药大学中药学院,上海 201203)
赶黄草为虎耳草科扯根菜属植物扯根菜PenthorumchinensePursh的干燥地上部位,别名扯根菜、水杨柳、水泽兰,具有利水除湿、祛瘀止痛的作用,常用于治疗黄疸、经闭、水肿跌打损伤等症[1],以其为原料的单方制剂在临床中多用于治疗慢性乙肝、急性病毒性肝炎等症[2-4],在治疗、保护肝损伤等方面也有较多研究报道[5-11]。根据文献调研结果,赶黄草中主要化学成分为黄酮、木脂素及酚酸,一些萜类、酯类、挥发油类等成分也均有报道[12]。目前,2020年版《中国药典》中尚未收载赶黄草的质量标准,地方质量标准仅要求槲皮素含量不少于0.1%,但该成分在赶黄草中含量低,不具备专属性,无法作为质量标志物来评价药材品质。乔松素-7-O-β-D-葡萄糖苷具有较好的抗肝损伤活性[13],同时连有多个没食子酰基且成环的多酚类成分,pinocembrin-7-O-[4″,6″-(S)-hexahydroxydiphenoyl]-β-D-glucose、pinocembrin-7-O-[3″-O-galloyl-4″,6″-(S)-hexahydroxydiphenoyl]-β-D-glucose、thonningianin A亦具有较好的抗肝纤维化活性[7]。此外,亦有报道上述大环多酚具有一定的降糖活性[8],具有成为赶黄草质量标志物的潜力。在此基础上,本研究建立了HPLC法同时测定赶黄草中上述4种活性成分的含量,以期更加全面科学地对其质量进行评价。
1 材料
1.1 仪器 Agilent 1200型高效液相色谱仪(美国Agilent公司);XS105DU 电子天平、XS104 电子天平(瑞士Mettler-Toledo公司);Centrifuge 5810R高速台式冷冻离心机(德国Eppendorf 公司);Milli-Q超纯水净化仪(美国Millipore公司);N-1300旋转蒸发仪(东京理化器械株式会社);SY-360H超声仪、HWS-24恒温水浴锅(上海诚献仪器设备有限公司)。
1.2 药物与试剂 乔松素-7-O-β-D-葡萄糖苷对照品(自制,纯度≥98%,批号20181117)、pinocembrin-7-O-[4″,6″-(S)-hexahydroxydiphenoyl]-β-D-glucose对照品(自制,纯度≥98%,批号20181117)、TH A对照品(自制,纯度≥98%,批号20181103)、pinocembrin-7-O-[3″-O-galloyl-4″,6″-(S)-hexahydroxydiphenoyl]-β-D-glucose对照品(自制,纯度≥98%,批号20181103)。甲酸(色谱纯,德国Merck公司);水(超纯水,Milli-Q超纯水净化仪制备);乙醇、甲醇(分析纯,上海泰坦科技有限公司);乙腈(色谱纯,美国Thermo Fisher Scientific公司)。赶黄草信息见表1,经上海中医药大学孙连娜副教授鉴定为虎耳草科扯根菜属植物扯根菜PenthorumchinensePursh的干燥地上部分,保存于上海中医药大学中药资源与生物技术研究中心。
表1 样品信息
2 方法与结果
2.1 色谱条件 Agilent ZORBAX SB-C18色谱柱(4.6 mm × 250 mm, 5 μm);流动相0.5%甲酸水(A)- 乙腈(B),梯度洗脱(0~10 min,28%~30%B; 10~20 min,30%~36%B; 20~22 min, 36%~39%B; 22~30 min, 39%~40%B; 30~35 min, 40%~90%B; 35~37 min, 90%~28%B; 37~40 min, 28%B);体积流量1 mL/min;柱温30 ℃;检测波长280 nm;进样量10 μL。
2.2 对照品贮备液制备 取各对照品粉末适量,精密称定,置于10 mL量瓶中,加80%甲醇制备成乔松素-7-O-β-D-葡萄糖苷、pinocembrin-7-O-[4″,6″-(S)-hexahydroxydiphenoyl]-β-D-glucose、pinocembrin-7-O-[3″-O-galloyl-4″,6″-(S)-hexahydro-xydiphenoyl]-β-D-glucose、thonningianin A质量浓度分别为0.302 0、 0.600 8、 0.598 4、 0.499 2 mg/mL的溶液,即得。
2.3 供试品溶液制备 取药材适量,粉碎,过3号筛,取约1.0 g,精密称定,置于250 mL圆底烧瓶中,精密加入80%甲醇100 mL,密塞,称定质量,回流提取1 h,放凉,用80%甲醇补足减失质量,摇匀,滤过,取续滤液,即得。
2.4 专属性考察 在“2.1”项色谱条件下,上述溶液及空白溶液的色谱图见图1。由此可知,供试品溶液中4种成分色谱峰保留时间与对照品溶液一致,空白溶液于相同保留时间处无干扰,表明该方法专属性良好。

1.乔松素-7-O-β-D-葡萄糖苷 2.pinocembrin-7-O-[4″,6″-(S)-hexahydroxydiphenoyl]-β-D-glucose 3.pinocembrin-7-O-[3″-O-galloyl-4″,6″-(S)-hexahydroxydiphenoyl]-β-D-glucose 4.thonningianin A1.pinocembrin-7-O-β-D-glu coside 2.pinocembrin-7-O-[4″,6″-(S)-hexahydroxydiphenoyl]-β-D-glucose 3.pinocembrin-7-O-[3″-O-galloyl-4″,6″-(S)-hexahydroxydiphenoyl]-β-D-glucose 4.thonningianin A图1 各成分HPLC色谱图Fig.1 HPLC chromatograms of various constituents
2.5 线性关系考察 精密移取对照品贮备液适量,逐级稀释,依次制得6个质量浓度,在“2.1”项色谱条件下进样。以待测成分质量浓度为横坐标 (X),峰面积为纵坐标(Y)进行回归,结果见表2,表明各成分在各自范围内线性关系良好。

表2 各成分线性关系
2.6 精密度试验 精密吸取对照品溶液10 μL,在“2.1”项色谱条件下进样6次,测得乔松素-7-O-β-D-葡萄糖苷、pinocembrin-7-O-[4″,6″-(S)-hexahydroxydiphenoyl]-β-D-glucose、pinocemb-rin-7-O-[3″-O-galloyl-4″,6″-(S)-hexahydroxydi-phenoyl]-β-D-glucose、thonningianin A峰面积RSD分别为0.17%、1.15%、0.18%、0.12%,表明仪器精密度良好。
2.7 稳定性试验 取药材(S13),按“2.3”项下方法制备供试品溶液,于0、4、8、12、24 h在“2.1”项色谱条件下进样,测得乔松素-7-O-β-D-葡萄糖苷、pinocembrin-7-O-[4″,6″-(S)-hexahydroxydiphenoyl]-β-D-glucose、pinocembrin-7-O-[3″-O-galloyl-4″,6″-(S)-hexahydroxydiphen-oyl]-β-D-glucose、thonningianin A峰面积RSD分别为1.21%、2.04%、0.81%、0.68%,表明供试品溶液在24 h内稳定性良好。
2.8 重复性试验 取药材(S13),按“2.3”项下方法制备供试品溶液,平行6份,在“2.1”项色谱条件下进样,测得乔松素-7-O-β-D-葡萄糖苷、pinocembrin-7-O-[4″,6″-(S)-hexahydroxydi-phenoyl]-β-D-glucose、pinocembrin-7-O-[3″-O-galloyl-4″,6″-(S)-hexahydroxydiphenoyl]-β-D-glucose、thonningianin A峰面积RSD分别为1.32%、1.02%、0.90%、0.48%,表明该方法重复性良好。
2.9 加样回收率试验 取药材(S13)1.0 g,精密称定,按100%水平加入对照品,按“2.3”项下方法制备供试品溶液,平行6份,在“2.1”项色谱条件下进样,计算回收率。结果,乔松素-7-O-β-D-葡萄糖苷、pinocembrin-7-O-[4″,6″-(S)-hexahydroxy-diphenoyl]-β-D-glucose、pinocembrin-7-O-[3″-O-galloyl-4″,6″-(S)-hexahydroxydi-phenoyl]-β-D-glucose、thonningianin A平均加样回收率分别为101.30%、102.04%、100.90%、101.55%,RSD分别为2.54%、0.88%、0.82%、1.43%。
2.10 样品含量测定 取13批药材适量,按“2.3”项下方法制备供试品溶液,在“2.1”项色谱条件下进样,计算含量,结果见表3。
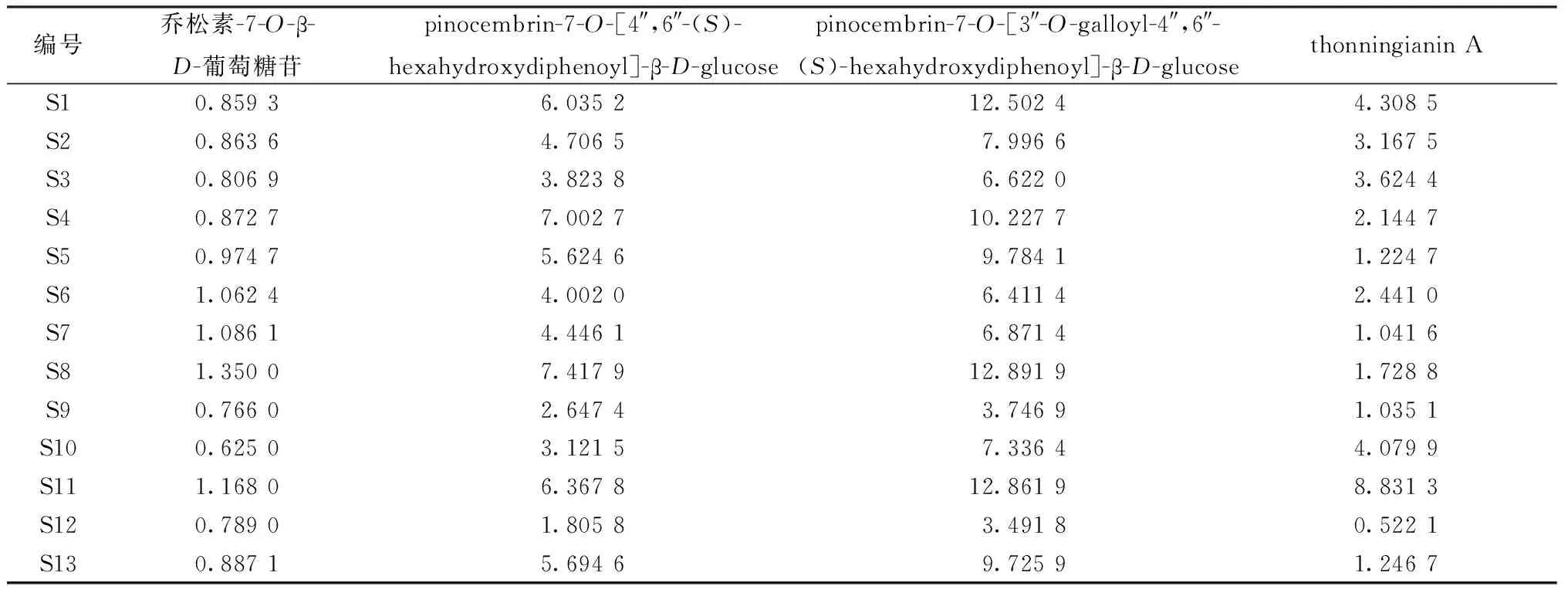
表3 各成分含量测定结果(mg/g,n=3)
3 讨论
取“2.2”项下对照品溶液,稍作稀释,在“2.1”项色谱条件下进行全波长(200~400 nm)扫描,结果显示280 nm处各待测成分均有较好吸收,而且基线平稳,故以其作为检测波长。对不同公司提供的Diamonsil C18(4.6 mm×250 mm, 5 μm)、Waters Atlantis® T3(4.6 mm×250 mm, 5 μm)、Agilent ZORBAX SB-C18(4.6 mm×250 mm, 5 μm),在不同流动相组合(甲醇-水、乙腈-水、乙腈-0.2%甲酸水、乙腈-0.5%甲酸水)下的洗脱效果进行比较,最终选择分离效果好、重复性佳的Agilent ZORBAX SB-C18色谱柱、乙腈-0.5%甲酸。对3种常见的提取方法(超声、回流、冷浸)进行考察,比较各待测成分峰面积,发现回流法提取效果最佳,提取完全,故确定其为供试品溶液提取方法。采用不同体积分数甲醇为提取溶剂,比较各待测成分峰面积,发现80%甲醇提取最为完全,故选择其为供试品溶液提取溶剂。比较不同回流提取次数下各成分峰面积,综合提取效果、考虑耗时、溶剂消耗,选择提取次数为1次,随后考察不同提取时间下各成分峰面积,最终选择60 min。
4 结论
本实验建立了HPLC法测定赶黄草中4种成分的含量,发现在不同产地、批次药材中均存在一定差异,其中乔松素-7-O-β-D-葡萄糖苷含量相对稳定,其他3种波动较大,该结果可为赶黄草的质量评价提供参考。
