血清人帕金森蛋白7及溶血磷脂酸与急性缺血性脑卒中斑块稳定性的相关性
2021-09-26佟攀峰
佟攀峰
(西平县人民医院 神经内二科,河南 驻马店 463900)
颈动脉粥样硬化斑块是急性缺血性脑卒中(acute ischemic stroke,AIS)重要的病理基础,也是AIS发生的重要危险因素,因而评估斑块的性质对预防AIS具有一定的意义。目前评估斑块性质主要依靠影像学,但由于辐射、操作者技术等因素的干扰,导致临床运用有局限性[1]。多项研究发现,颈动脉粥样硬化斑块的形成与炎症反应、纤溶系统异常等关系密切[2-3]。血清人帕金森病蛋白(Parkinson disease protein,PARK)7具有抗氧化应激能力,参与炎症反应[4]。溶血磷脂酸(lysophosphatidic acid,LPA)参与机体凝血、血栓形成进程,因而其水平变化可能与AIS患者的颈动脉粥样硬化斑块形成、发展等相关[5]。鉴于此,本研究旨在探讨血清PARK7、LPA表达与AIS患者斑块稳定性的相关性。
1 资料与方法
1.1 一般资料选取2019年1月至2021年1月西平县人民医院收治的120例AIS患者作为研究对象。(1)纳入标准:①符合AIS相关诊断标准[6]且经头颅CT或MRI检查确诊;②初次发作且发作至入院时间<24 h;③未进行溶栓或介入治疗;④患者签署知情同意书。(2)排除标准:①合并心房颤动、心脏瓣膜病疾病;②合并贫血、出血性疾病;③发病前1周使用抗血小板药物治疗;④颅内血管畸形、存在炎症;⑤合并感染性疾病、风湿免疫性疾病。本研究经西平县人民医院医学伦理委员会审核批准通过。
1.2 评估方法
1.2.1斑块稳定性评估方法及分组 采用DC-80迈瑞彩色多普勒超声仪检测患者入院时双侧颈动脉,探头频率8~12 HMz,患者取仰卧位,头向后仰且稍微偏向检测的对侧位置,从颈根部开始探查,依次向上探查双侧颈总动脉、颈内动脉,若发现斑块,短轴切面测量最大的动脉内膜中层厚度(intima-media thickness,IMT),同时观察斑块的位置、形态、性质等,彩色多普勒超声观察斑块表面、内部血流情况等。参照美国心脏协会制定的相关标准[7],根据斑块的形态学及超声特征将患者分为无斑块组、稳定组、不稳定组。其中IMT>1.2 mm表示斑块形成;若斑块回声低于外模回声为软斑;强回声伴声影为硬斑;与外模回声相等为中等回声斑;同时含有2种或2种以上成分为混合斑块。软斑与混合斑块归为不稳定斑块,硬斑与中等回声斑归为稳定斑块。
1.2.2血清PARK7、LPA水平检测方法 患者入院后取其空腹肘静脉血2~3 mL,以3 500 r·min-1速率离心15 min,离心半径为13.5 cm,取上清液,保存于-80 ℃环境中,采用免疫比浊法检测血清PARK7、LPA水平,试剂盒购自北京利德曼生化股份有限公司。
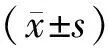
2 结果
2.1 斑块稳定性情况120例患者中,不稳定性斑块42例,占35.00 %(42/120),稳定性斑块40例,占33.33 %(40/120),无斑块38例,占31.67 %(38/120)。
2.2 不同颈动脉斑块性质患者一般资料不稳定组血清PARK7、LPA水平高于稳定组、无斑块组,差异有统计学意义(P<0.05),稳定组与无斑块组血清PARK7、LPA水平比较,差异无统计学意义(P>0.05);3组其他一般资料比较,差异无统计学意义(P>0.05)。见表1。
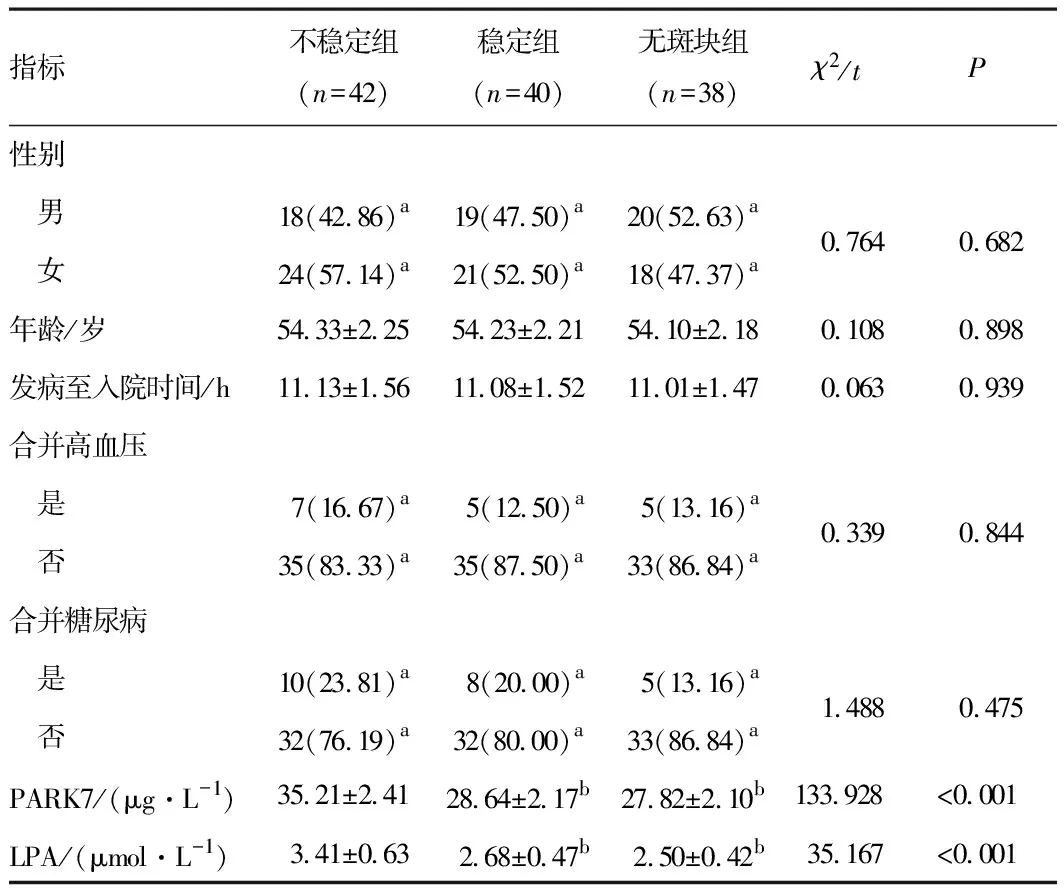
表1 不同颈动脉斑块性质患者一般资料比较
2.3 血清PARK7、LPA表达对AIS患者斑块稳定性的影响将血清PARK7、LPA水平作为自变量,将AIS患者斑块性质作为因变量(1=不稳定,0=稳定、无斑块),经logistic回归分析结果显示,血清PARK7、LPA高表达的AIS患者颈动脉斑块不稳定的风险较高(OR>1,P<0.05)。见表2。
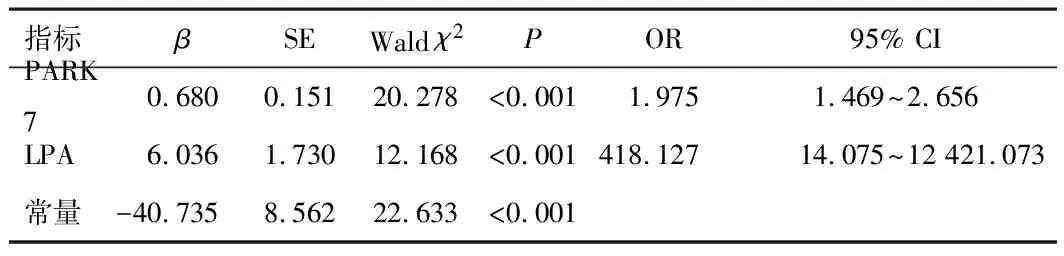
表2 血清PARK7、LPA表达对AIS患者斑块稳定性的 影响分析结果
2.4 AIS患者血清PARK7、LPA表达的相关性经双变量Pearson相关性检验分析显示,AIS患者血清PARK7与LPA水平呈正相关(r=0.632,P<0.001)。散点图见图1。

PARK7为人帕金森病蛋白7;LPA为溶血磷脂酸;AIS为急性缺血性脑卒中。
3 讨论
动脉粥样硬化是脑血管疾病重要的风险因素,根据病理学可将其病灶分为稳定斑块与易损斑块,而易损斑块的破裂是引起脑血管意外事件的主要原因。因而预测斑块的性质对预防AIS具有一定的作用。
早期主要依靠影像学技术评估动脉粥样硬化斑块的性质,但价格昂贵或具有辐射,因而存在局限性。由于氧化应激反应、微血栓的形成可促进粥样斑块的发生、发展,增加斑块不稳定的风险,因而相关指标与AIS患者的斑块稳定性可能具有一定关系。本研究结果显示,不稳定组血清PARK7、LPA水平高于稳定组、无斑块组,提示AIS患者出现斑块不稳定时血清PARK7、LPA水平呈高表达。分析其原因可能是,PARK7是一种氧化应激反应蛋白,对神经具有保护作用,可借助氧化应激而发生活化,而氧化应激反应可促使AIS患者斑块形成,PARK7水平越高提示内皮功能损伤越严重,因而发生斑块不稳定的风险较高[8]。LPA是血小板活化的分子标志物,水平升高可引起血小板形态改变和聚集,形成血栓,而血栓形成可导致血管狭窄,进而增加狭窄处斑块脱落的风险,且血栓可延伸进入纤维帽,导致纤维帽内巨噬细胞、炎症细胞进一步增多,引发易损斑块破裂,因而LPA水平越高斑块越不稳定[9]。因此AIS患者斑块不稳定时PARK7、LPA呈高表达。
本研究进行logistic回归分析发现,血清PARK7、LPA高表达的AIS患者颈动脉斑块不稳定的风险较高,可能是由于血清PARK7通过氧化应激反应参与斑块的形成,其高表达可加重炎症进程,导致斑块不稳定;LPA具有激活基质金属蛋白酶的作用,基质金属蛋白酶可降解多种细胞外基质成分,导致纤维帽变薄,而纤维帽的厚度与斑块稳定性呈正相关,因而LPA水平越高,斑块越不稳定[10]。再次证实了血清PARK7、LPA高表达与AIS患者颈动脉斑块稳定性密切相关。此外,本研究经相关性检验发现,AIS患者血清PARK7与LPA水平呈正相关,提示AIS患者血清PARK7与LPA水平可能具有一定的关系,可能是二者均可参与动脉粥样硬化的发生、发展进程,但具体机制仍需进一步探讨。
综上所述,血清PARK7、LPA表达与AIS患者斑块稳定性密切相关,血清PARK7、LPA水平高表达,提示患者斑块不稳定的风险较高。
