人参皂甙Rg3下调树突状细胞IDO杀伤小鼠肾癌细胞的实验研究
2021-09-26黄艳琴袁佳蕾余艳容彭珊珊郭红燕胡银英
黄艳琴,袁佳蕾,余艳容,彭珊珊,张 咏,郭红燕,胡银英
(1.江西省医学科学院抗肿瘤研究室; 2.江西省中医药大学附属医院肾内科,南昌330006)
树突状细胞(DC)是专职的抗原提呈细胞,IDO在其内的表达可抑制DC的表型和功能,主要表现为对细胞因子的反应降低,进而抑制T细胞的免疫反应[1]。传统的体外修饰DC的抗肿瘤疫苗通常采用肿瘤实体抗原、合成的肿瘤抗原致敏DC,以及肿瘤相关基因修饰DC,其虽有一定的抗肿瘤作用,但依然存在不足,如DC功能障碍、DC无能等[2]。因此,提高DC抗肿瘤的能力,完善DC疫苗的治疗效果是学者们共同关心的热点。人参皂苷Rg3是一种已被确认具有明显抗肿瘤作用的人参活性单体成分[3]。本研究采用人参皂苷Rg3作用小鼠肾癌RAG细胞株裂解物致敏的DC,探讨人参皂苷Rg3增强DC的抗原提呈能力,以及激活CTL抗肿瘤的作用机制。
1 材料与方法
1.1 动物与试剂
SPF级别C57BL/6小鼠,雄性,体重16~18 g,周龄6~8周,SPF级别BALB/C小鼠,雄性,体重16~18 g,周龄6~8周,购自湖南长沙斯莱克实验动物有限责任公司;小鼠肾癌细胞RAG细胞株,购自中国科学院细胞库。人参皂甙Rg3纯度>99%购自大连福生制药厂。
1.2 实验方法
1.2.1 DC的诱导与培养
将C57小鼠脱颈椎处死,浸泡于碘伏液消毒5 min;无菌状态下取双侧股骨,离断骺端,用注射针头破坏骨小梁后用无血清1640液反复抽吸冲洗髓腔,收集骨髓悬液,用0.5 mL红细胞裂解液重悬破坏红细胞,室温下静置5 min,加无血清1640稀释,离心洗涤2遍,弃上清,用10%FBSRPMI1640±20 ng·mL-1、GM-CSF±20 ng·mL-1IL-4 DC诱导培养体系重悬细胞,分别加入Rg3,进行实验分组,隔天进行半量换液。
1.2.2 实验分组
1)Control组(C组):普通DC诱导培养体系;2)G10组:DC诱导培养体系加人参皂苷Rg3至10 μg·mL-1;3)G20组:DC诱导培养体系加人参皂苷Rg3至20 μg·mL-1;4)G50组:DC诱导培养体系加人参皂苷Rg3至50 μg·mL-1。
1.2.3 DC的形态学观察及表型鉴定
倒置显微镜下观察DC生长过程及形态变化;收集培养6、9、11 d后DC,4组分别用0.01 M PBS洗涤2次,用200 μL 0.01 M PBS溶液重悬,而后各加5 μL anti-CD11c PE、anti-CD80PE-Cy5和anti-CD86 PE、MHC-Ⅱ-FITC,C组不加抗体;混合后4 ℃ 冰箱中避光反应半小时,上流式细胞仪进行样品测定分析。
1.2.4 RAG抗原致敏Rg3-DC
将对数生长期的小鼠肾癌细胞(RAG),调整细胞密度为1×107mL-1,置液氮反复冻融6次后制备成肿瘤抗原,加入培养5 d的Rg3-DC细胞中,溶度为100 μg·mL-1,继续培养24 h。收集DC细胞悬液,PBS洗涤3次,此细胞即为RAG抗原致敏Rg3-DC。
1.2.5 提取总RNA,QPCR检测IDO的表达效率
收集经RAG抗原致敏后各组Rg3-DC细胞,提取总RNA,QPCR检测IDO的表达[4]。
1.2.6 RAG抗原致敏Rg3-DC诱导T细胞增殖与激活实验
从BALB/C小鼠脾脏分离出T淋巴细胞,致敏Rg3-DC计数后调整细胞浓度,使致敏Rg3-DC和T细胞比分别为:1:10、1:50、1:100,加入96孔板中共培养,100 μL·孔-1,每组设个3复孔,并设刺激细胞对照孔(只加致敏Rg3-DC,100 μL·孔-1)和反应细胞对照孔(只加T细胞100 μL·孔-1)。96孔板置37 ℃、5%CO2孵箱中培养,72 h后取出96孔培养板,加入含有10 μL CCK-8的培养液100 μL,置孵箱中孵育4 h后,在波长490 nm处测其OD值,计算致敏Rg3-DC对CTL细胞增殖的影响,并优选出DC/T混合培养的最佳比例;收集DC与T细胞共培养上清液,用ELISA试剂盒检测IL-12、IFN-γ表达水平。
1.2.7 CCK-8法
采用CCK-8法检测CTL对靶细胞的杀伤能力。收集经RAG抗原致敏Rg3-DC激活各组T细胞(选择DC/T 1:10混合培养的比例),各组计数定量,取对数生长期的(RAG)与T细胞比分别为:1:10、1:20、1:40,各50 μL加入96孔板,37 ℃、5%CO2孵箱中培养,24 h后加入含有10 μLCCK8的培养液100 μL,置孵箱中孵育4 h后,在波长490 nm处测其OD值[5]。
1.2.8 统计学方法

2 结果
2.1 DC表面分子标志物鉴定
DC培养至6 d时,大多数细胞表面出现突起,细胞培养液中可见少许较大体积的悬浮细胞,表面粗糙,有明显丝状突起,G10、G20、G50组可看见更明显变化。
用FCM检测DC表面分子标志物结果显示,MHC-Ⅱ的表达差异无统计学意义(P>0.05);CD80的表达:6 d时随着人参皂苷Rg3的浓度的增加而上升,9 d时Rg3 20 μg·mL-1作用浓度下CD80的表达最高(P<0.05);CD86的表达:在Rg3 20 μg·mL-1作用浓度下达到高峰,且在培养9 d时达到最高值;CD11c的表达:G50组在6、9 d时高于其他3组,11 d时低于其他3组;在6 d时G20组高于C组和C10组,11 d时G20组低于于C组和C10组。表1—4。
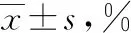
表1 表1 各组不同时间点DC细胞的MHCⅡ表达率
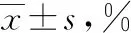
表2 各组不同时间点DC细胞的CD86表达率
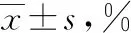
表3 各组不同时间点DC细胞的CD80表达率
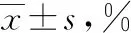
表4 各组不同时间点DC细胞的CD11c表达率
2.2 DC细胞中IDO的表达及沉默
取培养6 d后抗原致敏的人参皂苷Rg3-DC细胞检测IDO的表达,QPCR结果显示,G10、G20组人参皂甙Rg3,明显低于C组(P<0.05);C组与G50组比较差异无统计学意义(P>0.05)。见表5。

表5 Rg3诱导后的DC细胞IDO表达
2.3 Rg3-DC对CTL细胞增殖作用
Rg3-DC与同种异体小鼠脾脏T细胞混合培养,通过CCK-8检测结果,筛选出DC与T细胞最佳混合培养的比例为1:10,G10、G20、G50组Rg3-DC与T细胞混合培养72 h后,CCK-8检测各组淋巴细胞,以证实其浓度关系。结果显示:与C组相比G10、G20组淋巴细胞增殖明显增多(P<0.05);C组与G50组比较差异无统计学意义(P>0.05)。见表6。

表6 各组CTL细胞的OD值
2.4 Rg3-DC对CTL细胞免疫功能的影响
用ELISA法检测上述混合细胞培养上清中IL-12、IFN-γ表达水平,结果显示各组IL-12、IFN-γ的表达水平随着Rg3浓度的升高而升高(P<0.05)。见表7—8。

表7 各组CTL细胞IL-12的表达水平

表8 各组IFN-γ的表达水平
2.5 CTL对体外培养的RAG细胞的杀伤作用
根据CCK-8结果,设置DC:T比为1:10,Rg3-DC诱导CTL细胞与RAG细胞共培养24 h,发现同一效靶比时,Rg3-DC诱导G10、G20、G50组杀伤肿瘤的能力明显强于C组,其中G20组的杀伤能力最高(P<0.05)。见表9。
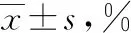
表9 Rg3-DC诱导的CTL对肾癌细胞的抑制率
3 讨论
人参皂甙Rg3是人参的有效成分,为我国开发并拥有完全自主知识产权的第一个中药单体Ⅰ类抗癌新药。Rg3具有抗氧化、抗炎和抗癌活性,对肿瘤细胞有诱导凋亡、抑制增殖、逆转多药耐药等作用[2,6]。Rg3能够诱导肿瘤细胞凋亡[7-8],选择性抑制肿瘤细胞黏附和浸润,抗肿瘤侵袭转移[9-10],抑制肿瘤新生血管形成[11-13],调节机体免疫功能[14-15],增强肿瘤化疗患者外周血淋巴细胞的免疫功能,升高其外周血NK细胞的表达活性,增强机体非特异性免疫功能等作用[16],因此,被认为是一种免疫增强剂。前期研究[17]也证实,人参皂甙Rg3具有促进树突状细胞分化成熟及刺激淋巴细胞的增殖等作用,并能诱导NKM45人胃癌细胞凋亡。
DC是一种功能极强的抗原提呈细胞,在免疫应答中居于重要地位[16]。因此,当机体免疫系统被激活时,DC促进机体生成CTL细胞和Th细胞,并产生免疫应答。由DC激活的CTL介导的细胞免疫应答对恶性肿瘤的发生、发展及预后发挥着极其重要的作用。DC功能缺陷或数量减少均与恶性肿瘤的发生发展密切相关[18],当肿瘤患者体内可能存在DC分化成熟障碍,导致DC在细胞因子表达、激活T细胞增殖及成功诱导CTL等方面出现程度不同的功能缺陷。
IDO是一种免疫调节酶,可催化色氨酸分子中吲哚环氧化裂解,从而沿犬尿酸途径分解代谢,DC是唯一能够激活初始型T细胞的抗原提呈细胞,但LPS或者TNF-α等可刺激其表达IDO,并通过降解色氨酸,使局部组织中的色氨酸耗竭,代谢产物犬尿氨酸含量增加,从而抑制T细胞的增殖,故DC表面表达IDO可能在诱导免疫逃逸中起着重要的作用[19-20],提示优化DC是提高DC抗原提呈功能的有效措施。本研究用Rg3联合细胞因子下调DC中的IDO表达,促进DC成熟,使得DC捕捉抗原的能力及激活CTL的能力增强,结果显示,随着Rg3浓度的升高CTL对肿瘤细胞的杀伤作用也越来越高,其机制可能是Rg3诱导DC有效地提呈抗原给CTL细胞,使CTL细胞所分泌的促使CTL细胞分泌抗肿瘤细胞因子IFN-γ和IL-12,再进一步促进T细胞克隆增殖,强化Thl型免疫应答反映抑制肿瘤的生长。本实验检测到Rg3诱导后DC的IDO表达效率有明显下降,启动更加有效的免疫反应,故推测Rg3在一定浓度范围内可诱导DC活性增强的具体机制可能与其引起IDO表达效率下降有关。
DC可以高表达MHC-Ⅰ类和MHC-Ⅱ类分子,MHC分子与其捕获加工的肿瘤抗原结合,形成肽-MHC分子复合物,并递呈给T细胞,从而启动MHC-I类限制性CTL反应和MHC-Ⅱ类限制性的CD4+Thl反应。本实验中Rg3诱导的DC所表达的MHC-Ⅱ在前9 d与C组相比都要高,这也说明Rg3促进了DC分化,MHC-Ⅱ的增强使DC获得更强的抗原摄取能力,更有利于刺激CTL的免疫反应,因此说明一定浓度的Rg3能够刺激诱导DC的成熟,能够更积极地启动T细胞的免疫反应。
总之,通过优化树突状细胞的靶向和抗免疫逃逸方法制备肿瘤疫苗,诱导产生抗原特异性CTL,为肿瘤患者进行主动免疫和过继性细胞免疫治疗提供实验数据,也为中药参与肿瘤的生物治疗奠定理论基础。
