沉默LncRNA TUG1通过上调miR-214-5p表达增加乳腺癌细胞的放射敏感性
2021-09-25孙露阳葛锁华彭俊华江苏大学附属金坛医院检验科常州213200
孙露阳 葛锁华 彭俊华 周 红(江苏大学附属金坛医院检验科,常州213200)
乳腺癌是威胁女性生命安全的恶性肿瘤之一,随着现代社会节奏的加快,乳腺癌发病率逐年上升,已严重影响患者生活质量[1]。目前乳腺癌的治疗方式为手术并辅以放疗或化疗,但术后患者预后差且极易发生转移[2]。研究表明,长链非编码RNA牛磺酸上调基因1(long noncoding ribonucleic acid taurine up-regulated gene 1,LncRNA TUG1)可促进人乳腺癌细胞增殖和转移[3]。LncRNA TUG1和微小RNA-145(microRNA-145,miR-145)间的双负反馈环促进人膀胱癌细胞的上皮间充质转换和放射抵抗性[4]。下调LncRNA TUG1的表达可通过抑制HMGB1表达来增强膀胱癌的放射敏感性[5]。然而,TUG1对乳腺癌细胞放射敏感性的影响仍然未知。miR-214可通过靶向抑制ATG12及其介导的自噬作用增加结直肠癌的放射敏感性[6]。miR-214通过抑制自噬作用提高乳腺癌细胞对他莫昔芬和富维斯特的敏感性[7]。然而,miR-214对乳腺癌放射敏感性的影响仍未完全阐明。starBase预测发现,TUG1与miR-214-5p具有互补结合的核苷酸位点,提示TUG1可通过充当miR-214-5p的海绵分子调控乳腺癌细胞的放射敏感性。因此,本研究通过检测TUG1的表达及其对乳腺癌细胞的放射敏感性及细胞凋亡的调控作用,探究TUG1与miR-214-5p的靶向作用关系及其可能的作用机制,为乳腺癌诊疗及提高治疗效果提供理论依据。
1 材料与方法
1.1 材料 人乳腺上皮细胞MCF-10A与乳腺癌MCF-7细胞均自美国ATCC细胞库。RPMI1640培养基、胰蛋白酶、胎牛血清购自美国Gibco公司;Li‐pofectamine2000转染试剂购自美国Thermo Fisher公司;TUG1干扰质粒、miR-214-5p mimics、miR-214-5p抑制剂(anti-miR-214-5p)及其各自相应的阴性对照购自上海吉玛生物科技有限公司;细胞凋亡检测试剂盒购自美国Sigma公司;Trizol试剂、反转录试剂盒及SYBR Green PCR Master Mix试剂盒购自大连宝生物工程有限公司;双荧光素酶报告基因载体及其检测荧光素酶活性试剂购自美国Promega公司。
1.2 方法
1.2.1 研究对象及放射敏感性判定 选取2015年4月至2016年3月于本院就诊的45例乳腺癌患者为研究对象,所有患者均经手术病理证实为乳腺癌,年龄为42~65岁,平均为(55.26±5.36)岁。纳入标准:临床分期为Ⅲ~Ⅳ期;病理学诊断为乳腺浸润性导管癌;患者入组前均未接受任何治疗;接受放化疗并接受放化疗后的临床评估;临床资料完整。排除标准:合并其他恶性肿瘤者;患有自身免疫性疾病者;肝、肾等重要组织器官严重损害者;依从性较差者。乳腺癌放射敏感性判定:根据放疗后病灶变化情况进行判定,放疗后原发肿瘤或部分肿瘤未出现未控及复发患者作为放射敏感组(25例),肿瘤未控及出现肿瘤复发患者作为放射抵抗组(20例),所有患者均于手术中切取乳腺癌组织,迅速放入液氮中,术后转移至−80℃超低温冰箱保存。
1.2.2 放射抵抗的乳腺癌细胞MCF-7R的建立取对数生长期的乳腺癌MCF-7细胞,使用200 cGy射线照射细胞,37℃、5%CO2培养箱继续培养,每隔24 h更换1次培养液,待存活的细胞处于对数生长期时进行传代培养,当细胞稳定传代后进行400 cGy射线照射细胞,重复上述步骤,依次给予600 cGy、800 cGy、1000 cGy射线照射细胞,当累积剂量达到1200 cGy时筛选具有稳定放射抵抗性表型的乳腺癌细胞系MCF-7R,MCF-7R细胞进行常规培养,待细胞稳定传代5代后进行后续实验。
1.2.3 细胞照射、转染及分组 人乳腺上皮细胞MCF-10A与乳腺癌MCF-7细胞、MCF-7R细胞培养于含10%胎牛血清与青霉素-链霉素混合溶液的RPMI1640培养基,置于恒温培养箱培养,取生长良好的细胞按照实验要求用不同剂量的X射线照射,照射条件为100 cm的源靶距,10 cm×10 cm的照射野,5 Gy/min的剂量率。同时取生长状态良好的MCF-7R细胞,胰蛋白酶消化细胞,调整细胞浓度为2×105个/ml,接种于6孔板,待细胞培养细胞浓度达到80%左右参照Lipofectamine2000转染试剂说明书进行转染,将TUG1干扰表达质粒(TUG1 siRNA)及其阴性对照干扰质粒转染至MCF-7R细胞,分别记为沉默TUG1组(si-TUG1)、沉默对照组(si-control)。将miR-214-5p mimics及其相应阴性对照分别转染至MCF-7R细胞,分别记为过表达miR-214-5p组(miR-214-5p)、过表达miR-NC组(miR-NC),将miR-214-5p抑制剂(anti-miR-214-5p)及其阴性对照分别与TUG1 siRNA共转染至MCF-7R细胞,分别记为沉默TUG1+抑制miR-NC组(si+TUG1+anti-miR-NC)、沉默TUG1+抑制miR-214-5p组(si-TUG1+anti+miR-214-5p)。转染前1 d将培养基更换为Opti-MEM减血清培养基,转染6 h后弃转染液并将细胞培养基更换为含10%胎牛血清的RPMI1640完全培养基,继续培养。转染后48 h用4 Gy剂量照射各组细胞,照射48 h后检测细胞凋亡。
1.2.4 实时荧光定量聚合酶链反应(qRT-PCR)检测TUG1、miR-214-5p表达 用Trizol试剂盒提取乳腺癌组织及各组细胞总RNA,测定RNA浓度,利用反转录试剂盒合成cDNA,反转录体系共12 µl:2 µg RNA(根据RNA浓度计算加入体积),1 µl oligo(dT),4 µl反应缓冲液,1 µl RNase抑制剂,2 µl dNTP,1 µl逆转录酶,ddH2O补足至12 µl。反应程序设定为65℃5 min,42℃1 h,70℃5 min,反转录得到cDNA,将cDNA置于−20℃冰箱保存。按照实时荧光定量PCR试剂盒配置qRT-PCR反应体系,反应体系共20 µl:SYBR 10 µl,正反向引物各0.8 µl,cDNA 1 µl,ddH2O补足至20 µl。置于实时荧光定量PCR仪检测,反应程序设定为95℃5 min,95℃30 s,60℃30 s,72℃30 s,共循环40次。采用2−ΔΔCt法计算TUG1与miR-214-5p的相对表达量。
1.2.5 细胞克隆实验 收集各组MCF-7与MCF-7R细胞,胰蛋白酶消化细胞后接种于6孔板,分别用0、2、4、6、8 Gy不同照射剂量照射细胞,实验均设置3次重复,置于恒温培养箱中培养,待细胞克隆生长出现细胞克隆团时,PBS洗涤10 min×3次,甲醇固定20 min,0.5%结晶紫染色15 min,置于显微镜下观察有效克隆数,使用GraphPad Prism 7软件单机多靶计算增敏比(SER),细胞克隆形成率=(有效克隆数/接种细胞)×100%,细胞存活分数=受照射细胞克隆形成率/对照细胞克隆形成率×100%。
1.2.6 细胞凋亡检测 转染后各组MCF-7R细胞经4 Gy剂量照射48 h,用预冷PBS洗涤细胞5 min×2次,加入1×Binding Buffer重悬细胞(100 µl),调整细胞密度(2×105个/ml),将195 µl细胞悬液加入检测管内,依次分别加入Annexin V-FITC 5 µl,避光孵育15 min,用200 µl的1×Binding Buffer洗涤细胞,4℃条件下,1000 r/min离心3 min,用190 µl的1×Binding Buffer重悬细胞,加入10 µl PI,避光孵育15 min,置于流式细胞仪检测细胞凋亡。
1.2.7 双荧光素酶报告基因实验 运用生物信息学数据库对TUG1可能吸附的miRNA进行预测,结果发现TUG1可能吸附miR-214-5p,将含有miR-214-5p结合位点的TUG13'UTR序列及其突变体插入荧光素酶报告基因载体中得到TUG1-Wt、TUG1-Mut,同 时 将MCF-7R细 胞 以1×105个/孔 接 种 于24孔板,待细胞生长融合度达80%左右时将miR-214-5p mimic或miR-NC与TUG1-Wt、TUG1-Mut分别共转染MCF-7R细胞,每组实验均设置3个复孔。放入恒温培养箱培养48 h后加入25 µl/孔1×Pas‐sive裂解缓冲液,室温静置15 min后以每孔加入20 µl裂解液的密度将其加入白板中,同时加入荧光素酶缓冲液(50 µl/孔),置于多功能酶标仪检测萤火虫荧光素酶活性。加入Stop&Glo(50 µl/孔),于多功能酶标仪检测海肾荧光素酶活性,以萤火虫荧光素酶活性值与海肾荧光素酶活性值的比值作为荧光素酶活性。
1.3 统计学处理 采用统计学软件SPSS21.0分析数据,实验数据以±s表示,两组间数据比较经正态性检验,服从正态分布采用t检验,多组间比较经方差齐性检验,采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 放射抵抗的乳腺癌组织和细胞中TUG1高表达 qRT-PCR检测放射敏感组与放射抵抗组患者乳腺癌组织中TUG1的表达水平。如图1A所示,放射抵抗组患者乳腺癌组织中TUG1的表达水平较放射敏感组明显升高(P<0.05)。细胞克隆形成实验结果显示,随着照射剂量的增加,MCF-7R细胞的存活分数与MCF-7细胞比较明显升高(P<0.05),见图1B。单击多靶模型参数值见表1,MCF-7R细胞增敏比(SER)为0.829。用qRT-PCR法进一步检测人乳腺上皮细胞MCF-10A及乳腺癌MCF-7细胞、乳腺癌放射抵抗MCF-7R细胞中TUG1的表达水平,如图1C所示,与MCF-10A相比,MCF-7细胞与MCF-7R细胞中TUG1的表达水平均明显升高(P<0.05),与MCF-7细胞相比,MCF-7R细胞中TUG1的表达水平显著升高(P<0.05)。
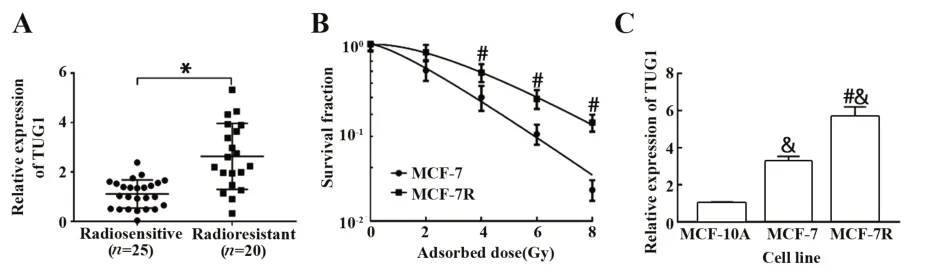
图1 放射抵抗的乳腺癌组织和细胞中TUG1的表达Fig.1 TUG1 expression in radioresistant breast cancer tissues and cells
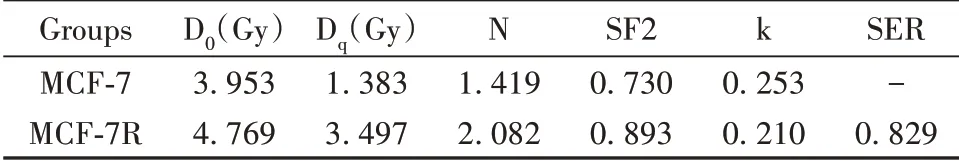
表1 乳腺癌MCF-7和MCF-7R细胞的单击多靶模型参数值Tab.1 Parameter values of single-click multi-target model for breast cancer MCF-7 and MCF-7R cells
2.2 沉默TUG1增加MCF-7R细胞的放射敏感性
利用瞬时转染技术将si-TUG1及其阴性对照转染至乳腺癌MCF-7R细胞,qRT-PCR验证转染效率,如图2A所示,沉默TUG1组乳腺癌MCF-7R细胞中TUG1的表达水平较沉默对照组明显降低(P<0.05),表明转染成功。细胞克隆实验检测沉默TUG1后乳腺癌MCF-7R细胞的放射敏感性,结果显示沉默TUG1组乳腺癌MCF-7R细胞存活分数较沉默对照组明显降低,见图2B,其中照射剂量为4 Gy时乳腺癌MCF-7R细胞存活分数出现显著差异,因此后续实验中以4 Gy照射细胞。沉默TUG1后MCF-7R细胞单击多靶模型的参数值见表2,沉默TUG1组乳腺癌MCF-7R细胞增敏比(SER)为1.440,表明沉默TUG1后可明显增加乳腺癌MCF-7R细胞放射敏感性。
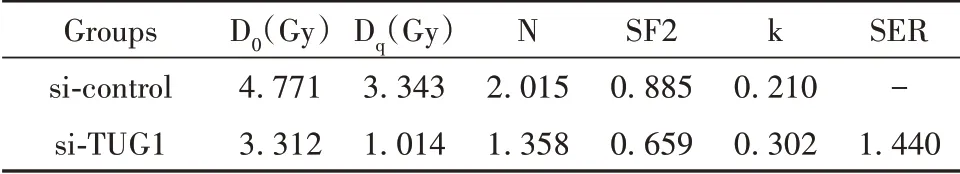
表2 沉默TUG1后MCF-7R细胞单击多靶模型的参数值Tab.2 Parameter values of MCF-7R cell click multi-tar⁃get model after silencing TUG1
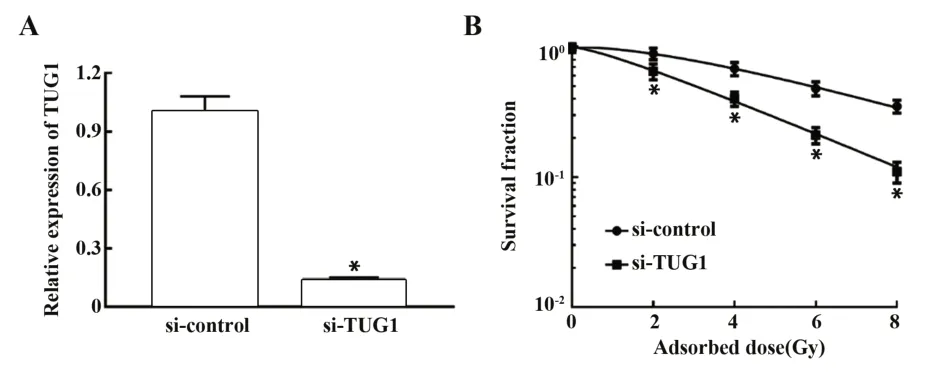
图2 沉默TUG1对MCF-7R细胞放射敏感性的影响Fig.2 Effect of silencing TUG1 on radiosensitivity of MCF-7R cells
2.3 沉默TUG1促进放射照射诱导的MCF-7R细胞凋亡 转染si-TUG1及其阴性对照后用4 Gy照射剂量照射MCF-7R细胞,分别为沉默对照+4Gy组、沉默TUG1+4Gy组。流式细胞仪检测经4 Gy照射后MCF-7R细胞的凋亡情况,如图3所示,与沉默对照组相比,沉默TUG1组、沉默对照+4Gy组MCF-7R细胞凋亡率均明显升高(P<0.05),与沉默对照+4Gy组相比,沉默TUG1+4Gy组MCF-7R细胞凋亡率明显升高(P<0.05)。表明沉默TUG1后可通过促进放射照射诱导的MCF-7R细胞凋亡进而增加乳腺癌细胞放射敏感性。

图3 沉默TUG1对辐射照射后MCF-7R细胞凋亡的影响Fig.3 Effect of silencing TUG1 on apoptosis of MCF-7R cells after radiation exposure
2.4 TUG1可吸附并调控miR-214-5p的表达 靶基因网站预测TUG1可能吸附的miRNA,结果发现TUG1可能靶向调控miR-214-5p,TUG1与miR-214-5p存在互补结合核苷酸位点,见图4A。通过双荧光素酶报告基因实验探讨TUG1是否可以直接靶向miR-214-5p,结果显示,与过表达miR-NC组相比,miR-214-5p过表达能够明显抑制野生型TUG1-Wt的荧光素酶活性(P<0.05),TUG1与miR-214-5p结合位点突变后,miR-214-5p过表达对突变型TUG1-Mut的荧光素酶活性无明显抑制效果(P>0.05),见图4B。qRT-PCR检测结果显示,沉默TUG1组乳腺癌MCF-7R细胞中miR-214-5p的表达水平较沉默对照组明显升高(P<0.05),见图4C。表明TUG1可靶向吸附miR-214-5p而抑制其表达。
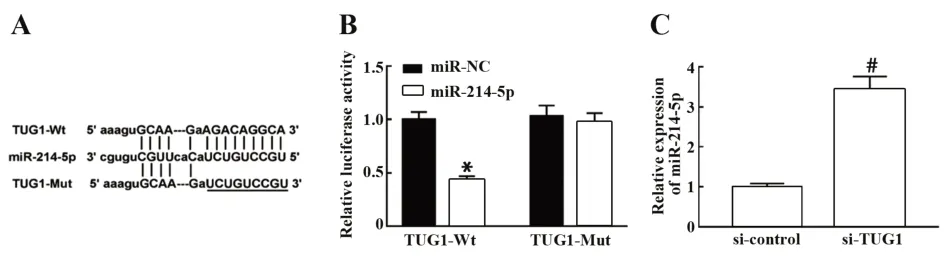
图4 TUG1可调控miR-214-5p的表达Fig.4 TUG1 can regulate expression of miR-214-5p
2.5 过表达miR-214-5p增加MCF-7R细胞的放射敏感性 qRT-PCR检测miR-214-5p在人乳腺上皮细胞MCF-10A及乳腺癌MCF-7、MCF-7R细胞中的表达水平,结果显示,与MCF-10A细胞相比,MCF-7、MCF-7R细胞中miR-214-5p表达水平均明显降低(P<0.05),与MCF-7细胞相比,MCF-7R细胞中miR-214-5p的表达水平明显降低(P<0.05),表明miR-214-5p表达水平的降低可能降低乳腺癌细胞放射敏感性(图5A)。将miR-214-5p mimics及其阴性对照转染至MCF-7R细胞,qRT-PCR验证转染效率,结果显示,过表达miR-214-5p组MCF-7R细胞中miR-214-5p的表达水平明显高于过表达miR-NC组(P<0.05,图5B)。细胞克隆形成实验结果显示,随着照射剂量的增加,过表达miR-214-5p组MCF-7R细胞存活分数较过表达miR-NC组明显降低(P<0.05,图5C),过表达miR-214-5p后MCF-7R细胞单击多靶模型的参数值见表3,过表达miR-214-5p组MCF-7R细胞增敏比(SER)为1.455。表明miR-214-5p过表达可增强乳腺癌细胞敏感性。流式细胞术检测miR-214-5p过表达后MCF-7R细胞凋亡情况,结果显示,与过表达miR-NC组相比,过表达miR-214-5p组与过表达miR-NC+4Gy组MCF-7R细胞凋亡率均明显增加(P<0.05),与过表达miR-NC+4Gy组相比,过表达miR-214-5p+4Gy组MCF-7R细胞凋亡率明显增加(P<0.05),见图5D。表明miR-214-5p过表达可通过促进放射诱导的乳腺癌细胞凋亡进而增加细胞放射敏感性。
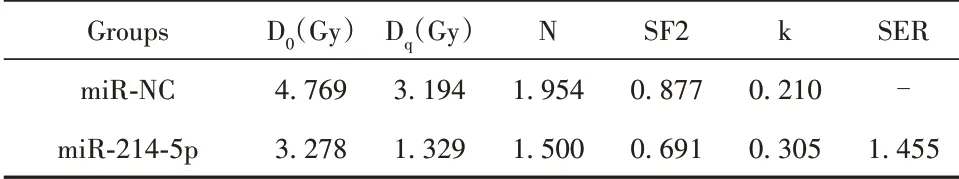
表3 过表达miR-214-5p后MCF-7R细胞单击多靶模型的参数值Tab.3 MCF-7R cell click multi-target model parameter values after overexpression of miR-214-5p
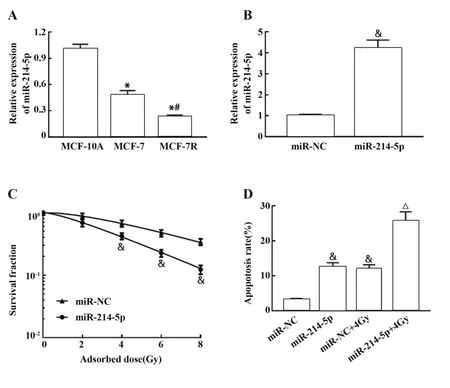
图5 过表达miR-214-5p对MCF-7R细胞放射敏感性的影响Fig.5 Effect of miR-214-5p overexpression on radiosensi⁃tivity of MCF-7R cells
2.6 抑制miR-214-5p可逆转沉默TUG1对MCF-7R细胞放射敏感性的影响 将si-TUG1与miR-NC共转染至MCF-7R细胞,si-TUG1与miR-214-5p抑制剂(anti-miR-214-5p)共转染至MCF-7R细胞,以验证TUG1是否通过抑制miR-214-5p表达进而降低乳腺癌细胞放射敏感性,细胞克隆形成实验结果显示,沉默TUG1+抑制miR-214-5p组MCF-7R细胞存活分数较沉默TUG1+抑制miR-NC组明显升高(P<0.05),见图6B。抑制miR-214-5p联合沉默TUG1后MCF-7R细胞单击多靶模型的参数值见表4,沉默TUG1+抑 制miR-214-5p组MCF-7R细 胞 增 敏 比(SER)为0.713,相较于沉默TUG1组明显降低。表明抑制miR-214-5p可逆转沉默TUG1对MCF-7R细胞放射敏感性的增强作用。流式细胞术检测结果显示,沉默TUG1+抑制miR-214-5p组MCF-7R细胞凋亡率较沉默TUG1+抑制miR-NC组明显降低(P<0.05),见图6C。表明抑制miR-214-5p可逆转沉默TUG1对放射诱导的乳腺癌细胞凋亡的促进作用。
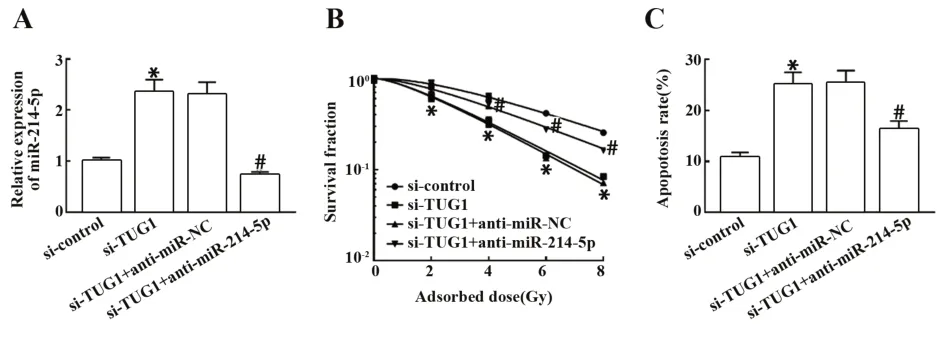
图6 抑制miR-214-5p联合沉默TUG1对MCF-7R细胞放射敏感性及放射诱导的细胞凋亡的影响Fig.6 Effect of miR-214-5p combined with silencing TUG1 on radiosensitivity of MCF-7R cells and ra⁃diation-induced apoptosis
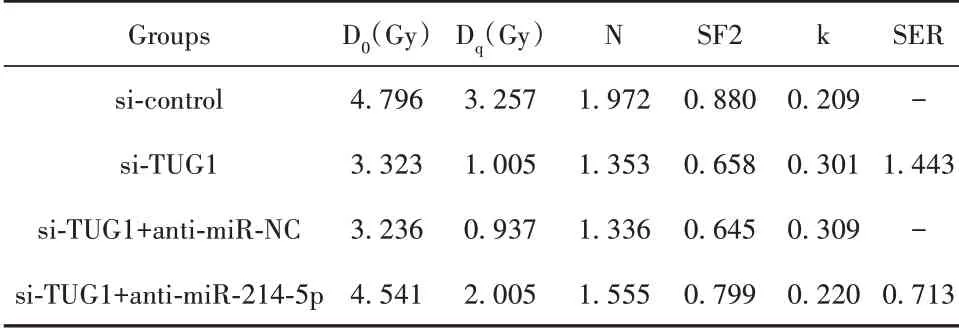
表4 抑制miR-214-5p联合沉默TUG1后MCF-7R细胞单击多靶模型的参数值Tab.4 Inhibition of miR-214-5p combined with silencing TUG1 in MCF-7R cells by clicking multi-target model parameter values
3 讨论
乳腺癌的治疗方式中放疗技术应用较为广泛,在一定程度上可延长乳腺癌患者生存期,但由于患者体质或病理程度不同导致放疗效果相差较大,部分患者甚至出现放疗抵抗性,因此如何通过增强肿瘤细胞放射敏感性成为提高乳腺癌患者临床治疗效果的重要切入点[8]。研究表明长链非编码RNA BRCA1相邻基因2(LncRNA NBR2)在放射诱导的乳腺癌细胞中呈低表达,上调LncRNA NBR2表达可通过抑制乳腺癌细胞增殖能力进而增强肿瘤细胞的放射敏感性[9]。近年来,研究发现部分LncRNA异常表达与乳腺癌细胞放疗敏感性有关,并可能作为肿瘤细胞放疗抵抗的预测因子[10]。但仍有部分LncRNA与乳腺癌细胞放疗敏感性的相关性研究尚未明确,需进一步深入挖掘LncRNA并探讨其与乳腺癌细胞放射敏感性的关系,为提高临床治疗效果提供参考。
TUG1在多种恶性肿瘤进展中均具有重要调控作用,研究表明TUG1在乳腺癌中呈高表达,其表达水平与乳腺癌患者肿瘤直径、TNM分期及淋巴结转移等呈正相关,TUG1表达可能通过下调p27表达进而促进乳腺癌生长[11]。肺腺癌组织中TUG1表达上调,其高表达与患者恶性临床病理特征密切相关,TUG1可能通过抑制p16表达促进肺腺癌的发生发展[12]。提示TUG1可能作为肿瘤诊断及治疗的重要分子标志物。张桓瑜等[13]研究表明,TUG1在神经母细胞瘤细胞中呈高表达,并可促进肿瘤细胞迁移及侵袭。越来越多的研究表明,TUG1可通过充当竞争性内源性RNA吸附miRNA或与RNA结合蛋白相互作用进而调控靶基因表达,最终影响癌症发生及发展过程,TUG1可能作为肿瘤诊断及评估患者预后的重要生物标志物及治疗靶点基因[14]。ZHAO等[15]研究表明TUG1可通过充当miR-382的海绵进而促进胰腺癌细胞增殖、迁移及EMT过程。LEI等[16]研究表明TUG1可通过靶向调控miR-145影响乳头状甲状腺癌细胞增殖、迁移及EMT过程。本研究结果表明,乳腺癌细胞中TUG1的表达水平明显高于乳腺上皮细胞,而放射抵抗性乳腺癌MCF-7R细胞中TUG1的表达水平较乳腺癌细胞明显升高,说明TUG1的表达水平升高可降低乳腺癌细胞放射敏感性。本研究通过沉默TUG1表达,发现MCF-7R细胞存活分数明显降低,细胞增敏比明显升高,说明沉默TUG1表达可增加乳腺癌细胞放射敏感性,提示TUG1可能作为乳腺癌靶向治疗的潜在靶点。本研究同时发现,沉默TUG1表达后经X射线照射后乳腺癌细胞凋亡率明显升高,说明沉默TUG1表达可通过促进乳腺癌细胞凋亡进而增加乳腺癌细胞放射敏感性。提示TUG1高表达可通过抑制放射诱导的乳腺癌细胞凋亡进而降低细胞放射敏感性。
miR-214-3p在宫颈癌细胞中呈高表达,上调miR-214-3p表达后可促进宫颈癌细胞增殖,抑制miR-214-3p表达后可抑制宫颈癌细胞增殖并诱导细胞凋亡,为宫颈癌临床诊断及治疗提供新靶点[17]。研究表明miR-214-5p在胰腺癌细胞中呈低表达,上调miR-214-5p表达可抑制胰腺癌细胞迁移及侵袭[18]。LI等[19]研究表明miR-214-5p过表达可抑制肝细胞癌细胞迁移及侵袭。miR-214-5p可靶向抑制ROCK1表达进而抑制人骨肉瘤细胞增殖及侵袭[20]。本研究发现乳腺癌细胞中miR-214-5p的表达水平明显升高,其在乳腺癌放射抵抗细胞中的表达水平较乳腺癌细胞明显降低,说明miR-214-5p表达水平与乳腺癌细胞放射敏感性密切相关。通过将miR-214-5p mimics转染入放射抵抗乳腺癌MCF-7R细胞以提高miR-214-5p的表达水平,结果发现miR-214-5p过表达可明显降低MCF-7R细胞存活分数,促进MCF-7R细胞凋亡,增加乳腺癌细胞放射敏感性。提示miR-214-5p过表达可明显增加乳腺癌细胞放射敏感性。双荧光素酶报告实验证实TUG1可吸附miR-214-5p而降低其表达,为验证其是否通过调控miR-214-5p表达降低乳腺癌细胞放射敏感性,将沉默TUG1与抑制miR-214-5p共转染至MCF-7R细胞,结果发现共转染后MCF-7R细胞存活分数明显增加,增敏比明显降低,细胞凋亡率明显降低。提示沉默TUG1可通过上调miR-214-5p表达进而增加乳腺癌细胞放射敏感性。
综上所述,TUG1在乳腺癌细胞中高表达,沉默TUG1可通过上调miR-214-5p表达而促进乳腺癌细胞凋亡并增加细胞株放射敏感性。但TUG1在乳腺癌细胞增殖、放疗抵抗及凋亡中的具体作用机制尚需深入研究。