KLF12在宫颈癌中的表达及其调控IL-6/STAT3通路影响宫颈癌细胞增殖和凋亡的机制研究
2021-09-25包克勇陶晓玉
包克勇 陶晓玉 张 雪 张 莉 王 东
(内蒙古民族大学附属医院西医妇科,通辽028000)
宫颈癌是女性常见恶性肿瘤之一,病理组织学多数为鳞癌,少数为腺癌,近年宫颈癌发病率持续上升,并呈现年轻化趋势,是导致妇女死亡的重要原因之一[1]。Krüpple样转录因子12(Krüpple-like factor 12,KLF12)是KLF家族成员,参与脂代谢、肾脏发育、肿瘤细胞增殖、凋亡、侵袭迁移等过程[2-3]。多种肿瘤中KLF12异常表达,其异常表达可影响肿瘤生长[4-5]。宫颈癌中KLF12研究较少,研究发现,92例宫颈癌患者中大部分患者KLF12呈高表达,KLF12高表达患者5年生存率明显降低,且KLF12高表达与患者淋巴结转移、临床分期和宫旁浸润密切相关[6]。IL-6/STAT3信号通路在多种肿瘤中异常激活,其异常激活可影响肿瘤侵袭迁移、凋亡等多种生物学过程[7-8]。本研究旨在观察抑制KLF12表达对宫颈癌细胞增殖、凋亡的影响,并进一步探讨IL-6/STAT3信号通路在此过程中的作用,为宫颈癌诊治提供依据。
1 资料与方法
1.1 资料
1.1.1 临床标本 收集2017年3月至2019年2月于我院就诊的宫颈癌患者术后切除的宫颈癌组织标本及相应癌旁组织(距离肿瘤边缘>3 cm)共42例,所有病例经我院病理医生复阅确认,年龄36~66岁,中位年龄45岁。所有病例术前均未接受放化疗及其他抗肿瘤治疗,术后30 min将所有病例标本置于液氮中冻存,−80℃保存,用于后续实验。所有样本采集前均得到患者知情同意,经我院伦理委员会批准。
1.1.2 细胞株 正常宫颈上皮永生化细胞End1/E6E7及宫颈癌C33A、HeLa和SiHa购自美国菌种保藏中心。
1.1.3 主要试剂和仪器 DMEM培养基、胎牛血清、胰蛋白酶购自美国Gibco公司;SDS-PAGE凝胶试剂盒、Annexin V-FITC细胞凋亡试剂盒购自中国碧云天公司;BCA试剂盒购自北京中杉金桥公司;KLF12、STAT3、p-STAT3、CyclinD1、Bcl-2和Bax抗体购自美国Abcam公司;CCK-8试剂购自日本同仁化学研究所;酶标仪购自美国Thermo公司;流式细胞仪购自美国BD公司。
1.2 方法
1.2.1 细胞培养及转染 正常宫颈细胞及宫颈癌细胞采用含10%胎牛血清及青霉素和链霉素的DMEM完全培养基培养,37℃、5%CO2,细胞覆盖瓶底70%左右时,胰酶消化,传代。转染前24 h接种生长至对数期的宫颈癌C33A细胞于6孔板,1 ml/孔加入细胞(约1×105个),生长至60%融合时进行转染。转染参照LipofectamineTM2000说明,KLF12特异性siRNA(si-KLF12组)、无意义siRNA(si-NC组)及Lipo‐fectamineTM2000中分别加入无血清培养基,将稀释后的siRNA与LipofectamineTM2000混匀,加入6孔板相应孔,仅加入脂质体的为对照组,转染后常规孵育5~6 h,更换为无抗生素含血清培养液继续培养48 h,Western blot检测转染后细胞KLF12表达。
1.2.2 Western blot检测蛋白表达 提取组织,转染si-KLF12,根据预实验选择的5 mg/ml重组人IL-6(RhIL-6)处理的转染si-KLF12的细胞总蛋白,BCA法测定蛋白浓度。蛋白样品与上样缓冲液混匀,100℃沸水中变性5 min,40 µg/孔加入变性蛋白,SDS-PAGE分离蛋白(220 V,2 h),电泳,取出凝胶,移至电转移槽(100 V,90 min),取下转好的PVDF膜,根据Marker切膜,5%脱脂奶粉室温封闭2 h。加一抗(1∶1000)4℃孵育过夜,洗膜,加HRP标记的二抗(1∶2000)室温孵育1 h,洗膜,ECL显色,曝光。Bio-Rad成像系统分析条带灰度值,目的蛋白相对表达=目的蛋白灰度值/内参GAPDH灰度值,实验重复3次。
1.2.3 CCK-8法检测细胞增殖 200 µl/孔(约5×103个)接种生长至对数期的C33A细胞于96孔板,采用含10%胎牛血清的DMEM培养基37℃、5%CO2培养24 h,采用KLF12 siRNA及KLF12 siRNA+RhIL-6处理细胞,分别在培养24 h、48 h和72 h加入CCK-8试剂(10 µl/孔),常规孵育3 h,取出培养板,酶标仪测定490 nm处各孔光密度(OD)值,实验重复3次[9]。
1.2.4 Annexin V-FITC/PI法检测细胞凋亡 收集经KLF12 siRNA及KLF12 siRNA+RhIL-6处理的细胞,预冷PBS洗涤2次,将10×Binding Buffer采用去离子水稀释为1×Binding Buffer,1×106个/ml重悬细胞于1×Binding Buffer中,取300 µl细胞悬液,加入流式管中,加5 µl Annexin V-FITC于流式管中,微量移液器混匀,室温(25℃)避光孵育15 min,加入5 µl PI,混匀,在流式管中加入200 µl 1×Binding Buffer,1 h内流式细胞仪分析,实验重复3次[10]。
1.3 统计学分析 采用SPSS21.0软件进行统计学分析,计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 KLF12在宫颈癌组织及细胞中的表达KLF12在宫颈癌组织中表达(0.622±0.063)明显高于癌旁组织(0.083±0.012,P<0.05,图1A),与正常宫颈上皮永生化细胞End1/E6E7(0.075±0.010)相比,宫 颈 癌C33A(0.525±0.058)、HeLa(0.201±0.022)和SiHa(0.314±0.028)细胞中KLF12表达均明显升高(P<0.01,图1B)。宫颈癌C33A细胞中KLF12表达最高,因此选择C33A细胞进行后续实验。
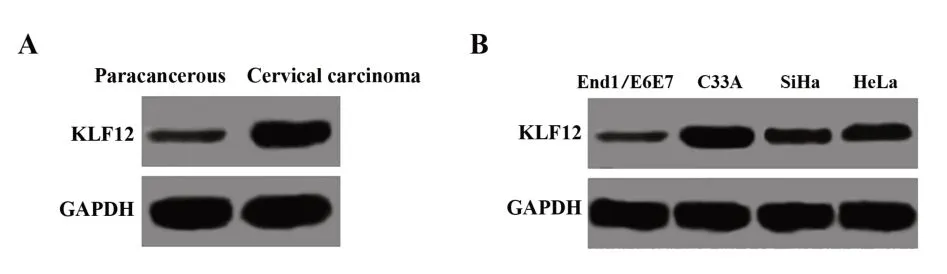
图1 Western blot检测宫颈癌组织及细胞中KLF12表达Fig.1 Expression of KLF12 in cervical cancer tissues and cells detected by Western blot
2.2 C33A细胞转染KLF12 siRNA后KLF12表达KLF12 siRNA转染C33A细胞48 h,KLF12表达明显低于对照组(P<0.01),si-NC组KLF12表达与对照组差异无统计学意义(P>0.05,图2、表1)。
表1 C33A细胞转染KLF12 siRNA后KLF12表达(±s)Tab.1 KLF12 expression in C33A cells transfected with KLF12 siRNA(±s)
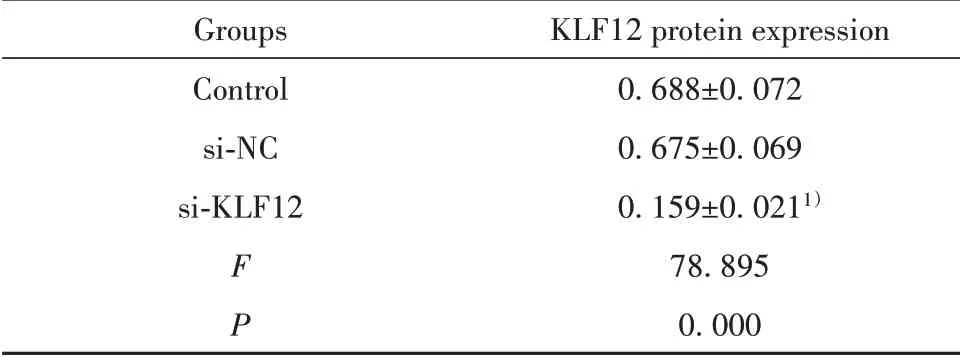
表1 C33A细胞转染KLF12 siRNA后KLF12表达(±s)Tab.1 KLF12 expression in C33A cells transfected with KLF12 siRNA(±s)
Note:Compared with Control,1)P<0.01.
Groups Control si-NC si-KLF12 F P KLF12 protein expression 0.688±0.0720.675±0.0690.159±0.0211)78.8950.000
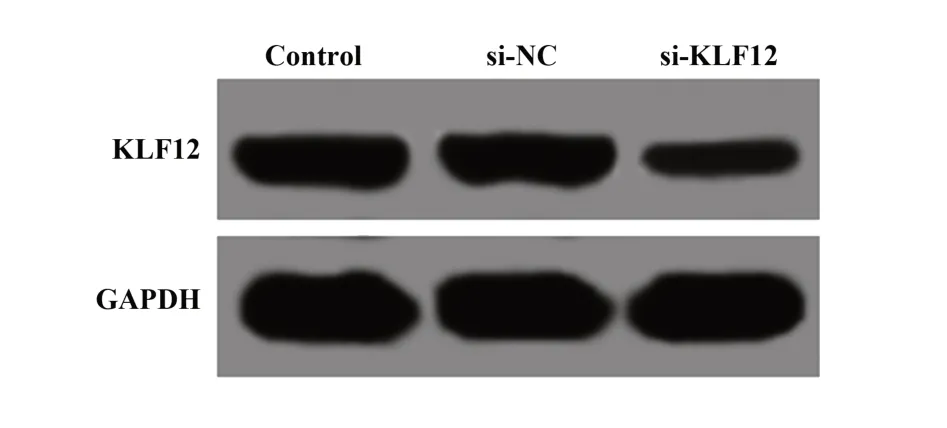
图2 Western blot检测C33A细胞转染KLF12 siRNA后KLF12表达Fig.2 KLF12 expression detected by Western blot after KLF12 siRNA transfected into C33A cells
2.3 抑制KLF12表达对C33A细胞增殖、凋亡的影响 si-NC组和对照组细胞活力及凋亡率差异均无统计学意义(P>0.05),si-KLF12组细胞活力明显低于对照组,凋亡率高于对照组(P<0.01,图3、表2)。
表2 抑制KLF12表达对C33A细胞增殖活力及凋亡率的影响(±s)Tab.2 Effect of inhibiting KLF12 expression on prolifera⁃tion activity and apoptosis rate of C33A cells(±s)
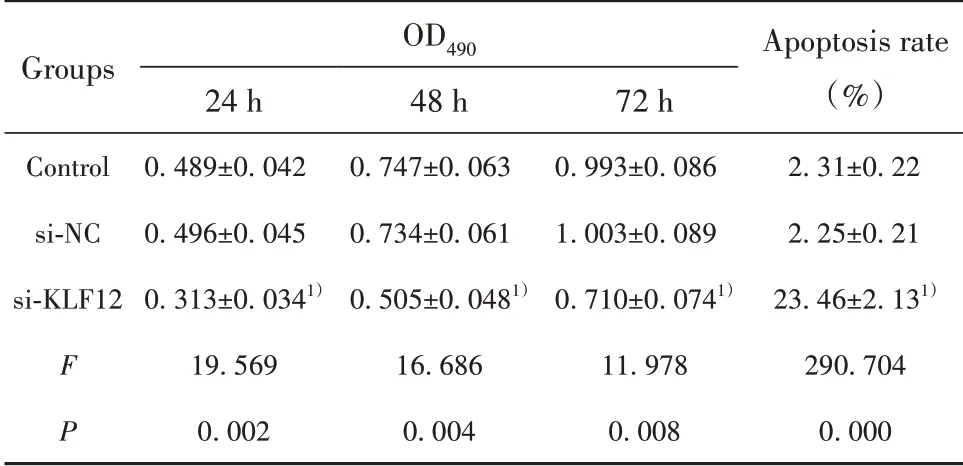
表2 抑制KLF12表达对C33A细胞增殖活力及凋亡率的影响(±s)Tab.2 Effect of inhibiting KLF12 expression on prolifera⁃tion activity and apoptosis rate of C33A cells(±s)
Note:Compared with Control,1)P<0.01.
Groups Control si-NC si-KLF12 F P OD490 24 h 0.489±0.0420.496±0.0450.313±0.0341)19.5690.00248 h 0.747±0.0630.734±0.0610.505±0.0481)16.6860.00472 h 0.993±0.0861.003±0.0890.710±0.0741)11.9780.008 Apoptosis rate(%)2.31±0.222.25±0.2123.46±2.131)290.7040.000
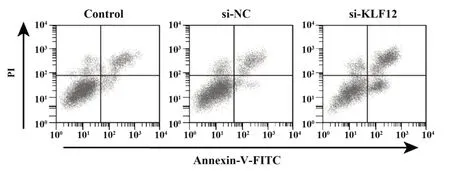
图3 抑制KLF12表达对C33A细胞凋亡的影响Fig.3 Effect of KLF12 inhibition on apoptosis of C33A cells
2.4 抑制KLF12表达对IL-6/STAT3信号通路的影响 各组细胞STAT3表达差异无统计学意义(P>0.05),与si-NC组相比,si-KLF12组p-STAT3表达明显降低,si-NC+RhIL-6组p-STAT3表达明显升高(P<0.01),与si-KLF12+RhIL-6组相比,si-KLF12组p-STAT3表 达 明 显降低,si-NC+RhIL-6组p-STAT3表达明显升高(P<0.01,图4、表3)。
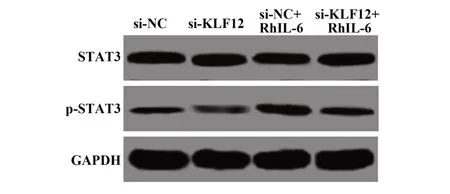
图4 Western blot检测各组C33A细 胞STAT3和p-STAT3表达Fig.4 Western blot to detect STAT3 and p-STAT3 ex⁃pressions of C33A cells in each group
表3 各组STAT3和p-STAT3蛋白表达(±s)Tab.3 Expressions of STAT3 and p-STAT3 in each group(±s)
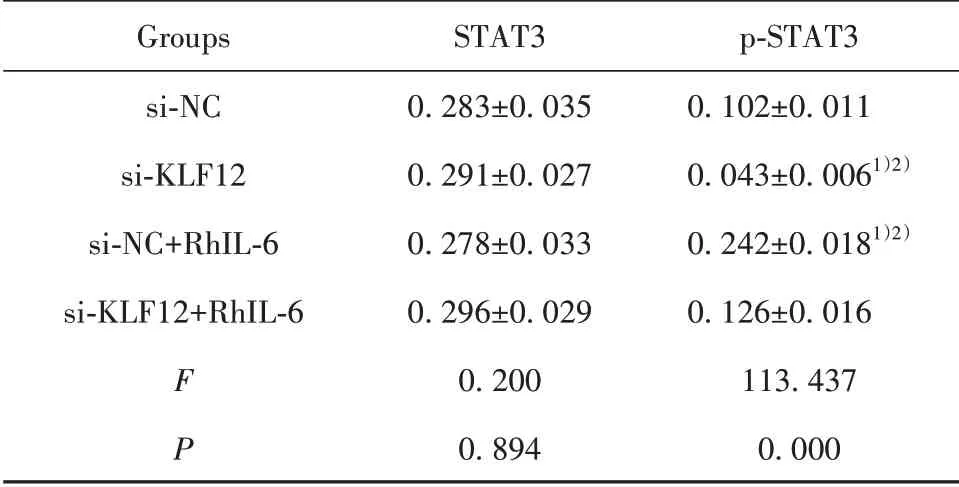
表3 各组STAT3和p-STAT3蛋白表达(±s)Tab.3 Expressions of STAT3 and p-STAT3 in each group(±s)
Note:Compared with si-NC,1)P<0.01;compared with si-KLF12+Rh IL-6,2)P<0.01.
Groups si-NC si-KLF12 si-NC+RhIL-6 si-KLF12+RhIL-6 F P STAT30.283±0.0350.291±0.0270.278±0.0330.296±0.0290.2000.894 p-STAT30.102±0.0110.043±0.0061)2)0.242±0.0181)2)0.126±0.016113.4370.000
2.5 抑制KLF12表达对CyclinD1、Bcl-2和Bax表达的影响 与si-NC组相比,si-KLF12组CyclinD1和Bcl-2表达明显降低,Bax表达明显升高,si-NC+RhIL-6组CyclinD1和Bcl-2表达明显升高,Bax表达明显降低(P<0.01),与si-KLF12+RhIL-6组相比,si-KLF12组CyclinD1和Bcl-2表达明显降低,Bax表达明显升高,si-NC+RhIL-6组CyclinD1和Bcl-2表达明显升高,Bax表达明显降低(P<0.01,图5、表4)。
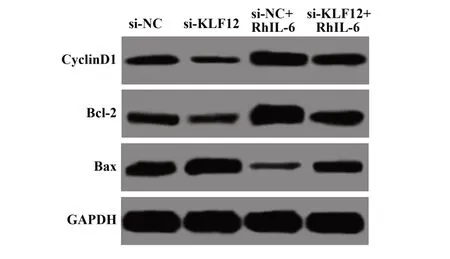
图5 Western blot检测各组C33A细胞CyclinD1、Bcl-2和Bax表达Fig.5 Western blot to detect CyclinD1,Bcl-2 and Bax ex⁃pressions in C33A cells
表4 各组细胞CyclinD1、Bcl-2和Bax蛋白表达(±s)Tab.4 Proteins expressions of CyclinD1,Bcl-2 and Bax of cells in each group(±s)
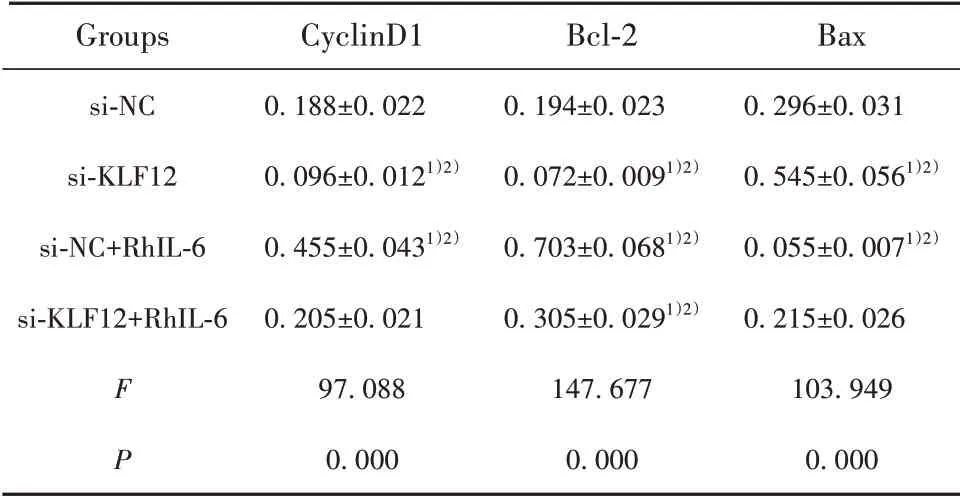
表4 各组细胞CyclinD1、Bcl-2和Bax蛋白表达(±s)Tab.4 Proteins expressions of CyclinD1,Bcl-2 and Bax of cells in each group(±s)
Note:Compared with si-NC,1)P<0.01;compared with si-KLF12+RhIL-6,2)P<0.01.
Groups si-NC si-KLF12 si-NC+RhIL-6 si-KLF12+RhIL-6 F P CyclinD10.188±0.0220.096±0.0121)2)0.455±0.0431)2)0.205±0.02197.0880.000 Bcl-20.194±0.0230.072±0.0091)2)0.703±0.0681)2)0.305±0.0291)2)147.6770.000 Bax 0.296±0.0310.545±0.0561)2)0.055±0.0071)2)0.215±0.026103.9490.000
3 讨论
宫颈癌发生发展是涉及多因素、多步骤、多基因的复杂过程,其发生发展的分子机制尚未明确[11]。近年研究发现,在女性生殖道内分泌肿瘤中KLF家族成员具有重要作用,研究显示,子宫内膜癌中KLF6表达降低,无淋巴结转移患者KLF6表达高于淋巴结转移者,且肿瘤浸润程度越高,KLF6表达越低[12]。宫颈癌中KLF4表达降低,随临床分期进展,其表达降低[13]。KLF12是KLF家族成员,在胃癌、胰腺癌等多种肿瘤中具有重要作用,但在宫颈癌中研究较少[14-15]。既往研究发现,宫颈癌中KLF12表达升高[6],KLF12对宫颈癌细胞生物学特性及机制的影响尚未明确。为探究KLF12在宫颈癌中的作用,本研究首先检测宫颈癌组织及不同宫颈癌细胞KLF12表达,结果显示,宫颈癌细胞及组织中KLF12表达均明显升高,与既往研究结果一致。由于宫颈癌C33A细胞中KLF12表达最高,因此选择C33A细胞作为研究对象。
本研究显示,KLF12特异性siRNA可明显降低宫颈癌细胞增殖,促进其凋亡,下调p-STAT3、Cy‐clinD1和Bcl-2表达,上调Bax表达,且可减弱RhIL-6对p-STAT3、CyclinD1、Bcl-2和Bax表 达 的 影 响。STAT3在细胞生长中有重要作用,与肿瘤发生发展密切相关[16-17]。正常细胞中,STAT3活化过程短暂,但在多种肿瘤细胞中,因细胞因子(如TNF-α、IL-6)、生长因子(如TGF-β、EGF)等失调,活化后的STAT3水平异常升高,可引起细胞增殖凋亡失衡,最终导致 肿 瘤 发 生[18-19]。增 殖 相 关 蛋 白(如Myc、Cy‐clinD1)、凋亡相关蛋白(如Bcl-2、Bcl-XL)等是STAT3的重要靶基因产物,IL-6/STAT3信号异常激活引起的上述基因表达异常将引肿瘤[20]。IL-6是一种细胞因子,是IL家族成员,在调节免疫细胞、传递信息、炎症反应、增殖和分化等过程中发挥重要作用[21-22]。提示抑制KLF12表达可能通过调控IL-6/STAT3信号途径抑制宫颈癌细胞生长。
综上所述,宫颈癌中KLF12表达升高,抑制其表达可降低癌细胞增殖,促进其凋亡,其机制可能与抑制IL-6/STAT3信号通路有关。本研究可能为研究KLF12在宫颈癌中的作用提供理论基础,提示KLF12可能是宫颈癌诊治的潜在靶标。