miR-128-3p通过调控Notch1表达影响子宫内膜癌细胞的增殖和凋亡①
2021-09-25顾晓荔任晓爽廖予妹郑州大学第二附属医院妇产科郑州450014
顾晓荔 任晓爽 廖予妹(郑州大学第二附属医院妇产科,郑州450014)
子宫内膜癌(endometrial cancer,EC)是女性生殖系统常见的恶性肿瘤,其发病率逐年增长及年轻化[1]。近年来,随着医疗水平的进步,EC的治疗取得巨大进步,但晚期患者易复发和转移,预后较差[2]。目前,EC的发病机制尚未明确。因此,探讨EC发生、发展的分子机制并寻找基因治疗靶点对于EC的治疗和预后改善具有重要意义。微小RNA(microRNA,miRNA)是一类小分子非编码RNA,通过与靶信使RNA(mRNA)的3'非翻译区(3'untrans‐lated region,3'UTR)靶向结合,降解靶mRNA或抑制靶mRNA翻译,进而调控靶基因的表达,影响细胞的生长、凋亡和分化等生命过程[3]。研究显示,miR-128-3p参与调控肝癌、食管癌、乳腺癌等肿瘤细胞的增殖、凋亡和迁移,在肿瘤的发生和发展过程中起重要作用[4-6]。但目前,miR-128-3p对EC细胞增殖和凋亡的影响还未知。生物信息学软件预测显示,Notch1的3'UTR存在与miR-128-3p结合的连续位点,提示Notch1是miR-128-3p的靶基因。Notch1是一种Ⅰ型跨膜蛋白,在肿瘤细胞生长、增殖和凋亡过程中起重要调控作用[7]。研究显示,Notch1蛋白在EC组织中阳性表达率升高,其表达与患者肿瘤淋巴结转移、分化程度等临床病理特征密切相关,参与调控EC细胞的增殖和凋亡[8-9]。目前,miR-128-3p能否通过调控Notch1表达影响EC细胞的增殖和凋亡也还未知。本研究首先检测了EC细胞系中miR-128-3p和Notch1表达水平,然后探讨了过表达miR-128-3p或低表达Notch1对EC细胞增殖和凋亡及Wnt/β-catenin信号通路的影响,并验证了miR-128-3p能否通过调控Notch1表达影响EC细胞增殖和凋亡,以期为EC的靶向分子治疗提供新靶点。
1 材料与方法
1.1 材料 人子宫内膜血管内皮细胞hEEC、EC细胞系HEC-1A、Ishikawa和AN3CA(中国科学院上海细胞库);胎牛血清(fetal bovine serum,FBS)、RP‐MI1640培养基(美国Hycolne公司);四甲基噻唑蓝(methylthiazoletrazolium,MTT)、LipofectamineTM2000试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒和双荧光素酶活性检测试剂盒(上海碧云天生物技术有限公司);胰蛋白酶(美国Sigma公司);Trizol试剂、逆转录试剂盒和PCR试剂盒(深圳晶美生物工程有限公司);PCR引物(上海生工生物工程有限公司);兔抗人Notch1、细胞周期蛋白D1(cyclinD1)和活化的半胱天冬酶-3(cleaved-caspase-3)多克隆抗体(美国Abcam公司);兔抗人β-肌动蛋白(β-actin)多克隆抗体(Jackson公司),膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(propidium iodide,PI)细胞凋亡试剂盒(南京森贝伽生物科技有限公司);miR-128-3p模拟物(mimics)及阴性序列、miR-128-3p抑制剂及阴性序列、Notch1的小干扰RNA(si-Notch1)及乱序无意义阴性序列(si-NC,广州锐博生物科技有限公司)。
1.2 方法
1.2.1 细胞培养 子宫内膜血管内皮细胞hEEC、EC细胞系HEC-1A、Ishikawa和AN3CA均用含10%FBS的RPMI1640培养基于培养箱中(37℃、CO2体积分数5%、湿度97%)培养。每隔2 d更换1次新鲜的培养基。待细胞融合至80%~90%时,0.25%胰蛋白酶溶液消化,进行传代培养。
1.2.2 Ishikawa细胞转染和分组 对数增殖期的Ishikawa细胞,以1×105个/孔接种于6孔板中。待细胞融合至60%时,按照LipofectamineTM2000试剂盒说明书进行转染。分别将miR-128-3p mimcs(miR-128-3p组)及阴性序列(miR-NC组)、miR-128-3p抑制剂(anti-miR-128-3p组)及阴性序列(anti-miR-NC组)、Notch1的小干扰RNA(si-Notch1)及乱序无意义阴性序列(si-NC)转染至Ishikawa细胞。转染12 h后,更换新鲜培养基,继续培养至48 h。收集细胞,RT-qPCR检 测miR-128-3p或Western blot检 测Notch1蛋白水平以评价转染效果。
1.2.3 RT-qPCR检测细胞中miR-128-3p和Notch1 mRNA表达 Trizol试剂提取细胞中总RNA,并逆转录为cDNA。以cDNA为模板,行PCR扩增。PCR扩增条件:95℃5 min,95℃10 s,60℃30 s,72℃30 s,共35个循环。miR-128-3p上游5'-GGAATTCAAC‐CAACTGTCAATAACTGGAG-3',下游5'-CGGGATC‐CAATTTGTCATCCAAATCTACTTTGG-3';Notch1上游5'-CGTGTGAACCCGTAGGCGCC-3',下游5'-GGCCAACGTGTGCAAGCGACGGC-3';U6上游5'-TGAACGCCGAGGGTGAGTGTCG-3',下 游5'-CGGAAC‐GTGACGTGTGGCGTACG-3';GAPDH上 游5'-GCGATAAGTGCTGAGCTGCTC-3',下游5'-GTTGACGC‐GAACTGACGTGT-3'。miR-128-3p以U6为内参,Notch1以GAPDH为内参,2−ΔΔCt法计算miR-128-3p和Notch1 mRNA的相对表达水平。
1.2.4 MTT检测Ishikawa细胞增殖 转染后的各组Ishikawa细胞,以5×103个/孔细胞接种于96孔板中,培养箱中培养48 h后,每孔加入20 µl浓度为5 g/L的MTT,继续孵育4 h。弃去培养基,每孔加入150 µl二甲基亚砜,反应5 min,混匀后于酶标仪490 nm处测定吸光度值(A)。每组设置3个复孔,实验重复3次,取平均值。细胞存活率(%)=A实验组/A对照组×100%。
1.2.5 流式细胞仪检测Ishikawa细胞凋亡 转染后的各组Ishikawa细胞,以1×104个/孔细胞接种于24孔板中,培养箱中培养48 h后,胰蛋白酶消化,收集细胞。取1.0×106个细胞,加入适量预冷的PBS清洗细胞2次。参照Annexin V-FITC/PI试剂盒说明书,加入400 µl结合缓冲液,轻轻吹打混悬细胞。加入10 µl Annexin V-FITC,室温避光孵育10 min。加入5 µl PI,室温避光孵育5 min。最后再加入100 µl结合缓冲液,涡旋混匀后流式细胞仪检测细胞凋亡。
1.2.6 Western blot法检测细胞中Notch1、cyclinD1和cleaved-caspase-3蛋白表达 RIPA蛋白裂解液提取细胞中总蛋白,4℃、12000 r/min离心5 min,保留上清液。BCA法测定上清中蛋白浓度对蛋白进行定量。取适量蛋白溶液,100℃煮沸5 min。蛋白变性后,以每孔20 µg蛋白行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳。电泳结束后,湿转至聚偏乙烯二氟膜,并置于5%脱脂牛奶中封闭2 h。分别加入稀释后的Notch1(1∶500)、cyclinD1(1∶100)、cleaved-cas‐pase-3(1∶1000)和β-actin(1∶8000)抗体,4℃冰箱孵育过夜。洗膜后,加入辣根过氧化酶标记的二抗(1∶5000),室温孵育1 h。洗膜后,滴加化学发光试剂ELC,避光显影后使用ZF-258型凝胶成像系统(上海嘉鹏科技有限公司)曝光拍照,Image J软件分析蛋白条带灰度值。目的蛋白的相对表达水平以期蛋白条带灰度值与内参β-actin蛋白条带灰度值的比值表示。
1.2.7 双荧光素酶报告基因实验验证miR-128-3p与Notch1靶向关系 Starbase软件预测显示,Notch1的3'UTR含有与miR-128-3p结合的连续位点。采用PCR技术扩增含miR-128-3p结合位点的Notch1的3'UTR序列,将其克隆至psiCHECK-2质粒中,构建Notch1野生型载体(WT-Notch1)。利用基因定点突变技术将结合位点突变后,克隆至psiCHECK-2质粒,构建Notch1突变型载体(MUT-Notch1)。Ishi‐kawa细胞1×105个/孔接种于6孔板中。待细胞融合至60%时,分别共转染WT-Notch1、MUT-Notch1与miR-128-3p mimic或miR-NC至Ishikawa细胞。转染12 h后,收集细胞,检测各组荧光素酶活性。具体操作参照双荧光素酶活性检测试剂盒说明书,各组的荧光素酶活性以荧光虫活性与海肾荧光强度的比值表示。
1.3 统计学分析 采用SPSS22.0软件对实验数据进行分析。符合正态分布的计量资料以±s表示。两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,两两比较采用SNK-q检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 EC细胞系中miR-128-3p和Notch1表达水平与hEEC细胞比较,EC细胞系HEC-1A、Ishikawa和AN3CA中miR-128-3p表 达 水平 降低(P<0.05),Notch1 mRNA和蛋白表达水平升高(P<0.05)。见图1和表1。

图1 Western blot检测EC细胞系中Notch1蛋白表达Fig.1 Western blot detected expression of Notch1 protein in EC cell lines
表1 EC细胞系中miR-128-3p和Notch1表达水平(±s,n=9)Tab.1 Expression levels of miR-128-3p and Notch1 pro⁃tein in EC cell lines(±s,n=9)
Note:Compared with hEEC group,1)P<0.05.
Groups hEEC HEC-1A Ishikawa AN3CA F P miR-128-3p 1.00±0.100.32±0.031)0.22±0.021)0.40±0.041)344.0930.000 Notch1 mRNA 1.02±0.113.02±0.301)3.76±0.381)2.76±0.281)149.1270.000 Notch1 protein 0.35±0.040.76±0.081)0.98±0.101)0.85±0.091)102.1150.000
2.2 过表达miR-128-3p对Ishikawa细胞增殖和凋亡的影响 miR-128-3p组Ishikawa细胞中miR-128-3p水平高于miR-NC组(P<0.05),说明miR-128-3p mimics转染成功,Ishikawa细胞中miR-128-3p过表达。与miR-NC组比较,miR-128-3p组Ishikawa细胞存活率和cyclinD1蛋白水平降低(P<0.05),细胞凋亡率和cleaved-caspase-3蛋白水平升高(P<0.05)。见图2和表2。
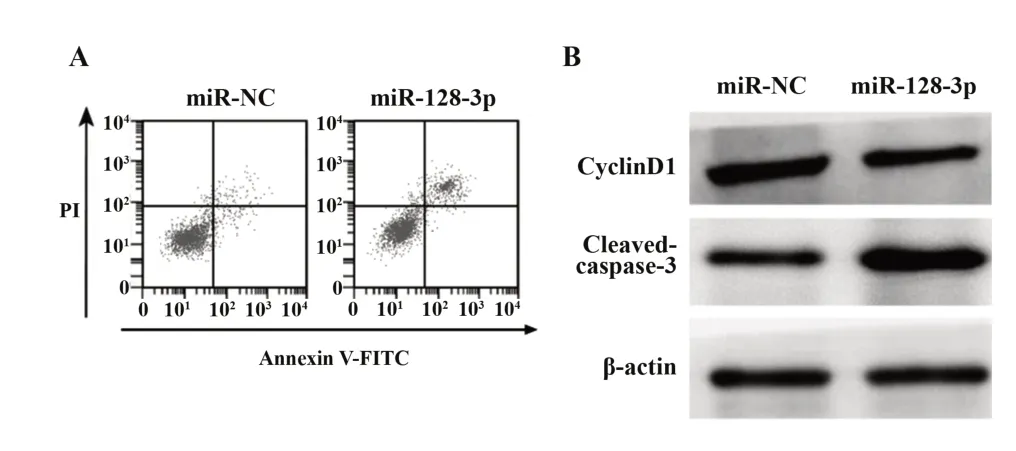
图2 高表达miR-128-3p对Ishikawa细胞增殖和凋亡的影响Fig.2 Effect of high expression of miR-128-3p on proliferation and apoptosis of Ishikawa cells
表2 高表达miR-128-3p对Ishikawa细胞增殖和凋亡的影响(±s,n=9)Tab.2 Effect of high expression of miR-128-3p on proliferation and apoptosis of Ishikawa cells(±s,n=9)
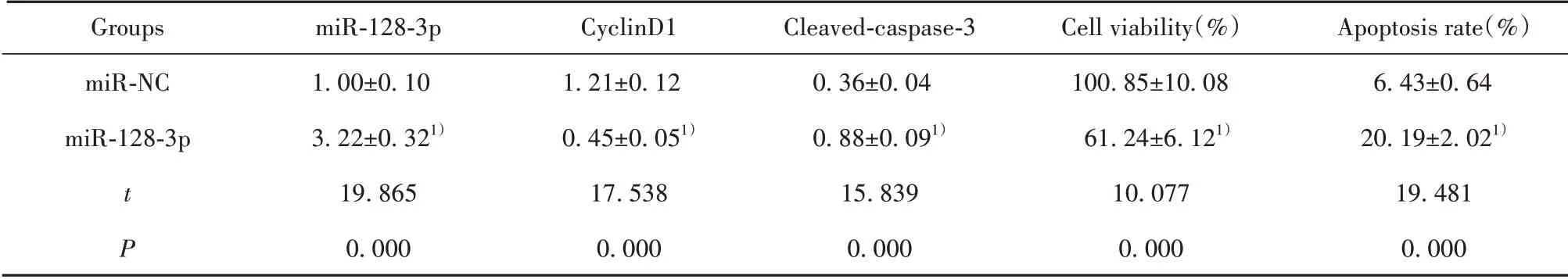
表2 高表达miR-128-3p对Ishikawa细胞增殖和凋亡的影响(±s,n=9)Tab.2 Effect of high expression of miR-128-3p on proliferation and apoptosis of Ishikawa cells(±s,n=9)
Note:Compared with miR-NC group,1)P<0.05.
Groups miR-NC miR-128-3p t P miR-128-3p 1.00±0.103.22±0.321)19.8650.000 CyclinD11.21±0.120.45±0.051)17.5380.000 Cleaved-caspase-30.36±0.040.88±0.091)15.8390.000 Cell viability(%)100.85±10.0861.24±6.121)10.0770.000 Apoptosis rate(%)6.43±0.6420.19±2.021)19.4810.000
2.3 低表达Notch1对Ishikawa细胞增殖和凋亡的影响 si-Notch1组Ishikawa细胞中Notch1蛋白水平低于si-NC组(P<0.05),说明Notch1小干扰RNA转染成功,Ishikawa细胞中Notch1表达降低。与si-NC组比较,si-Notch1组Ishikawa细胞存活率和cyclinD1蛋白水平降低(P<0.05),细胞凋亡率和cleaved-cas‐pase-3蛋白水平升高(P<0.05)。见图3和表3。
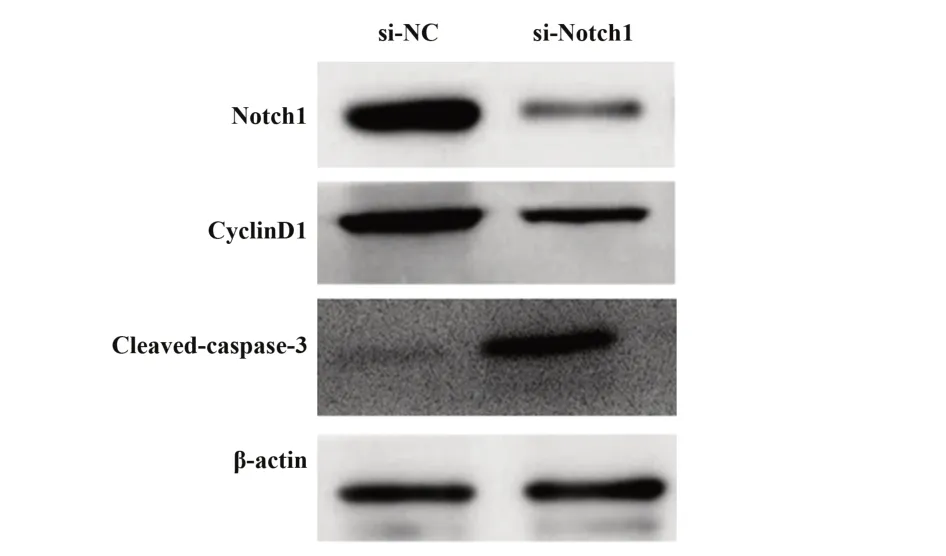
图3 Western blot检测Notch1、cyclinD1、cleaved-caspase-3蛋白表达Fig.3 Western blot detected expressions of Notch1,cy⁃clinD1 and cleaved-caspase-3 proteins
表3 低表达Notch1对Ishikawa细胞增殖和凋亡的影响(±s,n=9)Tab.3 Effect of low expression of Notch1 on proliferation and apoptosis of Ishikawa cells(±s,n=9)
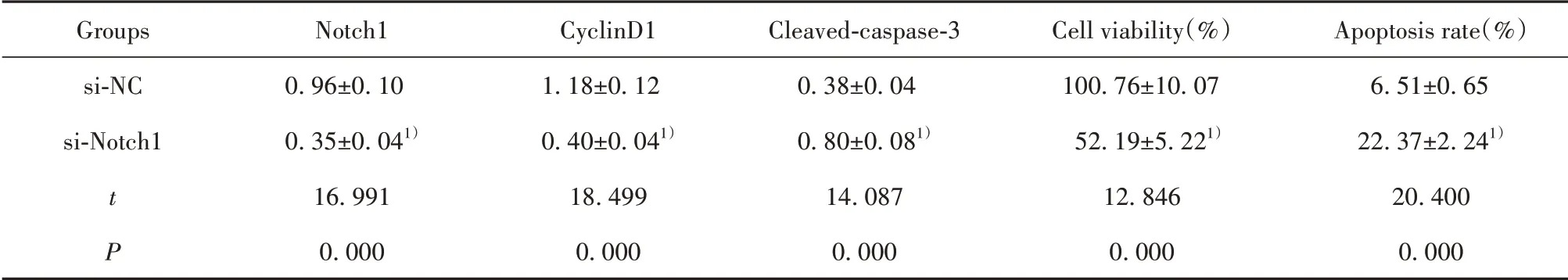
表3 低表达Notch1对Ishikawa细胞增殖和凋亡的影响(±s,n=9)Tab.3 Effect of low expression of Notch1 on proliferation and apoptosis of Ishikawa cells(±s,n=9)
Note:Compared with si-NC group,1)P<0.05.
Groups si-NC si-Notch1 t P Notch10.96±0.100.35±0.041)16.9910.000 CyclinD11.18±0.120.40±0.041)18.4990.000 Cleaved-caspase-30.38±0.040.80±0.081)14.0870.000 Cell viability(%)100.76±10.0752.19±5.221)12.8460.000 Apoptosis rate(%)6.51±0.6522.37±2.241)20.4000.000
2.4 miR-128-3p靶向调控Notch1表达 Starbase软件预测显示,Notch1的3'UTR含有与miR-128-3p结合的连续位点(图4A)。双荧光素酶活性检测显示,miR-128-3p mimics与WT-Notch1共转染组荧光素酶活性低于miR-NC与WT-Notch1共转染组(P<0.05),而miR-128-3p mimics与MUT-Notch1共转染组与miR-NC与MUT-Notch1共转染组相比荧光素酶活性无显著性差异(P>0.05),说明miR-128-3p可与Notch1的3'UTR靶向结合。miR-128-3p组Notch1蛋白水平低于miR-NC组(P<0.05),anti-miR-128-3p组Notch1蛋白水平高于anti-miR-NC组(P<0.05),进一步说明miR-128-3p在Ishikawa细胞中靶向负调控Notch1表达。见图4、表4、表5。
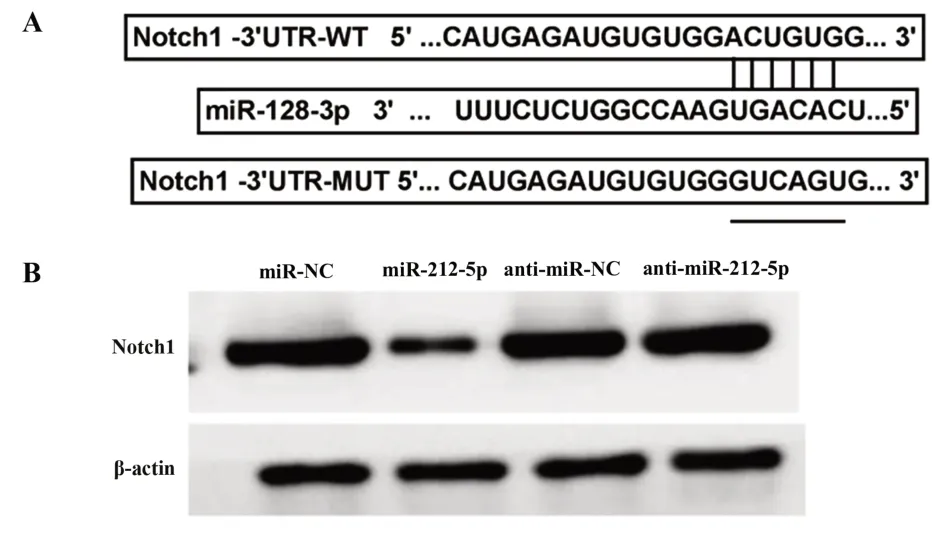
图4 miR-128-3p靶向调控Notch1表达Fig.4 miR-128-3p targeted regulation of Notch1 expres⁃sion
表4 双荧光素酶活性检测结果(±s,n=9)Tab.4 Results of dual luciferase activity detection(±s,n=9)
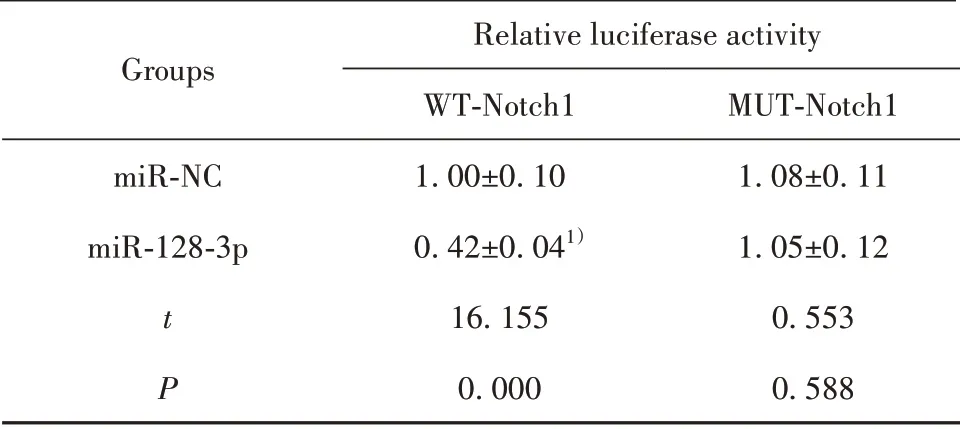
表4 双荧光素酶活性检测结果(±s,n=9)Tab.4 Results of dual luciferase activity detection(±s,n=9)
Note:Compared with the miR-NC group,1)P<0.05.
Groups miR-NC miR-128-3p t P Relative luciferase activity WT-Notch11.00±0.100.42±0.041)16.1550.000 MUT-Notch11.08±0.111.05±0.120.5530.588
表5 miR-128-3p对Notch1蛋白表达的影响(±s,n=9)Tab.5 Effect of miR-128-3p on expression of Notch1 pro⁃tein(±s,n=9)
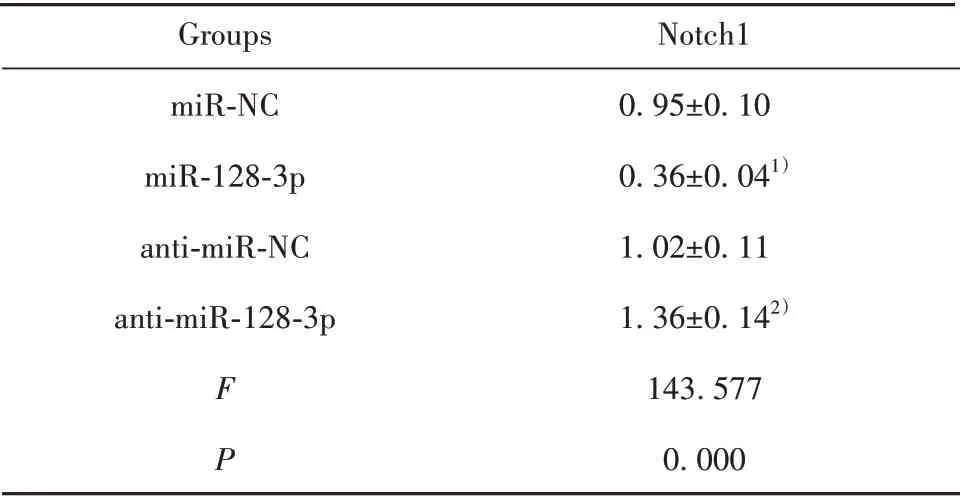
表5 miR-128-3p对Notch1蛋白表达的影响(±s,n=9)Tab.5 Effect of miR-128-3p on expression of Notch1 pro⁃tein(±s,n=9)
Note:Compared with miR-NC group,1)P<0.05;compared with antimiR-NC group,2)P<0.05.
Groups miR-NC miR-128-3p anti-miR-NC anti-miR-128-3p F P Notch10.95±0.100.36±0.041)1.02±0.111.36±0.142)143.5770.000
2.5 过表达Notch1可逆转过表达miR-128-3p对Ishikawa细胞增殖和凋亡的影响 与miR-128-3p+pcDNA-NC组 比 较,miR-128-3p+pcDNA-Notch1组Ishikawa细胞存活率、Notch1和cyclinD1蛋白水平升高(P<0.05),细胞凋亡率和cleaved-caspase-3蛋白水平降低(P<0.05)。见图5和表6。
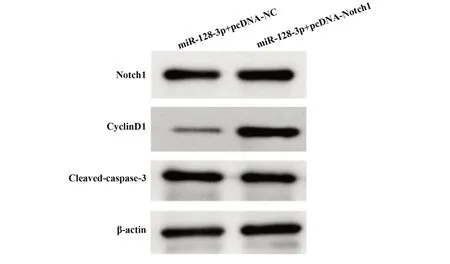
图5 Western blot检测Notch1、cyclinD1、cleaved-caspase-3蛋白表达Fig.5 Western blot detected expressions of Notch1,cyclinD1 and cleared-caspase-3 proteins
表6 过表达Notch1可逆转过表达miR-128-3p对Ishikawa细胞增殖和凋亡的影响(±s,n=9)Tab.6 Overexpressing Notch1 reversed effect of overexpressing miR-128-3p on Ishikawa cell proliferation and apoptosis(±s,n=9)
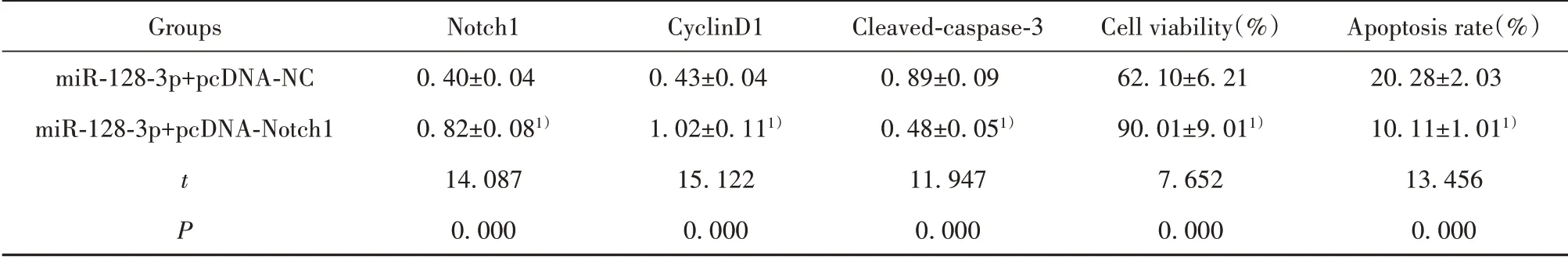
表6 过表达Notch1可逆转过表达miR-128-3p对Ishikawa细胞增殖和凋亡的影响(±s,n=9)Tab.6 Overexpressing Notch1 reversed effect of overexpressing miR-128-3p on Ishikawa cell proliferation and apoptosis(±s,n=9)
Note:Compared with miR-128-3p+pcDNA-NC group,1)P<0.05.
Groups miR-128-3p+pcDNA-NC miR-128-3p+pcDNA-Notch1 t P Notch10.40±0.040.82±0.081)14.0870.000 CyclinD10.43±0.041.02±0.111)15.1220.000 Cleaved-caspase-30.89±0.090.48±0.051)11.9470.000 Cell viability(%)62.10±6.2190.01±9.011)7.6520.000 Apoptosis rate(%)20.28±2.0310.11±1.011)13.4560.000
2.6 过表达Notch1可逆转过表达miR-128-3p对Ishikawa细胞Wnt/β-catenin信号通路的影响 与miR-NC组比较,miR-128-3p组Ishikawa细胞β-catenin蛋白水平降低(P<0.05)。与miR-128-3p+pcDNANC组比较,miR-128-3p+pcDNA-Notch1组β-catenin蛋白水平升高(P<0.05)。见图6和表7。
表7 Western blot检测β-catenin蛋白表达(±s,n=9)Tab.7 Western blot detected β-catenin protein expression(±s,n=9)
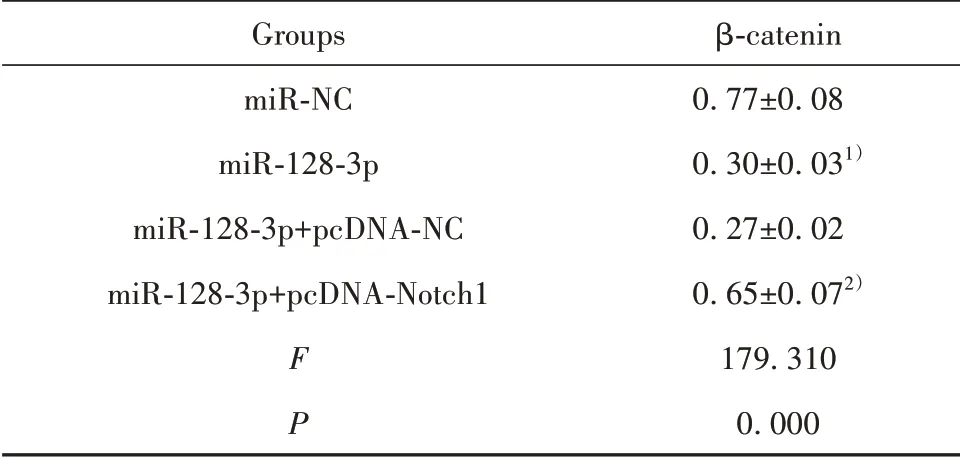
表7 Western blot检测β-catenin蛋白表达(±s,n=9)Tab.7 Western blot detected β-catenin protein expression(±s,n=9)
Note:Compared with miR-NC group,1)P<0.05;compared with miR-128-3p+pcDNA-NC group,2)P<0.05.
Groups miR-NC miR-128-3p miR-128-3p+pcDNA-NC miR-128-3p+pcDNA-Notch1 F P β-catenin 0.77±0.080.30±0.031)0.27±0.020.65±0.072)179.3100.000
3 讨论
miRNA的长度约为18~25个核苷酸,在转录后调控靶基因的表达,影响肿瘤的发生、发展。miR-128-3p是近年来新发现的一种miRNA。CHEN等[10]研究显示,间变性甲状腺癌细胞和组织中miR-128-3p表达水平降低,过表达miR-128-3p可降低癌细胞活力,并诱导细胞凋亡。FU等[11]研究显示,miR-128-3p在胶质瘤组织中表达降低,过表达miR-128-3p通过靶向抑制gremlin1表达抑制胶质瘤细胞活性。ZHAO等[12]研究显示,过表达miR-128-3p通过靶向抑制LIM结构域激酶1表达抑制乳腺癌细胞的增殖和迁移能力。目前,还未见miR-128-3p影响EC细胞生物学行为的相关报道。
本研究显示,miR-128-3p在EC细胞系中表达降低,提示miR-128-3p作为促癌基因参与该疾病的发生发展。通过转染miR-128-3p mimics构建过表达miR-128-3p的Ishikawa细胞,结果显示,过表达miR-128-3p后,Ishikawa细胞存活率降低,凋亡率升高,提示过表达miR-128-3p抑制Ishikawa细胞增殖,促进细胞凋亡。cyclinD1是细胞周期调控蛋白,促进细胞由G1期向S期转变,加速细胞增殖[13]。cas‐pase-3是caspase级联反应的关键调控蛋白,其活化后促进细胞凋亡[14]。本研究显示,过表达miR-128-3p可降低Ishikawa细胞中cyclinD1蛋白表达,促进活化的caspase-3蛋白表达,提示miR-128-3p通过调控cyclinD1和活化的caspase-3蛋白表达影响Ishikawa细胞的增殖和凋亡。为了进一步探讨miR-128-3p影响EC细胞增殖和凋亡的作用机制,本研究生物信息学遇见预测显示,Notch1可能是miR-128-3p的靶基因。本研究通过双荧光素酶活性检测证实了miR-128-3p可与Notch1的3'UTR靶向结合。此外,上调Ishikawa细胞中miR-128-3p表达后,Notch1蛋白表达降低,而下调miR-128-3p表达后,Notch1蛋白表达升高,进一步说明miR-128-3p靶向负调控Notch1表达。
Notch1是Notch受体家族成员之一,在胰腺导管腺癌、非小细胞肺癌等肿瘤中发挥促癌作用[15-16]。本研究结果显示,EC细胞系中Notch1 mRNA和蛋白表达升高,低表达Notch1可抑制EC细胞增殖,并诱导细胞凋亡,与相关研究结果一致,提示Notch1作为促癌基因参与EC发生发展,靶向抑制其表达对于该疾病的治疗具有重要意义[9]。本研究还显示,过表达Notch1逆转了过表达miR-128-3p对Ishikawa细胞增殖和凋亡的影响,提示过表达miR-128-3p通过靶向抑制Notch1表达,进而抑制Ishikawa细胞增殖,并促进细胞凋亡。
Wnt/β-catenin信号通路的激活可引起β-catenin转位至细胞核,激活下游靶基因如cyclinD1、c-myc等表达,从而参与肿瘤的发生、发展。如彭宁等[17]研究显示,沉默肝癌细胞中ZNF674-AS1的表达可通过抑制Wnt/β-catenin信号通路抑制肝癌细胞的增殖,并诱导细胞凋亡。研究已表明,抑制Wnt/βcatenin信号通路的激活可抑制EC细胞增殖、迁移和侵袭[18-19]。本研究结果显示,过表达miR-128-3p可降低Ishikawa细胞中β-catenin和cyclinD1蛋白表达,而过表达Notch1逆转了过表达miR-128-3p对Ishikawa细胞中β-catenin和cyclinD1蛋白表达的抑制作用,提示过表达miR-128-3p通过抑制Notch1表达,进而抑制Wnt/β-catenin信号通路的激活影响Ishikawa细胞的增殖和凋亡。
综上所述,miR-128-3p在EC细胞中呈低表达,过表达miR-128-3p可抑制EC细胞增殖,并促进细胞凋亡,其可能通过靶向抑制Notch1表达及Wnt/βcatenin信号通路的激活发挥作用,是EC治疗的潜在分子靶点。