姜黄素对HIV-1辅助受体CCR5启动子的干预作用①
2021-09-25李志慧郑文锦夏金婵李晓娟
李志慧 冯 龙 郑文锦 孙 颖 夏金婵 梅 雪 江 华 李晓娟
(河南中医药大学医学院,郑州450046)
获得性免疫缺陷综合征(AIDS)是由人类免疫缺陷病毒(HIV)引起的传染性疾病。HIV-1 进入靶细胞需要两种受体:主要受体CD4 和辅助受体CCR5(或CXCR4)[1]。辅助受体CCR5(或CXCR4)首先与CD4 分子结合,形成二聚复合体,然后HIV gp120 再与辅助受体结合,使其发生构象改变,暴露gp41 位点,从而引发HIV 病毒包膜与靶细胞膜的融合[2-4]。趋化性细胞因子受体CCR5(CC-chemokine receptor 5,CCR5)作为嗜巨噬细胞性HIV-1 病毒的辅助受体,近年来备受关注。因此,干预CCR5 的启动子,阻断HIV 早期感染,为防治艾滋病带来了新希望。
姜黄素是从传统中药姜黄根茎中提取的活性成分,具有强大的抗肿瘤、抗炎、抗氧化功能[5]。近年研究发现,姜黄素可以使慢性感染HIV-1和HSV-2的T细胞和原代人类生殖器上皮细胞的病毒复制显著降低[6]。同时,姜黄素也是HIV 整合酶和蛋白酶的抑制剂[7]。因此,姜黄素的分子结构可以作为抗HIV 新药设计的结构基础,具有开发潜力。但姜黄素抑制HIV 感染辅助受体CCR5 的确切机制仍然没有探明,欠缺明确的科学证据。因此,本研究采用双荧光素酶报告基因技术,以萤火虫荧光素酶作为报告基因,用于反映CCR5 启动子的活性。载体下游重组入海肾荧光素酶(hRluc)基因,作为本底对照报告基因。通过序列分析,发现由于hRluc 单元具有两个SV40 增强子,使hRluc 基因表达活性较强,削弱了上游萤火虫荧光素酶的表达,使得双荧光素酶报告基因表达载体不能真实反映出上游CCR5 启动子的活性[8]。因此,本实验对双报告系统进行优化,通过PCR 技术,扩增出了保留hRluc 单元中SV40 部分片段的基因片段(命名该基因片段为Rluc)。将CCR5 启动子基因片段和Rluc 基因片段分别克隆入pGL4.10 表达载体,成功构建重组载体pFireRluc-CCR5,提高了双荧光素酶报告基因技术的灵敏性和准确性。将该重组载体瞬时转染293T细胞,姜黄素对CCR5 启动活性的影响可以通过海肾荧光素酶与萤火虫荧光素酶活性的比值表达。本实验通过双荧光素酶的比值反映出姜黄素对趋化因子受体CCR5启动子活性起到抑制作用。
1 材料与方法
1.1 材料 人胚肾上皮细胞系293T细胞购自中国典型培养物保藏中心。姜黄素购自Sigma-Aldrich公司(批号:LRCOS107),用无水乙醇配制成10 µmol/L 的母液,使用时稀释到所需浓度。质粒提取试剂盒、胶回收试剂盒、清洁试剂盒购自Axy-Gene 公 司(批 号 分 别 为08218KA1、25917KE1、33914KB1);pGL4.10 质粒、pGEM-T 载体、E1960 荧光检测试剂盒均购自Promega 公司(批号分别为0000185341、0000172570、0000306998);Cell Count‐ing Kit-8 细胞增殖-毒性测试试剂盒购自东仁化学科技(上海)有限公司(批号:NN699);引物合成及序列分析由上海生工生物工程有限公司完成;普通PCR 仪购自美国Labnet;隔水式恒温培养箱购自上海精宏公司;低温高速离心机购自德国Eppendorf;多功能微孔板测读仪购自德国Berthold;酶标仪及凝胶成像分析仪购自美国Bio-Rad。
1.2 方法
1.2.1 细胞培养 人胚肾上皮细胞系293T细胞培养于10% 胎牛血清和1% 青-链霉素的DMEM 培养基中,置于37℃、5%CO2的恒温培养箱中。每2~3 d更换一次培养液,细胞达80%~90% 生长融合时,胰蛋白酶消化后制成单细胞悬液,接种于6孔板、96孔板或培养瓶中用于实验研究及传代。
1.2.2 引物设计 以pmir GLO 载体为模板进行PCR 扩增,获得Rluc 表达单元。以人基因组为模板进行PCR 扩增,获得CCR5 启动子表达单元,引物序列如表1。

表1 引物序列Tab.1 Primer sequence
1.2.3 pFireRluc-CCR5 载体构建 使用分子克隆技术,构建pFireRluc-CCR5表达载体:①PCR获得目的基因片段:根据Rluc 基因编码区序列设计特异引物Rluc-F、Rluc-R,根据CCR5 启动子基因编码区序列设计特异引物CCR5-F、CCR5-R。抽取健康人血液,用血液基因组DNA 提取试剂盒提取人基因组模板,以人DNA 为模板PCR 扩增出CCR5 启动子基因片段,以pmir GLO 载体为模板扩增加出Rluc表达单元,如表1。 ②构建重组载体pGEM-T-CCR5 和pGEM-T-Rluc:DNA 连接酶分别将CCR5 和Rluc 表达单元与pGEM-T 载体连接,获得重组载体pGEMT-CCR5 和pGEM-T-Rluc,分别将其转化入感受态细菌DH5α,并进行氨苄青霉素筛选。③构建重组载体pFireRluc:用限制性内切酶SalⅠ对pGEMT-Rluc和pGL4.10进行单酶切,并对双黏载体pGL4.10进行去磷酸化处理,用T4 DNA 连接酶将Rluc 表达单元与磷酸化的pGL4.10 进行连接,转化入感受态细菌DH5α。④酶切鉴定正反插入:挑选pFireRluc 阳性克隆,用StuⅠ、XbaⅠ双酶切鉴定正反插入,若正向插入则送上海生工测序,测序正确获得双荧光素酶报告基因表达载体pFireRluc。⑤构建重组载体pFireRluc-CCR5:用限制性内切酶XhoⅠ和NheⅠ对pGEM-T-CCR5 和pFireRluc 进行双酶切,用T4 DNA连接酶将CCR5表达单元与磷酸化的pFireRluc双黏载体进行连接获得重组载体pFireRluc-CCR5,转化入感受态细菌DH5α。挑选pFireRluc-CCR5 阳性克隆,送上海生工测序,测序正确获得双荧光素酶报告基因表达载体pFireRluc-CCR5。
1.2.4 CCK-8法测定姜黄素对293T细胞的毒性细胞培养至对数生长期时进行实验,制备5×104个/L的细胞悬液,接种于96 孔板中,每孔加入100 µl 细胞悬液,24 h 后加入含不同浓度姜黄素(10、20、40、60、80 µmol/L)的完全培养基(每孔设3 个复孔)。于加药24 h 后进行CCK-8 比色实验。每次于比色前1 h,每孔加入CCK-8 溶液10 µl,继续培养1 h 后,在450 nm 处进行吸光度OD 值测定。计算各实验组抑 制 率(%)=OD(对照组−实验孔)/OD(对照孔−空白孔)×100%。 此实验重复3次。
1.2.5 细胞分组及转染 根据CCK-8 检测结果将293T 细胞分组:对照组(Control)为不转染pFire-Rluc-CCR5 的293T 空细胞、无水乙醇对照组(Alco‐hol)、实验组(0、10、20、40、60、80 µmol/L 姜黄素)。转染步骤参照脂质体LipofectamineTM2000 转染说明进行。转染前1 d 以3.6×105个/孔细胞接种于6 孔板,置于体积分数10% 胎牛血清(FBS)的细胞培养基中,5%CO2、37℃常规培养。 细胞融合率达到60%~70% 时,用脂质体包裹转染质粒pFireRluc-CCR5 入293T 细胞中,转染6 h 后,更换体积分数10% 胎牛血清(FBS)的细胞培养基,加入一定浓度的姜黄素继续培养24 h。
1.2.6 双荧光素酶活性的检测 姜黄素作用于已转染pFireRluc-CCR5 的293T 细胞,5%CO2、37℃常规培养24 h 后,收集细胞,按照双荧光素酶报告基因试剂盒说明书步骤操作,用Glomex20/20 检测仪检测各组细胞的海肾荧光素酶和萤火虫荧光素酶荧光值,每个药物浓度分别设置3个复孔。
1.3 统计学处理 实验结果采用GraphPad Prism 8统计软件,以单因素方差分析的方法,分析加药实验组与对照组间差异是否具有显著性,选取P<0.05表示差异具有统计学意义。
2 结果
2.1 Rluc 表达单元和CCR5 启动子表达单元扩增结果 提取人基因组DNA 后,PCR 扩增,胶回收获得Rluc 和CCR5 启动子基因片段,电泳结果显示:2000 bp及1000 bp处下侧各见一条阳性条带,与引物设计的目的片段Rluc和CCR5启动子的理论大小相对应,表明Rluc 和CCR5 启动子的基因片段扩增成功(图1)。
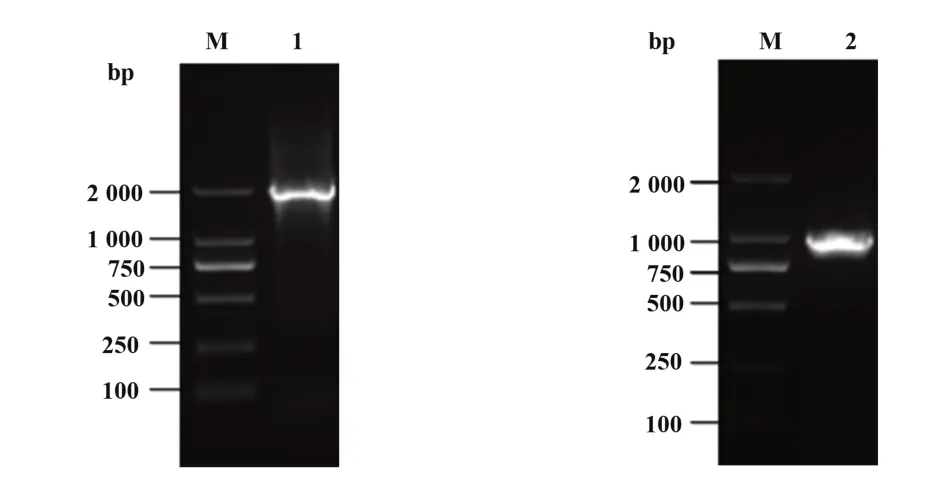
图1 重叠PCR得到Rluc表达单元和CCR5启动子表达单元Fig.1 Overlapping PCR to obtain Rluc and CCR5 pro⁃moter expression unit
2.2 pFireRluc-CCR5 重组载体的酶切鉴定结果核酸内切酶酶切鉴定正反插入结果pFireRluc 重组载体大小为6239 bp,经StuⅠ、XbaⅠ双酶切,正向连接者产生5935 bp 和304 bp 两个片段,如图2 所示,证实pFireRluc 为正向插入克隆。测序结果进一步证实克隆入载体的Rluc基因和CCR5启动子基因符合实验设计的要求,且无移码突变和点突变,部分测序结果如图3、4。
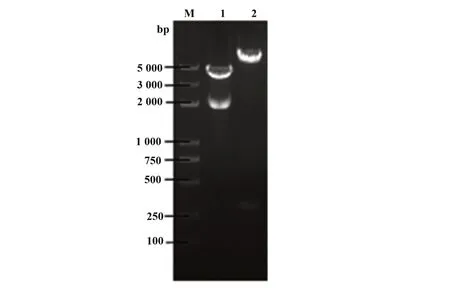
图2 酶切后的pFireRluc-CCR5分子Fig.2 pFireRluc-CCR5 molecule after digestionNote:M.Marker;1.SalⅠdigestion result;2.StuⅠ,XbaⅠdouble enzyme digestion result.
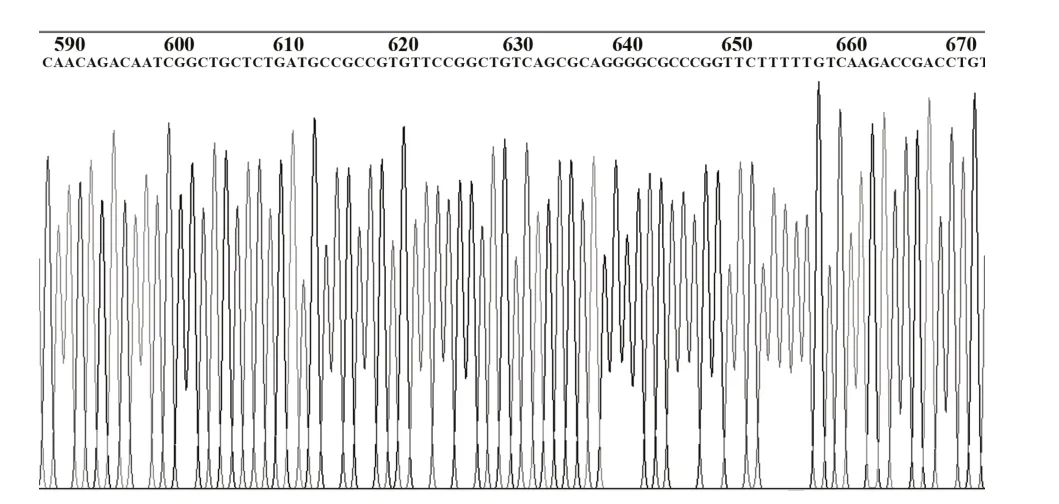
图3 Rluc表达单元的测序结果图Fig.3 Sequencing results of Rluc expression unit
图4 CCR5启动子表达单元的测序结果图Fig.4 Sequencing results of CCR5 promotor expression unit
2.3 姜黄素对293T细胞的毒性作用 为了探究姜黄素对293T细胞活性的影响,采用CCK-8检测细胞活性。实验结果显示:当姜黄素浓度低于80 µmol/L时,293T 细胞存活率维持在80% 以上,对293T 细胞的活性无明显影响;当浓度达到100 µmol/L 时,细胞活性降至80% 以下(图5)。因此,本研究选择了对细胞无显著毒性的10、20、40、60、80 µmol/L 剂量进行后续实验。
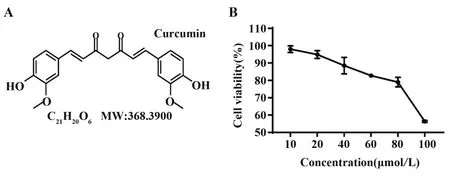
图5 姜黄素对293T细胞活性的影响(n=3)Fig.5 Effect of curcumin on cell viability of 293T(n=3)
2.4 双荧光素酶活性的检测
2.4.1 pFireRluc-CCR5 双荧光素酶报告基因表达载体活性验证 没有转染pFireRluc-CCR5 重组质粒的对照组(Control)与pFireRluc-CCR5转染组相比差异有统计学意义(P<0.05),实验结果如图6 所示,说明pFireRluc-CCR5 重组质粒转染成功,且所构建载体具有活性。
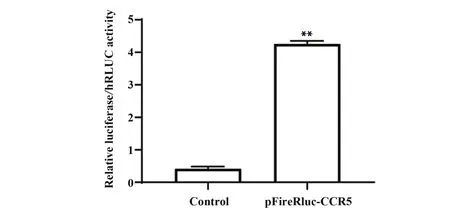
图6 pFireRluc-CCR5转染对荧光素酶表达的影响Fig.6 Effect of pFireRluc-CCR5 transfection on lucifer⁃ase expression
2.4.2 姜黄素对CCR5 启动子活性的影响 为了进一步检验姜黄素对CCR5 启动子活性的影响,将转染pFireRluc-CCR5 重组载体的293T 细胞,给予不同浓度的姜黄素处理24 h,测定各组荧光强度。实验结果如图7所示,与0 µmol/L姜黄素处理组相比,无水乙醇对照组荧光强度无显著变化,说明姜黄素溶剂无水乙醇对CCR5 启动子活性无明显影响(P=0.9956)。且随着姜黄素浓度的升高,CCR5启动子活性显著降低推测姜黄素对CCR5 启动子活性具有抑制作用。
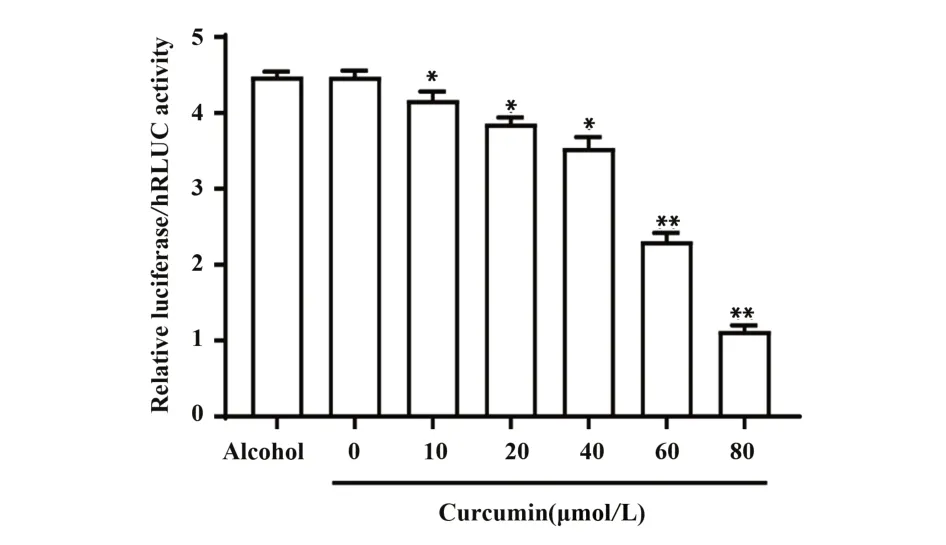
图7 姜黄素对荧光素酶表达的影响Fig.7 Effect of curcumin on expression of luciferase
3 讨论
HIV变异极其迅速,难以制备特异性疫苗,而现有抗HIV 药物普遍存在毒副作用较大和易产生耐药的问题[9]。目前艾滋病仍然是一项全球主要公共卫生问题[10-11]。趋化性细胞因子受体CCR5 作为嗜巨噬细胞性HIV-1 病毒的辅助受体,近年来备受关注。因此,以CCR5 为靶点,阻断HIV-1 早期感染,为防治艾滋病带来了新希望。
姜黄的主要生物活性成分姜黄素,已被证明具有广泛的生物活性,包括抗炎、抗细菌、抗真菌、抗原虫、抗病毒等作用[12-14]。本研究发现:姜黄素能够显著降低趋化性细胞因子CCR5 启动子活性。推测姜黄素可能通过抑制CCR5 启动子活性下调细胞表面CCR5 蛋白表达来影响HIV-1 侵入人体。为了进一步验证姜黄素对CCR5 的作用机制,将海肾荧光素酶报告基因Rluc和CCR5启动子基因重组入含有Firely 荧光素酶报告基因的pGL4.10 表达载体上,构建了重组载体pFireRluc-CCR5,能够同时表达Firely和Rluc,并以Rluc 作为内对照,降低了本底的影响,提高了转染效率。将该双报告载体转染入293T 细胞,能够较真实反映出CCR5 启动子活性。空细胞对照组与转染重组载体pFireRluc-CCR5 组的双荧光酶报告实验结果显示:pFireRluc-CCR5 重组载体转染成功且所构建载体具有活性。通过用不同浓度的姜黄素对转染pFireRluc-CCR5 的细胞进行干预,双荧光酶报告基因实验结果显示:随着姜黄素浓度的增加,CCR5 启动子活性显著下调,提示姜黄素对CCR5 启动子具有抑制作用,且具有剂量依赖性。因此推测,姜黄素可能通过抑制CCR5 活性,减少细胞表面CCR5的表达从而影响HIV-1侵入人体。
综上,姜黄素可能通过抑制CCR5 活性从而影响HIV-1 侵入人体,姜黄素影响HIV-1 感染辅助受体CCR5 的直接作用机制,还需要进一步深入研究,也是本课题组下一步准备进行的研究内容,所获得的研究成果有望提升现有抗艾滋病治疗的效果,对减少抗病毒药物的使用及长期服药的毒副作用以及降低经济负担等具有重要意义。同时,pFireRluc-CCR5 双荧光素酶报告基因表达载体的成功构建,也为针对CCR5 靶点活性抑制剂的筛选奠定了基础。