茶藨子木层孔菌化学成分及其抗肿瘤活性
2021-09-24鲍梦雨曹宸贞李媛媛刘玉红
鲍梦雨, 曹宸贞, 李媛媛, 刘玉红, 马 艳
(山东中医药大学药学院,山东 济南 250355)
针层孔菌属为担子菌亚门、层菌纲、非褶菌目、锈革孔菌科[1],现有研究表明,该属真菌含有多糖、甾体类、萜类、黄酮类等活性成分,具有抗肿瘤、增强免疫、抗氧化等生物活性,呈现很好的市场开发前景[2]。
茶藨子木层孔菌Phellinusribis,为针层孔菌属药用真菌,寄生于山楂、梨树的活体根茎上[3],主要分布于中国、日本、韩国。目前,国内外已经从茶藨子木层孔菌中分离得到多糖类、色素类、神经酰胺类、苯骈呋喃类成分[4-6],并且发现它们有抗肿瘤、增强免疫、神经保护等活性[7-9]。为了进一步开发利用茶藨子木层孔菌资源,本实验对其甲醇提取物进行分离纯化,从中得到4个化合物,均为苯乙烯基吡喃酮衍生物。其中,化合物1~4均为首次从本真菌中分离得到,对肝癌HepG2的增殖均显示抑制作用,以1最显著。
1 材料
JMS-700高分辨质谱仪(日本捷欧路公司);Inova-600型核磁共振仪(美国Varian公司);半制备液相色谱仪(日本分光Jasco公司);柱色谱硅胶(63~210 μm,日本关东化学株式会社);薄层色谱硅胶GF254(德国Merck公司);Sephadex LH-20(美国GE Healthcare公司);Cosmosil 5C18-MS-Ⅱ半制备色谱柱(10 mm×250 mm,5 μm,日本Nacalai公司)。所用试剂均为分析纯或色谱纯。
茶藨子木层孔菌采集于济南历城山区,由山东中医药大学生药学教研室徐凌川教授鉴定为正品。
2 提取与分离
取1.8 kg茶藨子木层孔菌的干燥粗粉,用甲醇室温浸提30 d,提取液减压浓缩得浸膏20 g,浸膏用硅胶柱色谱进行初步分离,用二氯甲烷、二氯甲烷-乙酸乙酯(9∶1、1∶1)、乙酸乙酯、乙酸乙酯-甲醇(9∶1、7∶3、1∶1)依次洗脱,合并后得到7个流分Fr.1~7。
Fr.4经Sephadex LH-20(甲醇)得9个部分(Fr.4.1~Fr.4.9),Fr.4.5经制备HPLC甲醇-水(1∶1)分离纯化,得组分Fr.4.5.6,再经制备薄层氯仿-甲醇(7∶3),得化合物4(1.5 mg)。流分Fr.3用Sephadex LH-20(甲醇)分离,合并得到8个组分Fr.3.1~Fr.3.8,Fr.3.5用硅胶柱色谱氯仿-甲醇(20∶1)处理,再经HPLC柱甲醇-水(65∶35)制备,得化合物1(5 mg);Fr.3.7经HPLC制备纯化,用丙酮-水(32∶68,1%TFA)洗脱,得组分Fr.3.7.4(4.4 mg), 溶于500 μL甲醇,静置72 h,上清为化合物2(1.2 mg),沉淀为化合物3(1.8 mg)。
3 结构鉴定
化合物1:黄色粉末(甲醇),分子式C23H16O8。HRFAB-MSm/z: 421.089 8[M+H]+。1H-NMR (600 MHz,丙酮-d6)δ: 7.36 (1H,d,J=2.2 Hz,H-6′),7.35 (1H,d,J=16.1 Hz,H-7),7.26 (1H,dd,J=8.3,2.1 Hz,H-10′),7.19 (1H,d,J=1.9 Hz,H-9),7.06 (1H,dd,J=8.3,1.9 Hz,H-13),6.93 (1H,d,J=8.3 Hz,H-9′),6.90 (1H,s,H-4),6.88 (1H,d,J=8.3 Hz,H-12),6.83 (1H,d,J=15.9 Hz,H-6),2.67(3H,s,1′-CH3);13C-NMR (150 MHz,丙酮-d6)δ:158.3 (C-1),109.2 (C-2),161.1(C-3),95.7 (C-4),159.2 (C-5),117.5 (C-6),135.5 (C-7),128.9 (C-8),114.6 (C-9),146.4 (C-10),147.9 (C-11),116.5 (C-12),121.6 (C-13),32.2 (C-1′),196.9 (C-2′),119.4 (C-3′),154.8 (C-4′),121.3 (C-5′),115.3 (C-6′),145.9 (C-7′),148.4 (C-8′),116.3 (C-9′),120.9 (C-10′)。以上数据与文献[10]基本一致,故鉴定为inoscavin C。
化合物2:深黄色无定型粉末,分子式C21H14O7。HRFAB-MSm/z: 401.064 6[M+Na]+。1H-NMR (600 MHz,CD3OD)δ: 7.30 (1H,d,J=15.9 Hz,H-2′),7.20 (1H,d,J=2.1 Hz,H-2″),7.16 (1H,dd,J=8.2,2.1 Hz,H-6″),7.04 (1H,d,J=2.1 Hz,H-4′),6.96 (1H,s,H-3),6.94 (1H,dd,J=8.5,2.1 Hz,H-8′),6.83(1H,d,J=8.2 Hz,H-5″),6.83 (1H,s,H-7),6.77 (1H,d,J=8.2 Hz,H-7′),6.70 (1H,d,J=15.8 Hz,H-1′);13C-NMR (150 MHz,CD3OD)δ:158.3 (C-2),100.3 (C-3),161.3 (C-4),158.6 (C-6),96.5 (C-7),117.4 (C-1′),135.5 (C-2′),129.3 (C-3′),114.7 (C-4′),146.8 (C-5′),148.3 (C-6′),116.6 (C-7′),121.6 (C-8′),122.4 (C-1″),112.7 (C-2″),146.9 (C-3″),148.0 (C-4″),116.8 (C-5″),117.9 (C-6″),112.3 (C-3a),162.7 (C-7a)。以上数据与文献[11]基本一致,故鉴定为phellifuropyranone A。
化合物3:黄色粉末,分子式C20H12O8。HRFAB-MSm/z: 381.060 3[M+H]+。1H-NMR (500 MHz,CD3OD)δ:8.41 (1H,s,H-7),7.60 (1H,s, H-10),7.42 (1H,d,J=15.9 Hz,H-2′),7.08 (1H,d,J=1.9 Hz,H-4′),6.99 (1H,dd,J=8.5,1.9 Hz,H-8′),6.79(1H,d,J=8.3 Hz,H-7′),6.70 (1H,d,J=15.8 Hz,H-1′),6.52 (1H,s,H-4);13C-NMR (125 MHz,CD3OD)δ:162.0 (C-1),160.5 (C-3),99.9 (C-4),161.2 (C-6),115.4 (C-7),148.2(C-8),155.2 (C-9),111.8 (C-10),116.3 (C-1′),138.1 (C-2′),128.8 (C-3′),114.9 (C-4′),146.9 (C-5′),149.1 (C-6′),116.6 (C-7′),122.3 (C-8′),162.7 (C-4a),112.6 (C-6a),129.1 (C-10a),100.6 (C-10b)。以上数据与文献[12]基本一致,故鉴定为phelligridin D。
化合物4:橙黄色粉末,分子式C25H18O9。HRFAB-MSm/z: 463.103 8[M+H]+。1H-NMR (600 MHz,CD3OD)δ: 7.43 (1H,d,J=15.9 Hz,H-7),7.08 (1H,d,J=1.9 Hz,H-9),6.99 (1H,dd,J=8.8,1.9 Hz,H-13),6.79 (1H,d,J=8.2 Hz,H-12),6.74 (1H,d,J=15.2 Hz,H-6),6.74 (1H,d,J=8.9 Hz,H-10′),6.70(1H,d,J=2.1 Hz,H-7′),6.58 (1H,dd,J=8.3,2.1 Hz,H-11′),6.49 (1H,s,H-4),5.65 (1H,s,H-5′),5.57 (1H,s,H-2′),1.97 (3H,s,1′-CH3);13C-NMR (150 MHz,CD3OD)δ:160.6 (C-1),99.5 (C-2),176.8 (C-3),95.5 (C-4),167.0 (C-5),117.3 (C-6),139.9 (C-7),128.5 (C-8),115.1 (C-9),146.9 (C-10),149.4 (C-11),116.6 (C-12),122.6 (C-13),192.9 (C-1′),105.1 (C-2′),203.1 (C-3′),94.5 (C-4′),95.9 (C-5′),123.2 (C-6′),115.5 (C-7′),146.3 (C-8′),147.8 (C-9′),115.9(C-10′),120.2(C-11′),16.6(C-1′CH3)。以上数据与文献[13]基本一致,故鉴定为inoscavin A。
4 抗肿瘤活性筛选
参照文献[14]方法,测定化合物1~4在不同浓度下对肝癌HepG2细胞的抑制率。实验组每孔加入20 μL样品溶液,终浓度分别为5、10、20、40、80、160 μmol/L,同时设空白对照组、阳性对照组(5-Fu,终浓度为80 μmol/L),每组重复6次,结果见图1。由此可知,化合物1~4对肝癌HepG2细胞增殖的抑制活性在5~160 μmol/L浓度范围内呈现出较好的剂量依赖性;在浓度为160 μmol/L时,各化合物对HepG2细胞的抑制率分别为71.8%、63.1%、45.2%、56.5%,即1抑制作用较强。
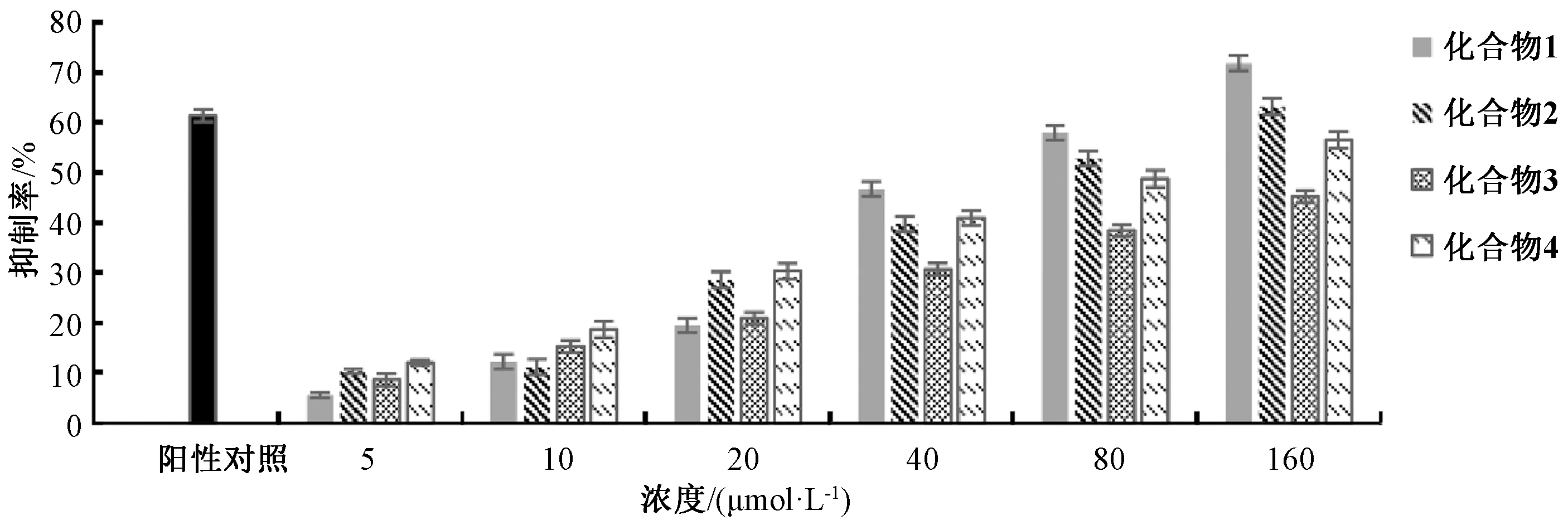
图1 各化合物对HepG2细胞的抑制作用Fig.1 Inhibitory effects of various compounds on HepG2 cells
5 讨论
茶藨子木层孔菌在中国、韩国作为传统药物被用于抗肿瘤[15],疗效确切,以往对其抗肿瘤活性的研究主要集中在水溶性大分子多糖类成分[16],关于其小分子成分及抗肿瘤活性筛选的报道较少。本实验在前期研究的基础上,从茶藨子木层孔菌中分离鉴定出了4个苯乙烯基吡喃酮类化合物,均为首次从该真菌中分离得到。
据文献报道,化合物1、4具有清除自由基和抑制Hela229细胞增殖的潜力[17];化合物2、3对小鼠黑色素瘤和人肺癌细胞株的增殖有抑制作用,两者GI50值分别为5.6~31.3、7.1~22.6 μmol/L[11]。另外,化合物4有强效脂氧合酶抑制活性[18],化合物3还具有抗炎、抗氧化作用[19],证明茶藨子木层孔菌具有较好的药物开发前景。
本研究显示,化合物1~4均具有明显的抑制肝癌HepG2细胞增殖的活性,并在5~160 μmol/L浓度范围内呈现出较好的剂量依赖性。其中,化合物1较化合物2对肝癌HepG2细胞的抑制作用强,可能是前者、结构多1个醛基;化合物4对肝癌HepG2细胞的抑制作用较化合物2弱,其结构多1个五元环,可能破坏了呋喃并吡喃酮环的平面性,后期可进一步考察其构效关系。本实验丰富了茶藨子木层孔菌活性成分的研究,并为苯乙烯基吡喃酮类成分抗肿瘤的作用机制研究提供了参考,也为后期该真菌药理活性研究提供了依据。
