不同类型氮输入对三峡库区消落带紫色潮土氮赋存形态的影响
2021-09-24何立平林俊杰段林艳
何立平, 林俊杰*, 段林艳, 陆 伟
1.重庆三峡学院, 三峡库区水环境演变与污染防治重庆高校市级重点实验室, 重庆 404100 2.三峡库区生态和灾害防治重庆市协同创新中心, 重庆 404100
三峡大坝成功蓄水后,库区水流减缓,部分支流水体富营养化加重且出现水华现象[1-2],陆源氮输入是导致该结果的主要原因之一[3-4]. 消落带是水陆交错的过渡地带,受水库运行影响,三峡消落带处于周期性淹水和落干状态,其土壤氮释放问题已成为关注的热点[5-7].
目前,针对土壤氮形态的研究主要探讨了耕作制度[8-10]、土壤修复[11-13]、气候条件、地理位置[14]和土壤性质[15]等因素对硝态氮、铵态氮、溶解性有机氮、微生物氮、矿物和团聚体结合态有机氮等的影响,为提高氮素有效性和减少氮流失提供了重要依据. 然而,上述研究尚缺乏考虑氮素与土壤颗粒之间的赋存形态. 土壤氮素释放潜力是由其与土壤颗粒之间的赋存形态决定的[16-17],氮素在土壤中的赋存形态可分为离子交换态氮(IEF-N)、碳酸盐结合态氮(CF-N)、铁锰氧化物结合态氮(IMOF-N)、有机及硫化物结合态氮(OSF-N)和非可转化态氮(NTF-N)[18]. 其中,IEF-N是指可被中性盐类交换的无机氮,最易在水-土界面发生迁移并进入水体;CF-N主要是指碳酸盐矿物中的固定态铵[19],在土壤pH下降时可溶解释放;IMOF-N主要是指铁锰氧化物吸附态硝态氮和有机氮,在土壤氧化还原电位降低和氮矿化时可转化为IEF-N释放[20-21];OSF-N是指以有机态赋存的部分或未分解的有机态氮[22],可通过微生物矿化进一步释放[23];NTF-N是指土壤中最稳定的氮形态,主要包括固定态铵和腐殖质氮[22],在土壤中难以迁移和转化. 可见,除NTF-N外,其余土壤氮形态均可向IEF-N转化并进入水体.
氮素在三峡消落带土壤中的赋存形态决定了其进入水体的速率和通量,落干期消落带土地利用以农业耕作为主. 有关三峡消落带土壤氮赋存形态的研究主要集中于各形态氮含量之间的关系和转化过程[24-25]、其在流域尺度上的空间分布特征[26-28]、水文和植被等因素对其含量的影响[29]等,而针对氮肥输入对土壤氮素赋存形态的影响研究鲜有报道[30]. 紫色潮土是三峡库区消落带分布面积最大的土壤类型[31],该研究以紫色潮土为研究对象,采用室内培养法,模拟淹水、落干2种水文条件和NaNO3、NH4NO3、(NH4)2SO4、CO(NH2)24种氮肥输入情况,探讨水文条件和氮输入类型对三峡库区消落带紫色潮土氮素赋存形态的影响,以期为三峡流域农业氮肥科学施用及水体富营养化防治提供参考.
1 材料与方法
1.1 研究区域与样品采集
三峡消落带位于湖北省和重庆市部分区域,面积约349 km2,属亚热带季风性湿润气候,年均气温18.2 ℃,年降雨量1 053.15 mm. 三峡水库水位周期性涨落,落干期消落带土壤暴露于空气中,淹水期则被淹没于水下[32-33].
于2018年6月三峡水库水位最低时,在万州段消落带(30°47.28′N~30°50.10′N、108°21.35′E~108°23.41′E),使用蛇形布点法于145~175 m水位高程内随机采集表层(0~20 cm)土样20个,立即4 ℃ 保存送实验室. 土样经动植物残体及石砾剔除、冷冻干燥、过2 mm筛后于干燥器中备用. 土壤有机碳(SOC)、总氮(TN)、总磷(TP)、阳离子交换量(CEC)、最大田间持水量(WHC)等理化性质见表1,初始氮形态含量见表2.
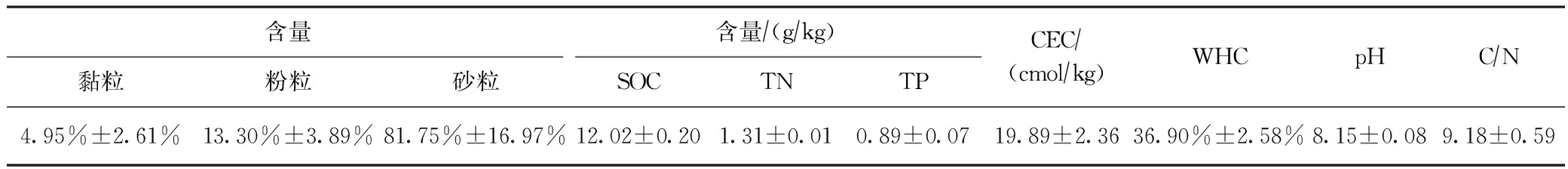
表1 消落带土壤理化性质

表2 消落带土壤中不同氮形态的含量
1.2 土壤培养
落干试验:将20 g土壤样品平铺于50 mL塑料瓶底部,调整含水率为50% WHC. 使用parafilm膜密封瓶口并开小孔透气,置于20 ℃培养箱预培养24 h,以消除物理扰动的影响. 添加3.6 mL氮溶液(对照土样添加3.6 mL去离子水)使土壤含水量为 60% WHC,此时土壤氮添加量为150 mg/kg.
淹水试验:在落干处理基础上,另加40 mL去离子水,使土壤完全淹没,用高纯氮(99.99%)排尽空气(O2体积分数<1×10-6).
落干和淹水试验均于第0、1、3、6、10、15天破坏性取样. 采用称重法保持土壤含水率恒定. 试验处理包括:2个水文条件(落干和淹水)×5种氮处理(4种氮添加类型+1个对照)×3个重复×6次破坏性取样,总计180个土样. 其中,氮添加类型包括硝酸钠(NaNO3)、硝酸铵(NH4NO3)、硫酸铵〔(NH4)2SO4〕和尿素〔CO(NH2)2〕.
1.3 化学分析方法
土壤IEF-N、CF-N、IMOF-N、OSF-N和NTF-N含量采用连续分级提取法测定[18]. 土壤NH4+-N、NO2--N和NO3-N含量分别采用靛酚蓝分光光度法、盐酸萘乙二胺分光光度法和镉柱还原-分光光度法测定. 土壤TN含量和pH分别采用元素分析仪和酸度计(水土比为5∶1)测定. 土壤质地和SOC含量分别采用比重计法[34]和重铬酸钾氧化-分光光度法测定. 土壤WHC采用重量法测定. 土壤TP含量和CEC分别采用碱熔-钼锑抗分光光度法和氯化钡缓冲液法测定[35].
1.4 氮形态含量变化计算方法
氮形态变化速率计算公式:
Ri=(Cin-Ci0)/n(n=1,3,6,10,15)
(1)
式中:Ri为第i种氮形态的变化速率,mg/(kg·d);Cin和Ci0分别为土壤培养第n天和第0天第i种氮形态的含量,mg/kg.
土壤培养结束后,氮形态含量变化在氮输入量中的占比(αi,%)计算公式:
αi=(Cif-Ccf)×100/AN
(2)
式中:Cif和Ccf分别为培养结束后各处理和对照土壤中第i种氮形态的含量,mg/kg;AN为氮添加量,mg/kg.
1.5 数据统计方法
采用ANOVA单因素方差分析法检验氮添加类型对培养结束后土壤氮形态含量及其变化在氮输入量中占比的影响. 采用指数衰减模型拟合培养期间氮形态变化速率与培养时间的关系. 采用线性混合模型检验水文条件与氮处理交互作用对土壤氮形态含量及其变化在氮输入量中的占比的影响. 采用多元线性回归分析拟合IEF-N含量变化占比与CF-N、IMOF-N、OSF-N、NTF-N含量变化占比之间的线性关系. 使用SPSS 18.0软件进行统计分析,使用SigmaPlot 12.5软件制图.
2 结果与分析
2.1 氮形态含量
研究区域内,无论是否添加氮素,土壤中OSF-N含量均表现为淹水期>落干期(见图1,P<0.001),IEF-N和IMOF-N含量均表现为落干期>淹水期(P<0.001),CF-N与NTF-N含量则无显著性差异(P>0.05). NaNO3、NH4NO3、(NH4)2SO4和CO(NH2)2添加下,落干期IEF-N含量分别为93.88、79.42、59.02和46.80 mg/kg,IMOF-N含量分别为11.59、16.81、19.40和24.39 mg/kg,OSF-N含量分别为122.18、126.21、137.53和148.19 mg/kg;淹水期IEF-N含量分别为65.60、56.95、42.46和32.94 mg/kg,IMOF-N含量分别为7.22、6.91、7.33和7.68 mg/kg,OSF-N含量分别为142.22、149.09、156.43和161.76 mg/kg. 落干期OSF-N与IMOF-N含量均在CO(NH2)2添加下最高(P<0.001),在NaNO3添加下最低(P<0.001),IEF-N含量表现与之相反(P<0.001);NTF-N与CF-N含量在4种氮添加类型间无显著性差异(P>0.05). 淹水期,除IMOF-N含量在不同氮添加类型间无显著性差异(P>0.05)外,其他氮形态含量分布均与落干期表现一致(P<0.001).
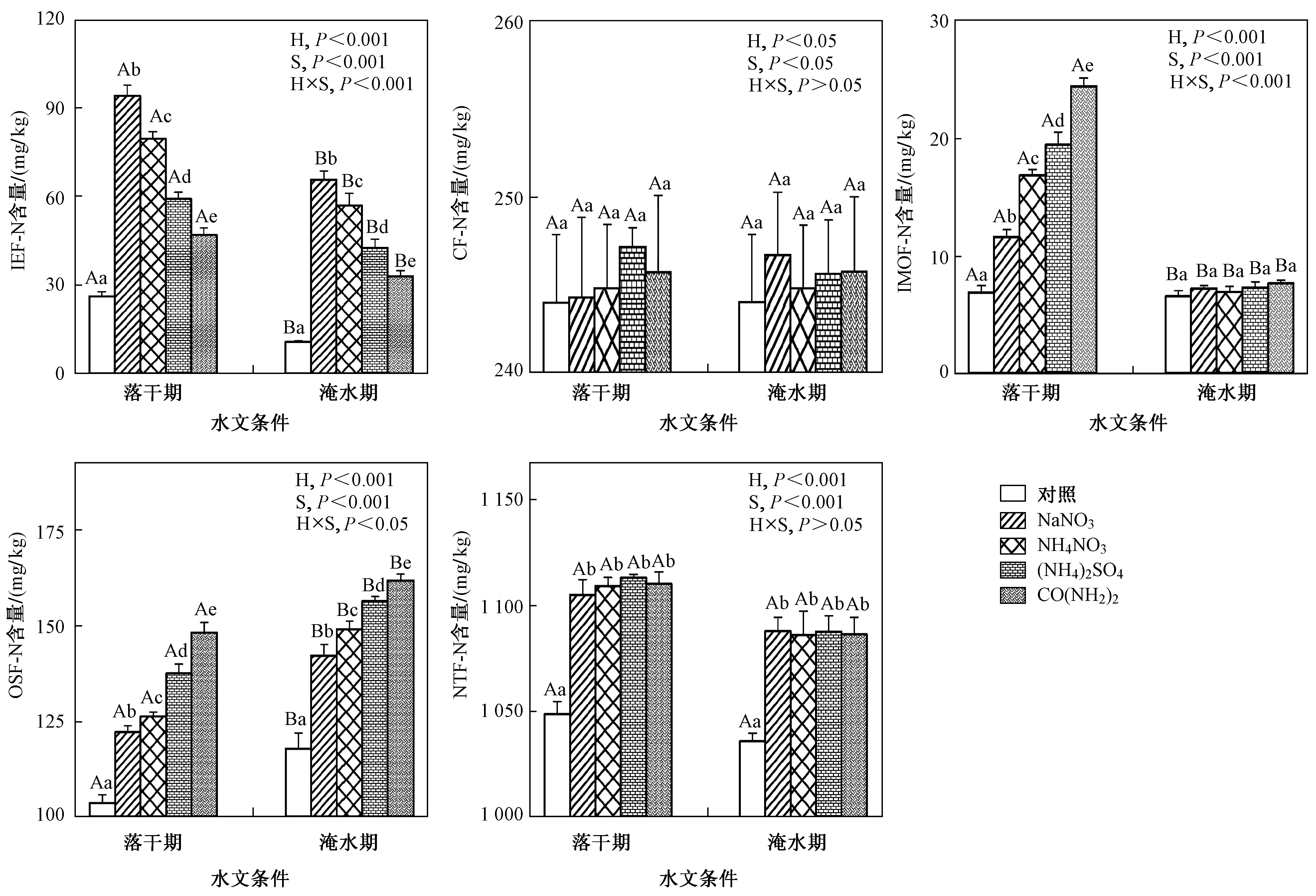
注:IEF-N、CF-N、IMOF-N、OSF-N和NTF-N分别为离子交换态氮、碳酸盐结合态氮、铁锰氧化物结合态氮、有机及硫化物结合态氮和非可转化态氮;培养时间为15 d;H表示不同水文条件;S表示不同氮添加类型;不同小写和大写字母分别表示氮形态含量在不同氮添加类型和水文条件间存在显著差异(P<0.05).图1 水文条件及氮添加类型对土壤氮形态含量的影响Fig.1 The influences of hydrological conditions and nitrogen addition types on soil contents of nitrogen fractions
2.2 氮形态变化速率
落干期和淹水期,在4种氮添加类型下,除CF-N外,IEF-N、IMOF-N、OSF-N和NTF-N变化速率与培养时间的关系均符合指数衰减模式(y=y0+ae-bx,见图2、3). 落干期和淹水期,无氮添加时,IEF-N变化速率随时间呈递减模式,氮添加时则与之相反. 落干期和淹水期,无论是否添加氮素,IMOF-N和OSF-N变化速率均随时间呈指数增加模式,NTF-N变化速率则与之相反. 落干期和淹水期,土壤培养0~3 d,氮添加下,IEF-N变化速率小于对照(P<0.01),IMOF-N和OSF-N变化速率则呈与之相反的趋势.

图2 落干期氮添加类型对土壤氮形态变化速率的影响Fig.2 The influences of nitrogen addition types on the change velocities of soil nitrogen fractions during the dry period
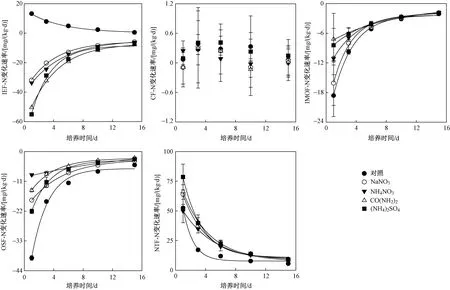
图3 淹水期氮添加类型对土壤氮形态变化速率的影响Fig.3 The influences of nitrogen addition types on the change velocities of soil nitrogen fractions during the flood period
2.3 氮形态变化占比
IEF-N和IMOF-N含量变化在氮输入总量中的占比均表现为落干期>淹水期(见图4,P<0.001),OSF-N变化占比则相反(P<0.05),CF-N和NTF-N变化占比在两个水文条件间无显著差异(P>0.05). NaNO3、NH4NO3、(NH4)2SO4和CO(NH2)2添加下,落干期,IEF-N变化占比分别为45.20%、35.56%、21.96%和13.82%,IMOF-N变化占比分别为3.14%、6.61%、8.34%和11.67%,OSF-N变化占比分别为12.33%、15.02%、22.57%和29.68%;淹水期IEF-N变化占比分别为36.57%、30.80%、16.21%和7.26%,IMOF-N变化占比分别为0.50%、0.35%、0.53%和0.77%,OSF-N变化占比分别为16.76%、21.84%、26.73%和30.29%. 落干期IEF-N变化占比在NaNO3添加下最高(P<0.001)、在CO(NH2)2添加下最低(P<0.001),IMOF-N和OSF-N变化占比则与之相反(P<0.001). 淹水期IEF-N和OSF-N变化占比分布特征与落干期一致(P<0.001),IMOF-N变化占比在不同氮添加类型间无显著性差异(P>0.05). IEF-N变化占比在落干期与IMOF-N、OSF-N变化占比均呈线性负相关(见表3,P<0.001),在淹水期仅与OSF-N变化占比呈线性负相关(P<0.001).
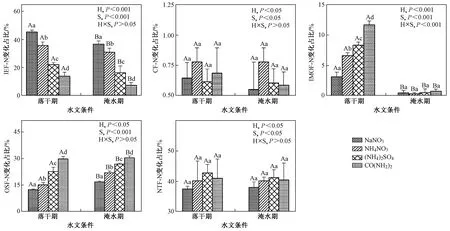
注:培养时间15 d;H表示不同水文条件;S表示不同氮添加类型;不同小写和大写字母分别表示氮形态变化在氮输入量中的占比在不同氮添加类型和水文条件间存在显著差异(P<0.05).图4 水文条件及氮添加类型对土壤氮形态变化占比的影响Fig.4 The influences of hydrological conditions and nitrogen addition types on the proportions of soil nitrogen fraction changes in the total nitrogen input

表3 落干期和淹水期土壤氮形态变化之间的关系
3 讨论
3.1 氮输入对土壤氮赋存形态的影响
落干期和淹水期,OSF-N含量及其变化在氮输入量中的占比在CO(NH2)2添加下最高,在NaNO3添加下最低(见图1、4,P<0.001),IEF-N含量及其变化占比则与之相反(P<0.001). 这表明4种氮类型中,CO(NH2)2最易被土壤固定形成OSF-N,而NaNO3则更易以IEF-N形式存在. 究其原因:① CO(NH2)2水解可产生NH4+,与NO3-相比,NH4+更易被土壤微生物同化[36];②与微生物生长的最佳C/N值(25)相比,土壤C/N值(9.18)偏低(见表1),尿素添加带来的碳输入更有利于氮素被微生物同化[37-38]. 氮肥施用时,添加硝化抑制剂能有效减少土壤氮流失[39],这与笔者所得结果一致. 一般认为,与NH4+相比,土壤胶体对NO3-的吸附能力较弱是导致NO3-比NH4+更易在土壤中发生迁移的原因,而该研究结果表明,相比NO3-而言,NH4+更易被土壤微生物固定形成OSF-N亦是导致上述结果的原因. 可见,减少三峡库区消落带土壤NO3-输入将有利于降低短期内土壤氮素因雨水淋溶进一步向三峡水体释放的风险,这为三峡水库富营养化的防治提供了方向.
与对照相比,氮添加下,落干期和淹水期OSF-N含量均显著增加(见图1,P<0.001),其变化占比与IEF-N变化占比呈线性负相关且相关系数最大(见表3,P<0.001),表明外源氮在落干期和淹水期主要向OSF-N转化. 氮输入使得土壤微生物无机氮同化作用增强是导致上述结果的主要原因[40]. 氮输入后,落干期和淹水期IEF-N变化速率均为负值(见图2、3),培养初期氮添加下OSF-N变化速率大于对照(P<0.01)的结果也支持了上述解释. 氮输入导致土壤微生物量氮减小[41],这与笔者所得结果相反,土壤pH差异可能是主要原因. 文献[41]中土壤偏酸性,氮输入导致土壤进一步酸化,抑制了微生物氮同化[42],而三峡消落带紫色潮土偏碱性(pH=8.15,见表1),短期少量氮添加对土壤pH影响较小,因此,得到了相反的结果. 氮添加后大棚蔬菜表层土壤有机氮含量显著升高[43],这与笔者所得结果一致. 可见,氮输入增加了消落带土壤氮素通过有机氮矿化逐渐向水体释放的风险.
与对照相比,氮添加下,落干期IMOF-N含量显著增加(见图1,P<0.001),其变化占比与IEF-N变化占比呈线性负相关(见表3,P<0.001),表明外源氮在落干期还存在向IMOF-N转化的过程. 外源氮向IMOF-N转化的途径有2种:①外源氮通过土壤黏土矿物非生物固定作用形成IMOF-N[44-45];②外源氮被微生物同化固定于土壤铁锰氧化物胶体表面. 鉴于落干期IMOF-N含量及其变化占比在各氮添加类型间的分布特征与OSF-N相同(见图1、4,P<0.001),笔者推测,外源氮的微生物同化过程亦是导致落干期IMOF-N含量增加的原因,要明确具体的转化途径,仍需进一步深入研究. 土壤微生物氮残体可吸附于森林土壤铁氧化物微粒表面[46],这与笔者所得结果相一致. IMOF-N在淹水条件下可被微生物还原释放[47-48],因此,落干期氮输入增加了消落带土壤氮素淹水释放的风险.
3.2 水文条件对土壤氮素赋存形态的影响
IEF-N含量及其变化占比表现为落干期>淹水期的结果表明,氮添加下,落干期消落带土壤氮释放的风险高于淹水期(见图1、4,P<0.001). 落干期和淹水期,土壤微生物有机氮矿化和无机氮反硝化能力的差异是导致上述结果的主要原因:①与淹水期相比,落干期土壤有机氮矿化速率更快[49],OSF-N含量及其变化占比均表现为落干期<淹水期(P<0.05)的结果也支持这一解释;②与落干期相比,淹水期IEF-N反硝化气态氮的释放能力更强[50]. 湿地土壤有机氮矿化速率随着淹水时间的增加呈逐渐下降趋势[51],这与笔者所得结果相一致. 淹水过程有利于消落带土壤有机氮矿化[52],这与笔者所得结果相反. 土壤培养条件的差异可能是主要原因. 与笔者所得结果相反的研究中,土壤经历了干湿交替过程,导致团聚体保护有机氮和微生物量氮的释放,促进有机氮矿化[53-54],而笔者的研究并未涉及干湿交替过程. 可见,为了防治三峡水体富营养化,落干期不仅应该严格禁止消落带上的农业种植活动,还应采取植被修复技术以减少土壤氮释放.
该研究初步探讨了氮输入对落干期和淹水期消落带土壤氮素赋存形态的影响,研究结果可为三峡流域农业氮施用和水体富营养化防治提供参考. 然而,该研究尚未考虑干湿交替环境变化的影响,仍需进一步探讨氮输入后土壤氮素赋存形态变化的生物及化学机制.
4 结论
a) 4种氮添加类型中,CO(NH2)2最易被土壤固定形成OSF-N,而NaNO3则更易以IEF-N形态存在.
b) 存在氮输入时,落干期消落带土壤氮释放的风险高于淹水期.
c) 落干期和淹水期,外源氮素主要表现为向OSF-N转化;此外,落干期外源氮素还存在向IMOF-N转化的过程. 这增加了消落带土壤氮素通过有机氮矿化和淹水释放途径持续向三峡水体释放的风险.
d) 减少落干期消落带土壤氮(特别是硝态氮)输入是防治三峡水库富营养化的有效途径.
