肺移植术后淋巴组织增生性疾病的研究进展
2021-09-24班乐张稷周敏王红梅毛文君陈静瑜
班乐 张稷 周敏 王红梅 毛文君 陈静瑜
肺移植已经成为治疗终末期肺病最有效的方法。1983年加拿大多伦多总院成功完成了世界首例肺移植,且受者长期存活[1]。随着肺移植技术的发展,肺灌注技术以及围手术期管理的进步,近30年来肺移植受者术后早期生存率明显提升。根据国际心肺移植学会(International Society for Heart and Lung Transplantation,ISHLT)统计[2],肺移植受者术后1、3、5年生存率分别为80%、65%、54%,其中位生存期为6.7年。但肺移植受者术后的长期存活较其它实体器官移植受者仍然存在差距,肺移植术后的远期并发症主要包括感染、慢性移植肺功能障碍(chronic lung allograft dysfunction,CLAD)、恶性肿瘤、心血管并发症等[3]。移植后淋巴组织增生性疾病(posttransplant lymphoproliferative disease,PTLD)为肺移植术后常见恶性肿瘤并发症,仅次于皮肤癌[4-6],其发生率为3.0%~8.0%[7-9]。在实体器官移植中,小肠移植受者的PTLD 发生率最高,其次是肺移植和心肺联合移植[4]。
PTLD是包含了从良性淋巴增生到恶性侵袭性淋巴瘤在内的一系列病理改变及临床表现的综合征,恶性侵袭性淋巴瘤进展迅速,如未得到及时有效治疗,预后极差,病死率很高,是肺移植术后潜在的致命并发症之一[10]。与其他实体器官移植相比,同种异体肺脏内淋巴组织较多,所需免疫抑制强度更高,因此肺移植受者PTLD的发生率较高。目前国内关于肺移植术后 PTLD 的研究较少,本文就肺移植术后PTLD的危险因素、病理分型、临床表现、诊断、治疗、预后和预防做一综述。
1 肺移植术后发生PTLD 的危险因素
1.1 病毒感染
1.1.1 爱泼斯坦-巴尔病毒 原发性爱泼斯坦-巴尔病毒(Epstein-Barr virus,EBV)感染在EBV阴性受者中是发生PTLD的一个公认的危险因素。60%~80%的PTLD病例与EBV感染有关[11]。EBV 感染后可导致体内被感染的B细胞克隆性增生,此活化增殖的过程在免疫功能正常的个体中会受到B细胞凋亡触发机制,而在肺移植受者中,免疫抑制导致T细胞抑制,从而导致缺乏T细胞对B细胞增殖的调节。特别是,当EBV血清学供者(donor,D)+/受者(recipient,R)-时,免疫抑制会导致EBV转化的B细胞不受控制地增殖,从而导致PTLD的发生。Peters等[12]对近30年4 171例接受实体器官移植的受者进行分析,其中109例发生PTLD(54例EBV阳性PTLD,41例EBV阴性PTLD),前者中位发病时间为1.2年,后者为7.6年(14例无相关资料)。根据Luskin等[13]的研究,1990年至1995年,PTLD中EBV阴性病例的比例为10%,1996年至2001年为19%,2002年至2007年为37%,2008年至2013年为49%,EBV 阴性 PTLD 病例近年来显著增多。如前所述,EBV阴性PTLD比EBV阳性PTLD发生时间晚,随着肺移植受者术后生存期的延长,可能导致迟发性PTLD的增加。EBV 阴性 PTLD 的发病机制是否与免疫抑制有关或另有机制尚不明确。
1.1.2 巨细胞病毒 巨细胞病毒(cytomegalovirus,CMV)感染导致淋巴细胞(主要是CD4+T细胞)减少,随后在感染消退时出现反应性、多克隆T细胞和B细胞增殖,这可能是随后PTLD发展的辅助因子。因此,CMV血清学D+/R-与移植术前EBV血清阴性受者PTLD的高风险相关[14]。
1.1.3 人类疱疹病毒8型 与 EBV 类似,人类疱疹病毒(human herpesvirus,HHV)-8能够感染 B 细胞和其他细胞类型并终生潜伏,在肺移植术后免疫抑制状态下,被感染的 B 细胞不受控制地增殖,从而导致PTLD[15]。与 EBV不同,HHV-8 感染在全球人群中并不普遍,某些种族的血清阳性率>50%,特别是在撒哈拉以南非洲以及拉丁美洲、加勒比海、地中海和中东国家,因此,发生移植后 HHV-8 相关疾病的风险主要取决于供者和受者所处的地理区域或种族起源中的 HHV-8 感染率。
1.2 年 龄
受者发生PTLD的风险因接受肺移植手术时的年龄不同而有所差异。Zaffiri等[16]对454例肺移植术后发生 PTLD 的病例进行回顾性分析发现,在肺移植术后1年内,行肺移植时年龄<45岁和年龄>62岁的受者发生PTLD的风险随着年龄的增长而降低;行肺移植时年龄45~62岁的受者发生PTLD的风险随着年龄的增长而增加。此外,年龄与肺移植术后不同时期发生 PTLD 的风险亦具有相关性,年轻受者在术后第1年发生PTLD的风险较高,而年龄增长是晚期PTLD的危险因素[16]。但在囊性纤维化(cystic fibrosis, CF)肺移植的人群中,年龄增长对PTLD的发生却有保护作用[17]。
1.3 免疫抑制水平
在免疫抑制状态下,T细胞功能受到抑制,导致T细胞缺乏对B细胞增殖的抑制。这可能导致EBV转化的B细胞不受控制地增殖。因此,免疫抑制治疗可能显著增加PTLD的发生风险[14]。由于肺移植较其他器官移植术后所需免疫抑制程度更高,免疫抑制剂的血药浓度需维持在较高水平,因此PTLD发生率更高。有研究表示,他克莫司和环孢素的使用也是发生PTLD的独立危险因素[18]。
1.4 限制性肺疾病
已有多项单中心研究表明,CF肺移植受者PTLD的发生率增加[19]。CF肺移植受者发生PTLD可能的危险因素包括术前EBV和HHV-1、2、3、6、8血清学阴性,以及肺移植术后3个月内发生急性排斥反应。
1.5 人类白细胞抗原错配
供、受者人类白细胞抗原(human leukocyte antigen,HLA)的错配会影响 PTLD 的发生。有研究观察发现,供者HLA-A1、A24、A26、B40位点错配导致PTLD发生风险增加,而HLA-B8、DR3、DR11位点错配可使风险降低[16,20]。
2 PTLD 的病理分型
2016年世界卫生组织(World Health Organization,WHO)将PTLD分为6个亚型(表1),包括传染性单核细胞增多性、旺炽性滤泡增生性、浆细胞增生性、多形性、单形性和经典霍奇金淋巴瘤型PTLD[21]。其中,前3种类型为早期病变,单形性PTLD是最常见的亚型,占PTLD的60%~80%。根据淋巴瘤的诊断标准,80%以上的单形性PTLD为B细胞性恶性肿瘤,病理表现主要为弥漫性大B细胞淋巴瘤和Burkitt淋巴瘤[22]。T细胞性或自然杀伤(natural killer,NK)细胞性恶性肿瘤(外周T细胞淋巴瘤、γ/δ T细胞淋巴瘤、NK/T细胞淋巴瘤)和霍奇金淋巴瘤是单形性PTLD的罕见亚型。
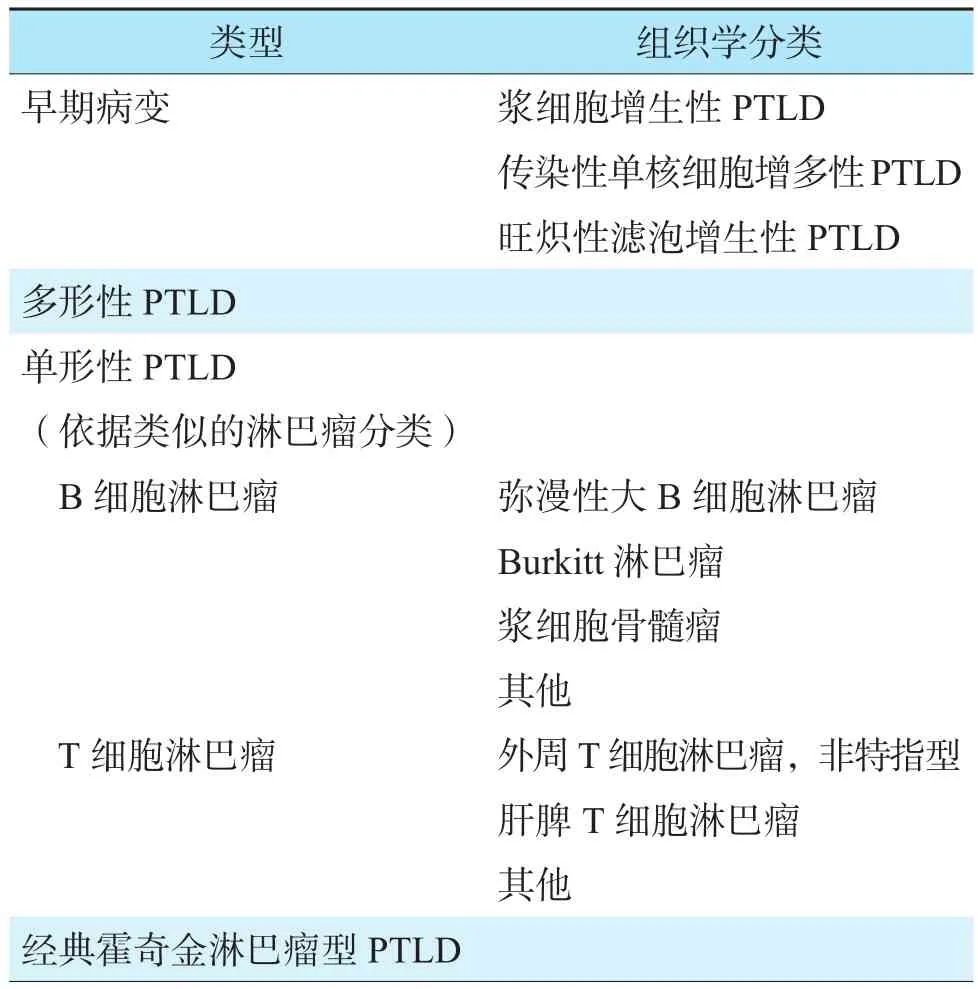
表1 2016年WHO的PTLD组织学分类[21]Table 1 WHO histological classification of PTLD in 2016
3 PTLD 的临床表现
PTLD的临床表现可能取决于从移植到诊断PTLD的时间,在术后1年内多出现在肺内,表现为移植肺失功、纵隔淋巴结肿大、胸腔积液[23]。术后1年后,肺外表现中胃肠道是PTLD最常见的受累部位,发生率为4%~15%[23-24]。据研究报道其他部位还包括颈部淋巴结、中枢神经系统(包括硬膜外肿物伴脊髓压迫)和副鼻窦。
PTLD的临床症状与淋巴增殖的全身反应有关,可能包括淋巴结肿大、压痛、发热、出汗、疲劳、鼻窦疼痛、咳嗽、头痛、腹痛和神经功能受损等[25]。PTLD患者体格检查可发现淋巴结或结节肿大、扁桃体肿大、肝脾肿大、肠梗阻和神经功能受损等。
4 PTLD的诊断方法
4.1 组织病理学检查
病理活组织检查(活检)不仅是诊断 PTLD的“金标准”,也是确定肿瘤形态和细胞遗传学的必要手段,同时也是制定治疗方案的主要依据,并能提示预后。但活检属有创检查,有出血、感染等风险,患者接受度差,不宜反复检查,可能会延误诊断。
4.2 影像学检查
为了明确 PTLD 的 Ann Arbor 分期[26],影像学检查是必不可少的。CT作为最为常用的检查,不仅可以作为初始的评估,也可用来确定穿刺活检部位,还可以用来评估疗效。MRI用于诊断累及脊髓及中枢神经系统的 PTLD 具有一定优势。18F-氟代脱氧葡萄糖(18F- fluorodeoxyglucose,18F-FDG)正电子发射计算机体层显像仪(positron emission tomography and computed tomography, PET/CT)检查作为一种非侵入性检查方法是必要的,多项研究回顾性分析了因临床怀疑PTLD而接受18F-FDG PET/CT检查的患者,其诊断的灵敏度、特异度、阳性预测值和阴性预测值都可达85%以上[27]。虽然18F-FDG PET/CT检查对于PTLD的初步诊断有一定的临床应用价值,但不同研究之间灵敏度不一致,表明还需要进一步的前瞻性研究,仍不建议仅凭影像学检查就做出明确诊断。
4.3 EBV DNA监测
EBV DNA 的监测目前用于高危异基因造血干细胞移植受者,以早期诊断EBV阳性PTLD,不主张用于实体器官移植术后 PTLD 的诊断。但是对于PTLD的高危患者,定期监测EBV DNA,有利于尽早发现PTLD[28]。分子基因学研究表明,EBV阴性PTLD的发病机制与EBV阴性淋巴瘤相似,其治疗方法与EBV阳性PTLD有所不同[29],因此肺移植术后EBV DNA的监测有助于PTLD治疗方案的制定。
5 PTLD 的治疗
5.1 降低免疫抑制水平
降低免疫抑制水平一直以来是治疗 PTLD的主要方式。对于早期病变和多形性PTLD,仅降低免疫抑制水平即可以获得完全缓解,而对于单形性PTLD则需要联合其它治疗方案。
美国器官移植外科医师学会(American Society of Transplant Surgeons,ASTS)指南建议:(1)对于局限性PTLD,减少25%免疫抑制剂用量;(2)对于进展性PTLD且患者一般情况较好,钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)减量50%,停止抗代谢药物,维持糖皮质激素7.5~10.0 mg/d;(3)对于进展性PTLD且患者一般情况差,仅维持糖皮质激素7.5~10.0 mg/d。2019年,我国器官移植PTLD临床诊疗规范指出,治疗反应通常在减少免疫抑制治疗后2~4周内出现,观察等待时间一般不超过4周,如受者未获得完全缓解,应进行下一步治疗。对于不能减少免疫抑制剂剂量或进展迅速的病例,应即刻施行其他治疗[30]。
除了免疫抑制剂剂量调节外,可将传统免疫抑制如CNI转换为西罗莫司[哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂],以降低免疫抑制水平。Ferreira等[31]报道了4例肾移植术后 PTLD 患者调整免疫抑制方案为西罗莫司后,病情缓解,且没有发生移植肾衰竭。在临床实践中,如果 PTLD 患者出现移植物衰竭或移植物抗宿主病(graft- versus-host disease,GVHD)而需要保持一定的免疫抑制强度,则应考虑这种降低免疫抑制水平的方法。
然而,免疫抑制水平的下降可能会引发CLAD,是肺移植受者术后晚期死亡的主要原因[32]。研究表明,CLAD(主要是闭塞性细支气管炎综合征)主要发生在早发性PTLD之后,同时也提示肺移植术后较短时间内免疫抑制水平的降低可能是CLAD发生的罪魁祸首。因此,单独降低免疫抑制水平时需密切监测患者PTLD相关病情及肺功能情况。
5.2 利妥昔单抗治疗
利妥昔单抗是PTLD最常见的治疗药物,是一种针对CD20的单克隆抗体,而CD20在B 细胞表面广泛表达。2020年美国国家综合癌症网络针对B细胞PTLD的指南中指出:(1)对于非破坏性PTLD,建议降低免疫抑制水平;(2)对于全身性多形性PTLD和单形性PTLD,建议降低免疫抑制水平联合使用利妥昔单抗或利妥昔单抗联合细胞毒性方案;(3)对于局限性多形性PTLD,建议降低免疫抑制水平联合利妥昔单抗治疗,或联合放射治疗/手术加或不加利妥昔单抗治疗[33]。González-Barca等[34]进行了一项单独使用利妥昔单抗的Ⅱ期研究,包括41例实体器官移植术后发生PTLD的B细胞CD20阳性的患者。在降低免疫抑制水平的同时,患者每周接受利妥昔单抗治疗4周(第1个疗程),未达到完全缓解(complete remission,CR)的患者再次接受类似治疗(第2个疗程)。第1个疗程后总缓解(overall response,OR)率和CR率分别为79%和34%,第2个疗程后CR率上升到61%。长期随访数据表明,获得CR对于PTLD患者术后长期存活是有显著意义的(5年生存率为94%,10年生存率为88%)。最近Jain 等[35]的一项研究表明,PTLD应用利妥昔单抗治疗无效是预后不良的重要因素。
5.3 T 细胞免疫治疗
T细胞免疫治疗是PTLD的有效治疗方法,它通常应用于利妥昔单抗治疗失败的多形性或单形性PTLD。细胞毒T淋巴细胞的功能障碍是EBV相关淋巴细胞疾病的主要原因,激活细胞毒T淋巴细胞可有效攻击EBV感染细胞。目前,临床上已经开发出具有较低同种异体反应性的供体来源EBV特异性细胞毒T淋巴细胞[36]。Kazi等[37]报道了20例实体器官移植术后发生PTLD的患者,输注EBV特异性细胞毒T淋巴细胞,OR率为75%。但应用细胞毒T淋巴细胞仍有GVHD的风险,在应用上还需进一步大样本的临床研究。
5.4 其 他
抗病毒药物(如缬更昔洛韦和阿昔洛韦)已被用于预防和治疗EBV相关的PTLD。与未经抗病毒治疗的患者相比,在接受抗淋巴细胞治疗期间以及之后3个月内接受抗病毒治疗的患者发生PTLD的风险降低[38]。手术在PTLD患者的治疗中起着次要的作用,但对于孤立病变的切除活检是一线综合治疗的一部分[28]。放射治疗对于全身治疗失败和(或)需要局部巩固的患者具有一定意义[39]。免疫调节剂、蛋白酶体抑制剂、磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)和蛋白激酶B(protein kinase B,Akt)抑制剂、新型抗CD20单克隆抗体和免疫检查点抑制剂等,对 PTLD具有一定的治疗潜力[11]。
6 PTLD 的预后
Leyssens等[14]通过病例对照研究得出,PTLD与肺移植受者术后长期生存率降低相关,大多数PTLD患者,尤其是晚发性PTLD患者,在PTLD确诊后6个月内死亡。据文献报道,PTLD患者的5年生存率为 8.0%~12.5%[40]。
根据病理分型不同,PTLD患者的预后也有差异。LaCasce等[22]分析了94项研究中306例PTLD患者的总生存期,其中,单形性T细胞PTLD中位生存期为9个月。不同亚型PTLD的2年生存率分别为:单形性T细胞PTLD为35%,多形性PTLD为70%,单形性B细胞PTLD为61%,霍奇金样PTLD为77%,结果表明,单形性T细胞PTLD患者的生存期比多形性、单形性B细胞性或霍奇金样PTLD患者差。
Luskin等[13]分析了1990年至2013年118例EBV阳性PTLD患者和58例EBV阴性PTLD患者的临床数据,结果显示两组患者对初始治疗的有效率和生存率(2年生存率均为60%)差异无统计学意义。
我国文献报道的肺移植术后PTLD病例数较少,缺乏预后的相关数据。
7 PTLD 的预防
在进行肺移植术前评估时,进行适当的血清学检测,识别出存在原发性EBV或CMV感染的受者。美国移植学会建议对EBV阴性的受者进行为期1年的每月EBV DNA载量监测[41]。对于肺移植术后免疫抑制水平需要加强的患者,包括发生急、慢性排斥反应的患者,或接受了T淋巴细胞清除治疗的患者,也应该提高EBV DNA载量的检测频率[14]。到目前为止,还没有指南对EBV DNA载量需要干预的阈值、检测的样本(血液、肺泡灌洗液)以及肺移植术后监测EBV DNA的频率等做出明确指导。
肺移植术后早期,免疫抑制水平最强时,常规预防CMV感染可能会降低EBV血清转化率,从而降低术后早期PTLD的发生率。预防性应用更昔洛韦抗病毒与降低发生PTLD的风险相关性高达83%[38]。与单独使用更昔洛韦相比,联合应用静脉注射免疫球蛋白并未降低EBV DNA载量[42]。降低免疫抑制水平是治疗PTLD的主要方式,而在EBV DNA载量升高和怀疑PTLD的情况下是否要降低免疫抑制水平尚无统一意见,有关肺移植术后1年内发生PTLD并减少免疫抑制水平后的急性排斥反应和闭塞性细支气管炎综合征发生率的数据也十分有限。因此,EBV的早期检测和对PTLD的早期诊断至关重要。
8 小结及展望
PTLD作为肺移植术后可致死性并发症,其多样的临床表现和多样的病理改变,需引起肺移植科医师的重视。EBV的监测也同样重要,但当EBV阴性而患者出现非特异性的临床表现时也要警惕EBV阴性PTLD。对于PTLD要根据病理分型制定治疗方案,首选降低免疫抑制水平,可视CR情况联合其它治疗方法。我国对于肺移植术后PTLD的研究还很缺乏,仍需进一步的研究。
