生姜提取物对LPS 诱导RAW 264.7 细胞炎症反应的干预作用研究
2021-09-23郭孝萱宿冬雪
郭孝萱 宿冬雪,2
(1. 中国农业科学院农业质量标准与检测技术研究所, 农业农村部农产品质量安全重点实验室, 北京100081; 2. 国家知识产权局专利局专利审查协作天津中心, 天津 300304)
炎症是机体为了防止有害感染而产生的一种常见的特异性免疫反应。 过度和持续的炎症与一些慢性疾病的发病机制有关, 包括心血管和肠道疾病、糖尿病、 关节炎和癌症等[1~2], 因此, 寻找安全有效的控制炎症的方法成为备受关注的问题。 目前越来越多的研究发现, 植物来源的活性物质可以有助于控制炎症反应而很少具有副作用, 因此越来越多的食品企业开始关注于利用天然产物开发能够预防炎症和减少炎症相关并发症风险的功能食品。
生姜 (Zingiber officinaleRoscoe) 是一种广泛应用的药食两用植物, 具有较高的营养保健价值。国内外很多学者研究了生姜在动物和细胞水平上的抗炎活性, 证明生姜可以降低炎症相关基因表达,减少炎症因子分泌, 降低炎症相关疾病风险[3~4]。姜酚是生姜中的主要活性物质, 也是姜辣素的重要组分之一。 姜酚主要包括6-姜酚、 8-姜酚、 10-姜酚、 12-姜酚等。 研究表明, 姜酚具有抗炎、 抗氧化、 抗血小板凝集、 抗肿瘤、 保护胃黏膜等多种生物活性[5]。 姜酚类物质存在β-羟基酮基结构,受热不稳定容易脱去一分子的水形成相应的姜烯酚类物质, 6-姜烯酚抗炎活性比6-姜酚更好[6]。 研究显示, 经过高温处理的生姜提取物具有更高的抗氧化活性[7], 本研究推测高温处理的生姜提取物可能会由于姜烯酚的富集赋予其更高的抗炎活性。
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌的细胞壁组分, 会引起巨噬细胞激活并参与促炎细胞因子的产生、 炎症介质的释放以及诱导型一氧化氮合酶 (inducible nitric oxide synthase, iNOS)和环氧合酶 2 (cyclooxygenase-2, COX2) 表达增加[8]。 LPS 诱导小鼠巨噬细胞RAW264.7 炎症模型被广泛用于食源性活性物质的抗炎活性筛选与评价。 本研究利用该模型研究冷冻干燥、 60℃和90℃烘干生姜提取物的抗炎活性, 从基因和蛋白表达层面研究其抗炎机制, 进一步分析其中主要活性物质的差异, 希望通过本研究能够为生姜的抗炎应用提供基础, 为食源性活性物质在炎症的预防和干预方面提供依据。
一、 材料与方法
(一) 材料与试剂新鲜生姜购买于当地超市,产地为山东。 DMEM 高糖培养基和胎牛血清(FBS) 购自美国 Gibco 公司; LPS 购自美国 Sigma公司; RNA 提取试剂盒和反转录试剂盒购自美国NEB 公司; 实时荧光定量试剂盒购自美国Bio-Rad 公司; 引物由上海生工公司合成; ELISA 试剂盒购自北京华英技术研究所; NO 试剂盒购自南京建成生物工程研究所; 三吡啶三吖嗪 (TPTZ)、2, 2'-联氮-双-(3-乙基苯并噻唑啉-6 磺酸)(ABTS)、 Trolox、 DPPH 购自美 国 Sigma 公司;NC 膜购自美国 Bio-Rad 公司; BSA 购自美国VWR 公司; 一抗 (β-actin、 IκBα 和 p-P65) 和HRP 标记二抗购自美国CST 公司; ECL 试剂盒购自美国Thermo Fisher Scientific 公司; 质谱级甲醇和乙腈购自德国Merck 公司; 质谱级甲酸购自美国Sigma 公司。 其他试剂均为分析纯, 购自北京化工厂。
标准品: 6-姜酚(纯度 98.9%)、 8-姜酚(纯度99.5%)、 10-姜酚(纯度 97.5%)、 6-姜烯酚(纯度97.6%)、 8-姜烯酚 (纯度 98.3%)、 10-姜烯酚(纯度 98.1%)、 四氢姜黄素(纯度 99.7%)、 姜黄素(纯度98.9%) 均购自天津阿尔塔科技有限公司。
(二) 细胞小鼠单核巨噬细胞系RAW264.7购自中国科学院上海细胞研究所, 培养于DMEM高糖培养基[含10%胎牛血清 (FBS) 和100 U/mL青霉素、 100U/mL 链霉素]于 37℃、 5% CO2培养箱中培养, 每2 d 用刮刀将细胞传代。
(三) 方法
1.生姜提取物制备。 将新鲜生姜切成1~2 mm的姜末, 分别用3 种不同方式干燥:(1) 冷冻干燥;(2) 60℃烘箱干燥;(3) 90℃烘箱干燥。 将干燥后的生姜粉碎过 40 目筛, 以 1∶20 的料液比加入70%乙醇水溶液, 常温下超声提取30 min, 重复提取3 次, 所得滤液减压蒸馏去除乙醇, 冷冻干燥得到3 种生姜提取物。
2. Trolox 当量抗氧化能力 (TEAC)。 TEAC 实验参照 RE 等[9]的方法进行。 7 mmol/L ABTS 溶于100 mmol/L 磷酸缓冲液中 (pH 值为 7.4), 内含有2.45 mmol/L 过硫酸钾, 避光放置至少 12 h,ABTS·+用 PBS 稀释至 734nm 处有吸光值 0.7±0.05, 这样的 ABTS·+溶液 2 h 内用完。 样品用乙醇配成 10 mg/mL, 取 20 μL 样品加入 980 μL ABTS 反应液中, 室温下孵育6 min 后于734 nm 波长下测定吸光度, 乙醇替代样品作为空白吸光度, 计算ABTS 自由基清除率。 用 0~2 mg/mL Trolox 溶液作标准曲线, TEAC 值换算成mg Trlox/g 提取物。
3. 还原铁离子能力 (FRAP)。 FRAP 实验参照BADAMI 等[10]的方法进行。 FRAP 反应液包含 10 mmol/L TPTZ ( 溶 解 于 40 mmol/L HCl) 、 20 mmol/L FeCl3和 0.3 mol/L 醋酸盐缓冲液 (pH 值为3.6), 现用现配。 将提取物以 2 mg/mL 溶解于乙醇, 取 0.2 mL 样品加入 1.8 mL FRAP 反应液, 在37℃准确反应5 min 后于 595 nm 读数。 用 0~500 μmol/L FeSO4乙醇溶液作标准曲线, FRAP 值换算成μmol Fe2+/g 提取物。
4.DPPH 清除能力。 DPPH 实验参照金亮等[11]的方法进行。 将提取物以不同浓度溶解于甲醇,0.2 mmol/L DPPH 溶于甲醇作为反应液, 用甲醇作为空白。 取 20 μL 样品加入 180 μL DPPH 反应液,在室温下反应5 min 后于540 nm 下读数。 结果表示为样品清除DPPH 自由基的IC 50 值。
5.MTT 试验。 将对数期生长的 RAW264.7 细胞以每孔5×103个细胞接种于96 孔板中, 置培养箱培养24 h 以后, 弃去培养基, 除了空白组外,其他组加入含有不同质量浓度(50、100 μg/mL)提取物的培养液继续培养24 h 后, 弃去培养基, 每孔加入 20 μL MTT 试剂 (5 mg/mL 溶于 PBS), 于37℃培养 4 h, 之后弃去 MTT 试剂, 加入 150 μL/孔DMSO 溶解胞内形成的甲瓒, 用酶标仪在570 nm 处测定吸光值, 和对照组相比计算细胞存活率。
6.细胞处理。 将对数期生长的RAW264.7 细胞以每孔1×105个细胞接种于12 孔板中, 置培养箱培养24 h 以后, 弃去培养基, 分别给药物及LPS处理, 并换成无酚红DMEM 完全培养基。 实验分5 组, 即对照组、 LPS 刺激组 (加入 0.1 μg/mL LPS)、 FDG 组 (加入 0.1 μg/mL LPS 和 50 μg/mL冻干姜提取物)、 60G 组 (加入 0.1 μg/mL LPS 和50 μg/mL 60℃烘干姜提取物)、 90G 组 (加入 0.1 μg/mL LPS 和 50 μg/mL 90℃烘干姜提取物), 置培养箱中培养24 h。
7. 细胞上清 NO、 IL-6、 TNF-α 和 PGE2 的测定。 收集细胞上清液, 按照NO 试剂盒说明书用Griess 法测定上清 NO 含量, 于 540 nm 读取吸光值, 和标准曲线比对计算各组NO 水平。 对于上清IL-6、 TNF-α 和 PGE2 的测定, 按照 ELISA 试剂盒说明书进行操作, 于450 nm 下读取吸光值, 和标准曲线比对计算各组 IL-6、 TNF-α 和 PGE2 的含量。
8. 细胞内炎症相关mRNA 表达的测定。 弃去细胞上清液, 按照细胞RNA 提取试剂盒说明书提取细胞 RNA, 用 NanoDrop 测定 RNA 浓度, 取 1 μg RNA 按照反转录说明书进行反转录, 得到的cDNA 稀释 5 倍, 至于-20℃保存。 实时定量 PCR反应体系组成: PCR supermix 5 μL, 正向引物 0.5 μL, 反向引物 0.5 μL, cDNA 2.5 μL, ddH2O 1.5 μL, 混匀后按说明书的程序进行PCR 反应。 引物设计如表1 所示。 每次扩增以β-actin 为内标, 比较各组mRNA 表达。

表1 RT-PCR 扩增引物信息
9. Western blot 蛋白表达分析。 将 RAW264.7细胞接种于 6 孔板, 用生姜提取物 (50 μg/mL) 预处理 2 h, 然后加入 0.1 μg/mL 的 LPS 分别处理 10 min 和 30 min 检测 IκBα 和 p-P65 的表达。 利用含有蛋白磷酸酶抑制剂的RIPA 裂解液在冰上裂解细胞, 于 4℃以 10 000 g 离心 3 min。 用 BCA 试剂盒定量上清液蛋白浓度。 利用10%SDS-PAGE 以恒定电压 100 V 分离 40 μg 样品蛋白, 随后在 250 mA 的电流下湿法转膜 1.5 h。 膜在 5% BSA 中封闭后, 4℃过夜孵育相应一抗 p-P65、 IκBα 和 βactin (1∶2 000)。 将膜与 HRP 酶标二抗室温摇床孵育1 h, 然后在膜上加入ECL 底物, 利用Tanon 5200 自动化学发光成像系统检测发光信号强度,利用Image J 软件对条带发光强度进行分析。
10. 超高效液相色谱-串联质谱法 (HPLCMS) 测定提取物中主要活性成分。(1) 标准溶液配制: 分别称取5.0 mg 标准品用甲醇定容至5 mL,配置成质量浓度为1 000 mg/L 的标准储备液, 用甲醇梯度稀释标准储备液配制成0.10~200 μg/L 的混合标准工作溶液, 现用现配。 (2) 样品配制: 分别称取3 种生姜提取物20.0 mg 用甲醇定容至5 mL, 配制成质量浓度4 000 mg/L 的样品储备液,过0.2 μm 有机滤膜, 临用前用甲醇梯度稀释至0.1 mg/mL 和 0.01 mg/mL 作为样品分析溶液。 (3) 色谱条件: 色谱柱为ZORBAX RRHD Eclipse Plus C18柱 (100 mm×2.1 mm, 1.8 μm); 柱温 30℃; 流动相: A 为0.1%甲酸水溶液, B 为0.1%甲酸甲醇溶液; 流速为 0.4 mL/min。 梯度洗脱程序: 0~1 min, 5% B; 1.0~2.5 min, 5%~40% B; 2.5~4.5 min, 40%~85%B; 4.5~4.6 min, 85%~5%B; 4.6~5.5 min, 5%B。 进样量为 2.0 μL。(4) 质谱条件: 离子源为喷射流离子聚焦-电喷雾电离(Jet Stream ESI) 源; 离子模式为正离子模式; 扫描方式为多反应监测 (MRM) 模式; 鞘气温度250℃, 流速为 11.0 L/min; 喷嘴电压为 500 V; 毛细管电压为4 000 V; 雾化气压力为0.31 MPa; 干燥气温度300℃, 流速为5.0 L/min; 以上干燥气、雾化器、 碰撞气、 鞘气均为高纯氮气。
(四) 数据处理与分析实验结果用平均值±SD 表示。 组间比较通过Origin 8.0 软件进行单因素方差分析 (One-way ANOVA) 及 Tukey 检验。P<0.05 代表组间有显著差异,P<0.01 代表组间有极显著差异。
二、 结果与分析
(一) 生姜提取物抗氧化能力比较本研究采用TEAC、 FRAP 和DPPH 试验评价提取物的还原能力和清除自由基能力, 结果如图1 所示, 和冷冻干燥相比, 经过高温烘干的生姜提取物抗氧化能力有极显著升高 (P<0.01), 且随着烘干温度的升高, 抗氧化能力显著提高 (P<0.05)。 TEAC 反映了提取物清除ABTS 自由基的能力, 60G 的TEAC值达到 FDG 的 2 倍 (P<0.01), 90G 达到 FDG 的 3倍 (P< 0.01), 且 90G 和 60G 相比也有极显著提高(P< 0.01)。 相似的结果出现在清除 DPPH 自由基能力上, 60G 和 90G 的 IC50 值降低至 FDG 的一半以下 (P<0.01)。 FRAP 值反映提取物的还原能力,60G 的 FRAP 值达到 FDG 的 1.66 倍 (P< 0.01),90G 的FRAP 值与60G 相近, 但仍表现出显著升高的趋势 (P<0.05)。
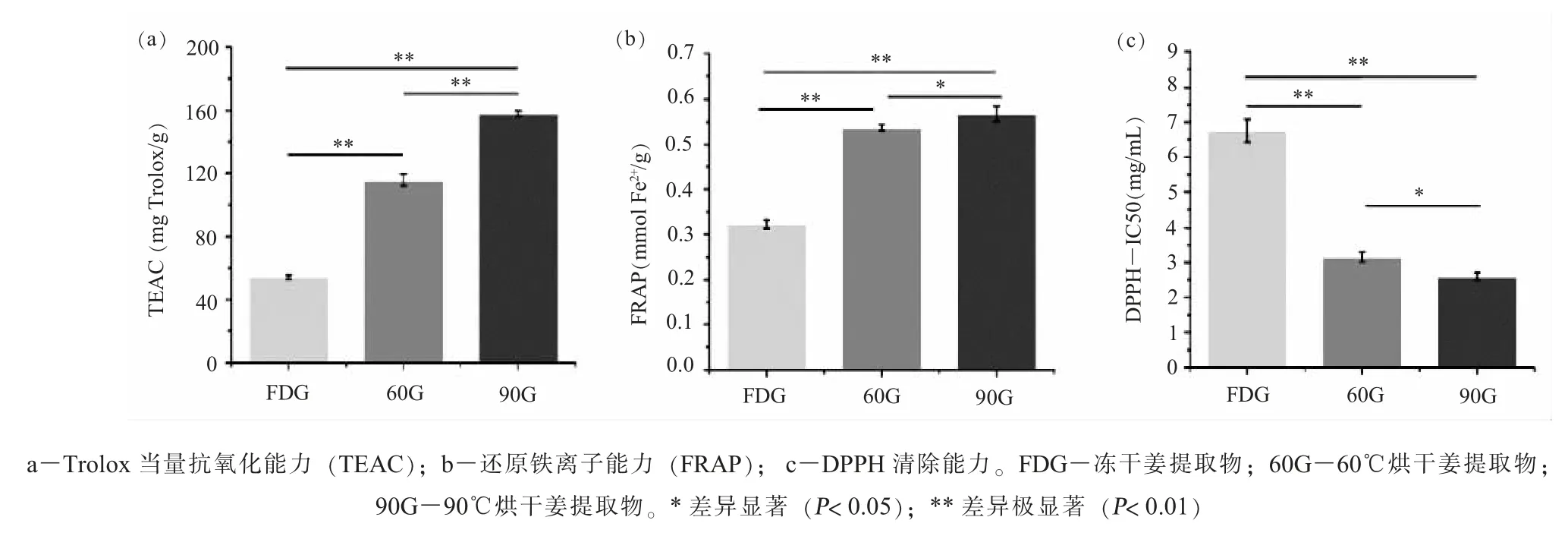
图1 3 种生姜提取物抗氧化能力比较
(二) 生姜提取物对RAW264.7 细胞增殖的影响3 种生姜提取物对细胞增殖的影响结果比较如图2 所示, RAW264.7 细胞经过生姜提取物作用24 h 后, 镜下观察细胞状态良好, 和对照组相比, 细胞活性无显著差异, 因此所选用的两个浓度50 μg/mL 和 100 μg/mL 对细胞无明显毒性, 在后续的研究中选择50 μg/mL 观察提取物的抗炎作用。
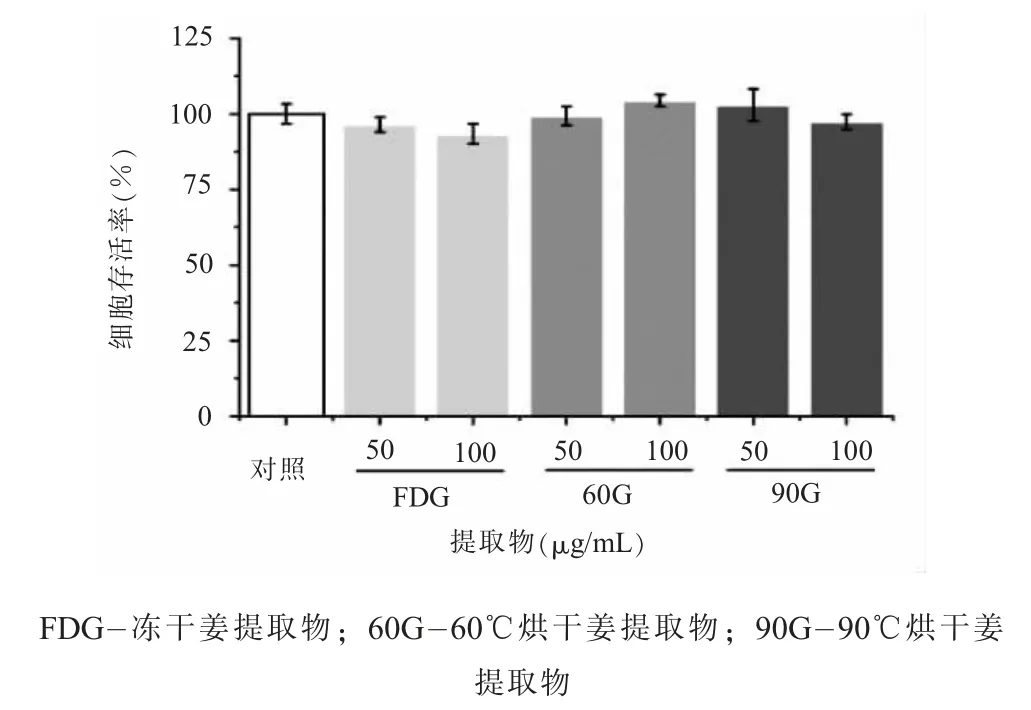
图2 3 种生姜提取物对细胞增殖的影响
(三) 生姜提取物对细胞 NO、 IL-6、 TNF-α和PGE2 分泌的影响NO 是重要的炎症介质,NO 的过量生成与炎症密切相关。 3 种生姜提取物对细胞上清 NO、 IL-6、 TNF-α 和 PGE2 的影响的测定结果如图 3 所示。 由图 3 (a) 可见, 0.1 μg/mL LPS 能激活RAW264.7 细胞产生大量NO,与对照组相比有极显著差异 (P<0.01)。 3 种提取物中, 只有高温烘干的60G 和90G 能够显著降低NO 水平 (P<0.01), 且 90G 比 60G 活性更强。 当巨噬细胞被激活会释放促炎因子如IL-6、 TNF-α和PGE2, 这些促炎因子会进一步激活细胞内炎症通路, 诱发细胞炎症反应。 如图2 (b)~(d) 所示,在 0.1 μg/mL LPS 刺激下, RAW264.7 产生大量IL-6、 TNF-α 和 PGE2, 与空白对照组相比有极显著差异 (P< 0.01), 其中 LPS 组 IL-6 达到对照组的 7 倍, TNF-α 和 PGE2 达到对照组的 2 倍,说明细胞出现炎症反应。 3 种提取物都可以显著降低细胞 IL-6 分泌 (P< 0.05), 60G 和 90G 效果优于FDG, 且随着温度升高抗炎活性越强。 对于TNF-α, 只有 90G 表现出显著抑制的效果 (P<0.05), 然而数值上来看 60G 效果优于 FDG。 在PGE-2 方面, 60G 和 90G 可以极显著抑制 PGE-2水平的升高, 而FDG 并没有表现出抑制作用。
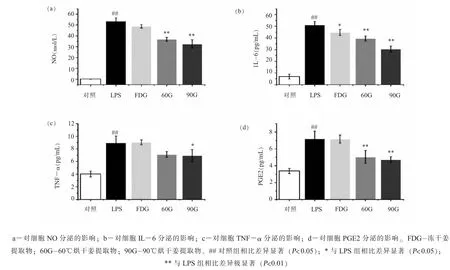
图3 3 种生姜提取物对细胞上清 NO、 IL-6、 TNF-α 和 PGE2 的影响
(四) 生姜提取物对RAW264.7 细胞炎症基因mRNA 表达的影响本研究进一步探究了提取物对炎症基因表达的影响, 如图4 所示, 在活化的巨噬细胞中, iNOS 对NO 的产生发挥主要作用。 在LPS 刺激下, RAW264.7 细胞中 iNOS 表达水平急剧升高, 和图 3(a)中 NO 水平相对应, 3 种提取物均可以极显著降低 iNOS 表达 (P<0.01), 其中FDG 和LPS 刺激组相比可以降低约38.6%, 60G和90G 效果优于FDG, 可以降低约64%的iNOS表达。 和图 3 中 IL-6 和 TNF-α 水平相对应,LPS 处理可以极显著升高 IL-6 和TNF-α mRNA表达 (P<0.01), 60G 和 90G 显著降低 IL-6 (P<0.05) 和 TNF-α (P<0.01) 表达, 而 FDG 并没有显著作用。 COX2 在细胞受到炎症刺激时大量表达, 可以快速应答一系列促炎介质和细胞因子, 分泌 PGE2 发挥促炎作用。 在 LPS 刺激下, RAW 264.7 细胞大量表达COX2, 达到对照组的 233 倍(P< 0.01), 在 3 种提取物中, 只有 60G 和 90G 可以显著抑制 COX2 表达 (P<0.01), 和 LPS 刺激组相比抑制率达到 50%以上 (P<0.01), 这个趋势和图3 中PGE2 分泌量相符。 此外, 本研究还检测了促炎因子 IL-1β 和 MCP-1 的 mRNA 表达, 同样地, LPS 诱导 RAW264.7 细胞大量表达 IL-1β 和MCP-1 (P<0.01), 60G 和 90G 只可以极显著抑制IL-1β 表达 (P<0.01), 且随着烘干温度升高, 提取物抑制效果更明显。 虽然3 种提取物都没有显著抑制 MCP-1 表达, 然而 60G 和 90G 表现出一定降低趋势。 这些结果表明, 不同方式干燥的生姜提取物可以通过调节炎症相关基因表达干预细胞炎症反应, 高温烘干利于抗炎活性的提升, 且随着烘干温度的升高, 抗炎活性有进一步升高的趋势。
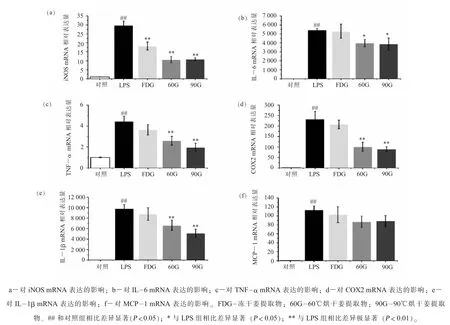
图4 3 种生姜提取物对细胞炎症基因mRNA 表达的影响
(五) 生姜提取物对 RAW264.7 细胞 NFκB 通路蛋白表达的影响NFκB 通路是炎症信号通路的核心。 本研究进一步利用western blot 研究了生姜提取物对 NFκB P65 亚基磷酸化和其抑制蛋白IκBα 表达的影响。 如图 5a 所示, LPS 处理后, IκBα明显降解 (P<0.01), 生姜提取物可以显著抑制IκBα 的降解 (P<0.05 或P<0.01), 其中 90G 最有效, 其次是 60G 和 FDG。 IκBα 的降解引起 NFκB的激活,LPS 组p-P65 表达水平显著升高(见图5b,P<0.01), 而 60G 和 90G 可显著抑制 p65 蛋白磷酸化 (P<0.01), 甚至达到对照组水平。 这些结果说明生姜提取物通过阻断NFκB 通路发挥抗炎作用。
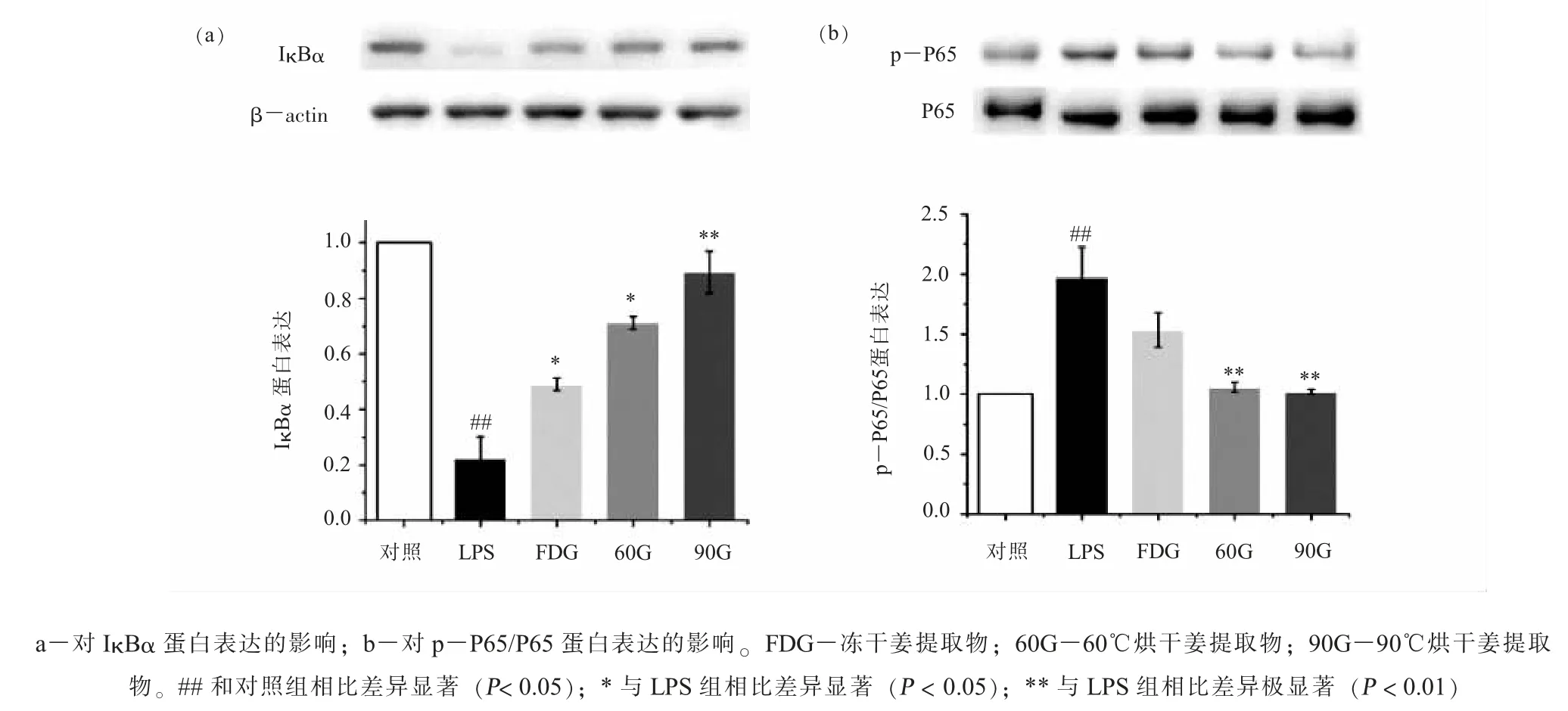
图5 3 种生姜提取物对细胞NFκB 通路蛋白表达的影响
(六) 生姜提取物中主要活性成分鉴定用HPLC-MS 鉴定生姜提取物中主要活性物质, 结果如表2 所示, 60G 和 90G 中8 种标准物质都有检出, FDG 中除了10-姜烯酚, 其他组分也都有检出。 提取物中6-姜酚含量最高, 其含量为10.79~11.15 g/kg, 其次是 10-姜酚和 8-姜酚。 60℃和90℃烘干可以促进姜酚向姜烯酚的转化, 且随着温度的升高, 转化率越高。 6-姜烯酚是姜烯酚中的主要成分, 60G 和90G 的6-姜烯酚含量分别达到F DG 的 2.4 倍 5.7 倍。 60G 和 90G 的 8-姜烯酚含量分别达到 FDG 的 4 倍和 10 倍。 虽然 10-姜烯酚在FDG 中含量过低未检出, 然而其在60G 和90G 中分别达到了32.99 mg/kg 和126.04 mg/kg。 因此提取物中姜烯酚的富集赋予了提取物更好的抗炎活性。
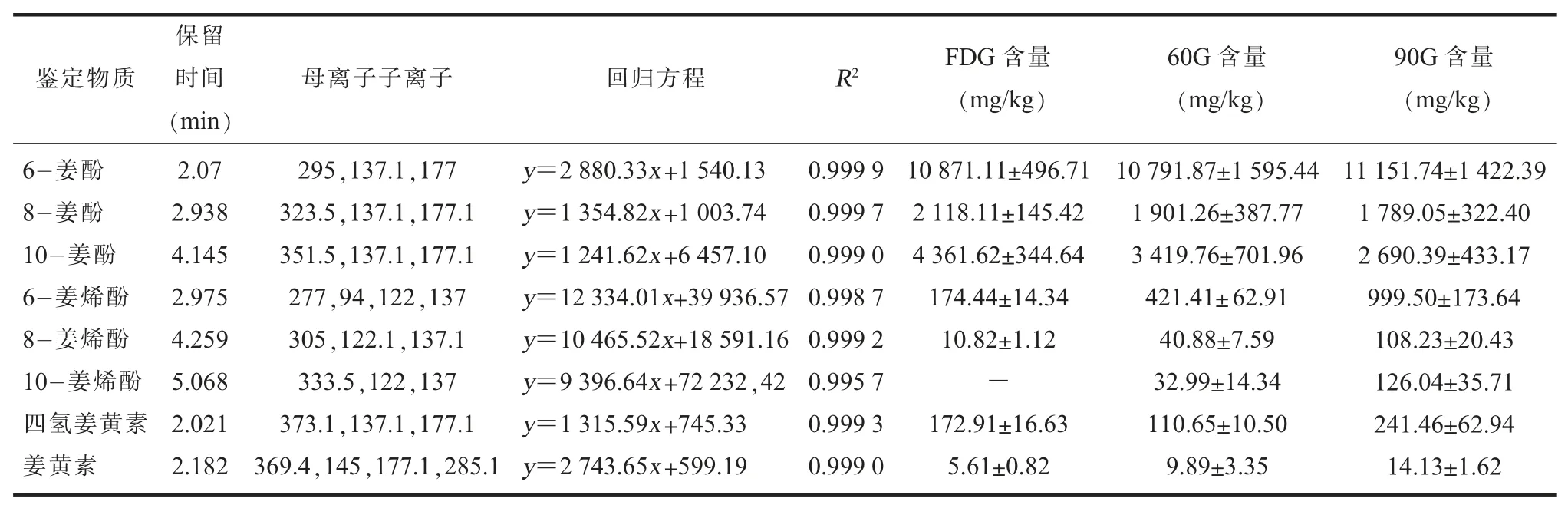
表2 HPLC-MS 鉴定生姜提取物中主要活性物质
三、 讨论
活性氧自由基 (reactive oxygen species, ROS)是炎症反应的重要介质, 在炎症相关疾病的发生、发展中发挥非常重要的作用[12]。 研究发现, LPS 刺激RAW264.7 细胞诱导胞内ROS 生成增加, ROS可以作为上游信号分子介导相关信号通路和转录因子的激活, 诱发炎症的发生[13]。 本文探讨了不同提取物的体外还原能力和清除氧自由基能力, 发现生姜提取物具有抗氧化活性, 且经过高温烘干的提取物比冷冻干燥的提取物活性更强, 可能和其中姜烯酚有关。 近年来大量研究报道了6-姜烯酚的抗氧化活性, 它可以通过上调Nrf2 介导的谷氨酰半胱氨酸合成酶和血红素氧化酶的表达来改善H2O2引起的HepG2 细胞氧化应激[14]; 还可以通过调控氧化应激和NFκB 通路改善糖尿病肾病和心肌病[15]。另外BAK 等[7]报道富含姜烯酚的提取物可以增强HepG2 细胞中抗氧化体系并改善二乙基亚硝胺诱导小鼠氧化应激。 生姜提取物的抗氧化作用可能是其抗炎活性的潜在机制, 对于生姜提取物如何调控LPS 诱导RAW264.7 细胞内ROS 产生及下游信号通路的活化尚不清楚, 需要进一步研究。
NO 是细胞间信息传递的重要调节因子, 有介导细胞免疫和炎症毒性的功能。 NO 的过量生成与炎症密切相关[16]。 在 LPS 诱导活化的 RAW264.7细胞中, iNOS 表达增加, 直接催化NO 持续生成,进而促使细胞分泌炎症标志因子TNF-α, TNF-α是全身炎性反应的始动介质, 可诱导IL-1 和IL-6 表达释放, 使炎性损伤的级联效应放大, 从而进一步加剧炎症反应[17~18]。 因此, 调节 NO 合成或iNOS 表达可能是治疗炎症的重要靶点。 另外,COX2 是一种诱导型合酶, 是启动炎症反应的关键酶, 由其合成的PGE2 可介导炎症反应。 本研究证明, iNOS 和COX2 是生姜提取物的抗炎作用靶点, 其可以通过降低 iNOS 和 COX2 的 mRNA 表达抑制LPS 诱导的炎症细胞NO 和PGE2 释放增加, 进一步下调 TNF-α 和 IL-6 等炎症因子的表达, 减少炎症因子的释放, 发挥抗炎功效。 生姜提取物的抗炎功效和其中的活性成分密切相关。 TRIPATHI 等[19]分离 LPS 刺激 C57B1 小鼠的腹膜巨噬细胞进行培养, 发现6-姜酚可以明显抑制促炎细胞 因 子 TNF -α、 IL -12 和 IL -1β 的 分 泌 。DUGASANI 等[6]发现, 6、 8、 10-姜酚可以通过抑制炎症介质NO 和PGE2 的释放来发挥抗炎活性,且6-姜烯酚抗炎活性比姜酚更好。 6-姜烯酚可以通过抑制ERK1/2 和PI3K/Akt 通路来抑制 LPS 诱导的小鼠巨噬细胞炎症反应[8]。 因此高温烘干可以通过富集姜烯酚进而使之抗炎活性得到提升。
NFκB 通路是调节炎症反应的经典信号通路。当细胞受到 LPS 刺激后, NFκB 信号通路激活, 易位进入细胞核内, 调控NO 的生成和细胞因子TNF-α、 IL-6 等的表达和释放[20]。 本研究证明,生姜提取物可以通过抑制NFκB 通路发挥抗炎活性, 其主要活性成分6-姜酚和6-姜烯酚也被报道可 以 抑 制 NFκB 信 号 通 路 的 激 活[19,21]。 另 外 ,MAPK 通路在介导炎症反应和细胞因子生成中起着重要的作用。 LPS 能够激活 MAPK 家族成员ERK、 JNK 和 p38, 影响多种转录因子的活性, 从而调节炎症因子基因表达, 相反, 多种炎症介质也能激活MAPK, 调控其他炎症介质的生成[22]。 6-姜烯酚可以通过抑制MAPK ERK1/2, MAPK P38通路的激活调节炎症因子分泌进而抑制LPS 诱导的小鼠巨噬细胞炎症反应[8]。 因此推测MAPK 通路也是生姜提取物的抗炎作用靶点。 本研究首次证明了加工温度对生姜抗炎活性的影响, 可以为生姜的加工和应用提供科学依据。 以炎症相关信号通路为切入点明确生姜提取物的抗炎作用靶点, 是本研究需要继续探究的内容。
