外源硅对不同低温胁迫下番茄根系生长及生理特性的影响
2021-09-23郭树勋杨然胡晓辉李小靖赵海亮白龙强张毅
郭树勋,杨然,胡晓辉,李小靖,赵海亮,白龙强,张毅*
(1.山西农业大学 园艺学院,山西 太谷030801;2.西北农林科技大学 园艺学院,陕西 杨凌712100)
近年来,全球极端天气出现的频率、强度及持续时间不断提高。植物在生长期内易遭受多种非生物胁迫影响,其中低温是出现频次较多的胁迫因素之一。低温胁迫可导致植物光合能力下降,生长延缓,合成代谢受阻等[1]。张腾国等[2]研究发现,低温胁迫诱导油菜的过氧化氢(H2O2)和羟自由基含量显著提高。由于H2O2等活性氧具有很强的氧化还原能力,其过量积累会对植物细胞造成氧化损伤,甚至导致植株死亡。牛铁荃等[3]研究发现,低温环境下葡萄的丙二醛(MDA)含量显著提高。MDA的积累会毒害蛋白质,对植物产生不利影响,破坏植物的正常发育进程。因此,研究缓解低温胁迫的措施对农业生产具有重要的实际意义。
目前在农业生产中应用外源非激素类无机物质提高植物抗逆性已成为研究的热点。王华等[4]研究发现,外源硒能够通过提高光合能力和抗氧化酶活性促进白术幼苗生长。Saad等[5]研究发现,外源锌可提高水稻渗透调节物质含量来抵御盐胁迫。大量研究表明,硅(Si)在提高植物对逆境胁迫的抵御能力上具有重要作用[6],但关于外源Si缓解低温胁迫的研究相对较少。赵培培等[7]研究发现,低温胁迫下外源Si能够显著降低小麦种子的MDA含量。邓凯翔等[8]研究发现,低温胁迫下外源Si能够显著降低葡萄幼苗的活性氧积累,说明外源Si可以通过降低胞内活性氧积累水平,缓解过氧化胁迫,进而提高植物抗逆性。尽管Si是地壳中第二大丰富的元素,但土壤中可供植物直接吸收的有效硅占比仍然很低,因而外源Si在农业生产中有广阔的应用前景[9]。
番茄(Solanum lycopersicumL.)是茄科番茄属植物,也是世界广泛种植的果菜之一。番茄生长期易受环境温度影响,低温可造成番茄生长减缓或发育受阻。朱丽云等[10]研究发现,持续8 d的低温寡照致使番茄减产率达70%以上。此外,曹逼力等[11]研究表明,外源硅能够提高番茄幼苗的光合能力并降低蒸腾作用。目前低温胁迫下根施外源Si对番茄生理特性的影响并不十分清楚,这在一定程度上限制了硅的应用。因此,本试验以‘中杂九号’番茄品种为材料,利用人工气候培养箱模拟低温胁迫,并采用根施Si溶液的方法,通过测定番茄幼苗根系生物量、MDA、活性氧和可溶性蛋白含量及抗氧化酶活性等指标,分析外源Si对低温胁迫下番茄根系生长发育及抗氧化酶系统的影响,以期为农业生产中利用外源Si缓解或抵御低温胁迫提供一定的理论依据。
1 材料与方法
1.1 材料及处理
试验于2020年春季在山西农业大学园艺实验中心进行。供试番茄品种为‘中杂9号’,种子购自中国农业科学院蔬菜花卉研究所。选取籽粒饱满,大小一致的番茄种子,经55℃温汤杀菌15 min后,置于28℃恒温培养箱浸种6 h,在铺有双层滤纸的培养皿中催芽,期间保持湿润;48 h后将露白1 mm的种子播于72孔穴盘中,栽培基质购于沃德农业科技公司(有机质含量≥25%)。当幼苗长至四叶一心时,选取长势一致的幼苗移植于规格为12 cm×13 cm的营养钵中(1钵1苗),缓苗5 d后进行低温处理。Si溶液由分析纯Na2SiO3·9H2O配制,药品由天津市百世化工有限公司生产。试验共使用3个人工气候培养箱,参数设置分别为常温(CW:24℃/18℃)、亚低温(YDW:18℃/12℃)、低温(DW:12℃/6℃);人工气候培养箱以下参数设定一致,昼夜为12 h/12 h,相对湿度60%,光照强度30000 lx。低温处理前1 d进行预处理,每株根施6 mL蒸馏水或不同浓度的硅溶液;低温处理期间每隔1 d根施1次,硅溶液浓度和体积与预处理一致。每3 d浇灌一次1倍日本山崎番茄配方营养液补充养分,处理15 d时取样。如表1所示,本试验共设计9个处理,每处理重复20株番茄幼苗。
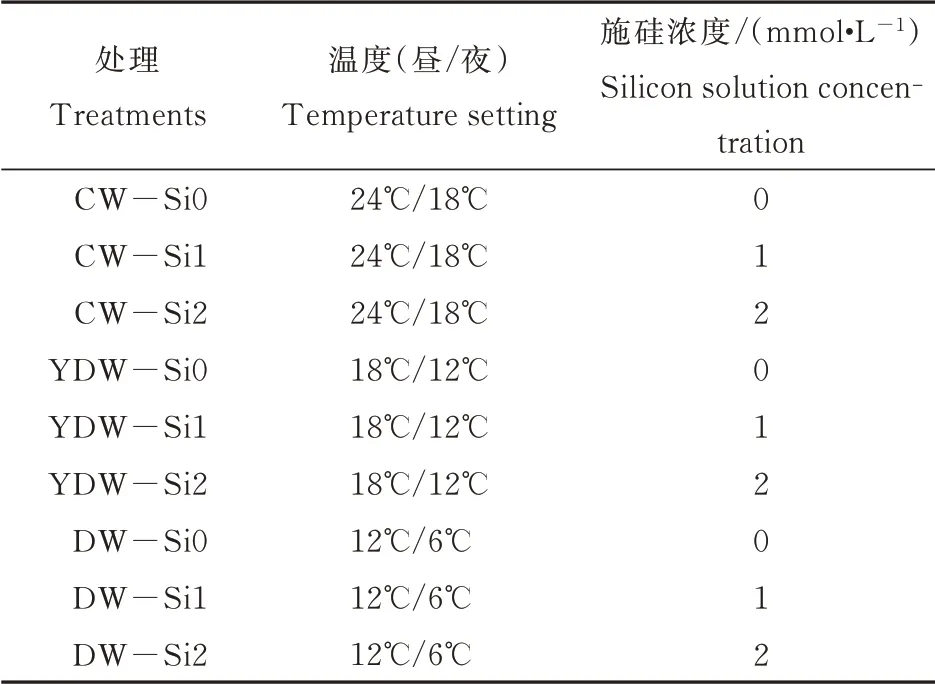
表1 不同处理的温度和施硅浓度设定Table 1 Temperature setting and Silicon solution concentration for different treatments
1.2 测定指标及方法
1.2.1 生长指标
每处理取4株番茄根系,称取根系鲜重;在烘箱中105℃杀青15 min,75℃将样品烘至恒重,称取根系干重。
1.2.2 生理指标
每处理取5株番茄根系,用蒸馏水洗净擦干后剪碎,置于-80℃超低温冰箱冻存。MDA含量采用2-硫代巴比妥酸法测定[12];超氧阴离子(O-·2)含量采用羟胺氧化法测定[13];H2O2含量测定参照Yin等[14]的方法。酶液提取 参照Gong等[15]的方法。取冻存样品0.3 g,加入3 mL预冷的磷酸钠缓冲液(PBS,0.05 mol·L-1,pH 7.8),研磨成匀浆,移入10 mL离心管中,4℃9661×g下离心20 min;上清液用于超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性的测定。其中SOD活性采用NBT光还原法[16],POD活性采用愈创木酚法[17],CAT活性采用紫外吸收法[18]。可溶性蛋白含量使用考马斯亮蓝G-250测定,参照Bradford的方法[19]。
1.3 数据分析方法
使用Excel 2016软件统计数据,所有数据采用3次以上重复试验的平均值和标准差;使用SPSS 24.0分析数据,数据处理间差异显著性检验采用Duncan’s法,以p<0.05为显著性检验水平。
2 结果与分析
2.1 外源硅对不同低温胁迫下番茄根系生长的影响
由表2可见,在根施蒸馏水处理中,低温处理后番茄幼苗根系鲜重和干重均显著下降,其中DW-Si0鲜重和干重比CW-Si0处理分别显著降低了78.78%和84.85%,说明低温胁迫抑制了番茄幼苗根系的生长。根施Si后,根系鲜重和干重均显著提高,其中DW-Si2处理的鲜重比DW-Si0处理显著提高了1.41倍,YDW-Si2处理的干重比YDW-Si0处理显著提高了1.52倍。说明根施外源Si能够显著提高番茄根系的生长能力。
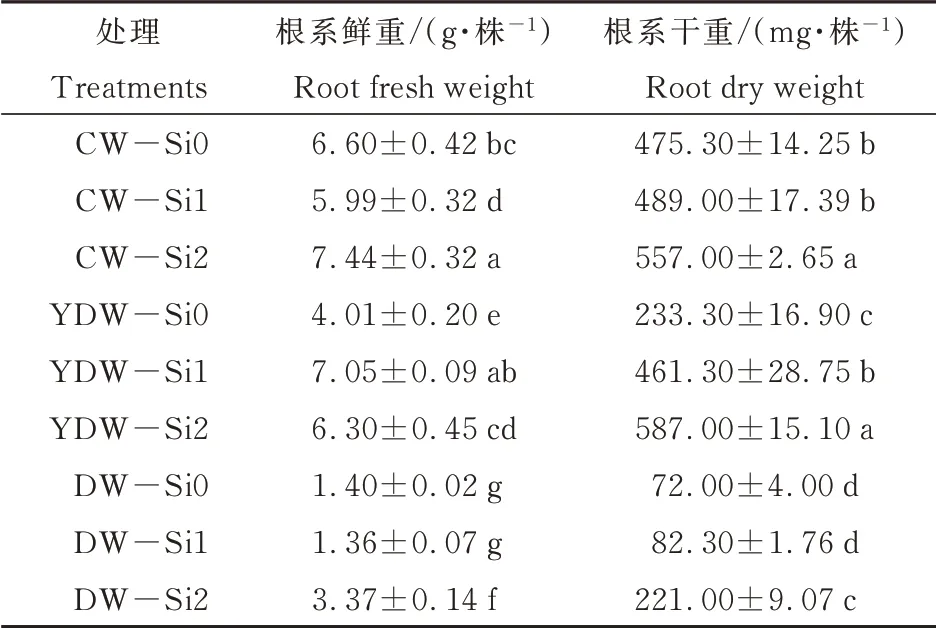
表2 外源硅对不同低温胁迫下番茄根系生长的影响Table 2 Effectof exogenoussilicon on rootgrowthof tomato seedlingsunder differentlow temperaturestress
2.2 外源硅对不同低温胁迫下番茄根系MDA、H 2O 2和的影响
由表3可见,在根施蒸馏水处理中,低温处理后番茄幼苗根系的MDA、H2O2和含量均随处理温度降低而显著升高。与CW-Si0相比,DWSi0的MDA、H2O2和含量分别显著提高了43%、82%和174%。根施Si后,根系中MDA、H2O2和含量均显著下降。其中CW-Si2的MDA、H2O2和含量与CW-Si0相比分别显著降低了25.85%、39.59%和33.90%;YDW-Si2与YDW-Si0相比分别显著降低了34.73%、21.18%和41.35%;DW-Si2与DW-Si0相比分别显著降低了33.81%、41.06%和60.03%,说明根施外源Si能够减少番茄根系的活性氧积累量,缓解氧化胁迫。
表3 外源硅对不同低温胁迫下番茄根系MDA、H 2O2和的影响Table 3 Effects of exogenous silicon on malondialdehyde,hydrogen peroxide and superoxide anion in tomato seedling roots under different low temperature stress

表3 外源硅对不同低温胁迫下番茄根系MDA、H 2O2和的影响Table 3 Effects of exogenous silicon on malondialdehyde,hydrogen peroxide and superoxide anion in tomato seedling roots under different low temperature stress
处理Treatments CW-Si0 CW-Si1 CW-Si2 YDW-Si0 YDW-Si1 YDW-Si2 DW-Si0 DW-Si1 DW-Si2丙二醛含量/(μg·g-1 FW)Malondialdehyde content 1.47±0.02 cd 1.21±0.00 f 1.09±0.07 g 1.67±0.09 b 1.33±0.09 e 1.09±0.08 g 2.10±0.07 a 1.57±0.06 bc 1.39±0.06 de过氧化氢含量/(μg·g-1 FW)Hydrogen peroxide content 28.14±0.47 d 22.23±0.59 f 17.00±0.05 h 25.69±0.20 e 22.29±0.39 f 20.25±0.48 g 51.18±0.90 a 35.90±0.62 b 30.16±0.51 c超氧阴离子含量/(μg·g-1 FW)Superoxide anion content 12.92±0.08 f 10.80±0.04 g 8.54±0.07 h 21.33±0.25 c 15.14±0.17 d 12.51±0.39 f 35.46±1.04 a 27.34±0.21 b 14.17±0.48 e
2.3 外源硅对不同低温胁迫下番茄根系可溶性蛋白含量的影响
由图2可见,在根施蒸馏水处理中,番茄幼苗根系的可溶性蛋白含量随处理温度降低而显著提高,其中DW-Si0处理比CW-Si0处理显著升高了66.55%,说明低温胁迫能够诱导可溶性蛋白积累。根施Si后,在常温条件下可溶性蛋白含量随施Si浓度的提高而显著降低,与CW-Si0相比,CW-Si2显著降低了18.81%;在亚低温条件下随施Si浓度的提高而显著提高;在低温条件下呈现出随施Si浓度先提高后降低的趋势。与CW-Si0相比,DW-Si1和DW-Si2分别显著提高89.93%和52.67%。
2.4 外源硅对低温胁迫下番茄根系抗氧化酶活性的影响
由表4可见,番茄根系经低温处理后SOD和POD活性随处理温度的降低而显著提高,CAT活性随处理温度的降低而显著降低。与CW-Si0相比,DW-Si0的SOD活性显著提高了29.12%,POD活性显著提高了55.12%,CAT活性显著降低了22.13%。施Si后,各处理SOD和CAT活性均有不同程度的降低,POD活性随施Si浓度的提高而显著提高。与CW-Si0相比,CW-Si2的SOD和CAT活性分别显著降低了21.65%和25.68%,POD活性提高了17.82%。与DW-Si0相比,DWSi2的SOD和CAT活性分别显著降低16.15%和24.99%,POD活性显著提高17.88%。

表4 外源硅对不同低温胁迫下番茄根系抗氧化酶活性的影响Table 4 Effects of exogenous silicon on antioxidant enzyme activities of tomato seedling roots under different low temperaturestress
2.5 相关性分析
由表5可见,番茄根系鲜重与活性氧及可溶性蛋白均具有显著或极显著负相关关系,说明根系活性氧含量的升高导致生物量降低。SOD活性与MDA、H2O2和含量均具有极显著正相关关系,说明根系活性氧积累会诱导SOD活性上升。
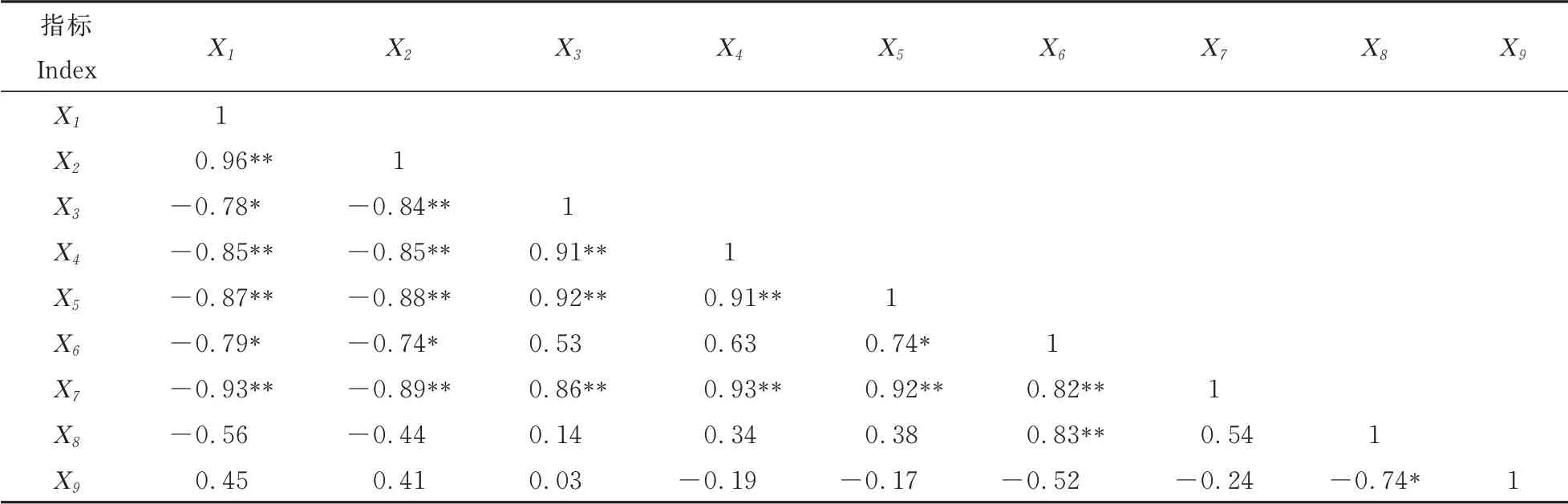
表5 各生理指标间的Pearson相关系数Table 5 Pearson correlation coefficient among various physiological indicators
2.6 主成分和综合得分分析
由表6可见,本试验原始数据经主成分分析后,共提取出9个主成分,其中前2个主成分解释了总方差的91.04%,说明提取的2个主成分能够代表原来9个生理指标的91.04%,所提取的主成分用于评价外源Si对不同低温胁迫下番茄根系生长及生理指标的影响已有一定把握。因此,提取2个主成分,分别为Y 1和Y 2,其中Y 1占主导地位,方差累积率为71.70%。
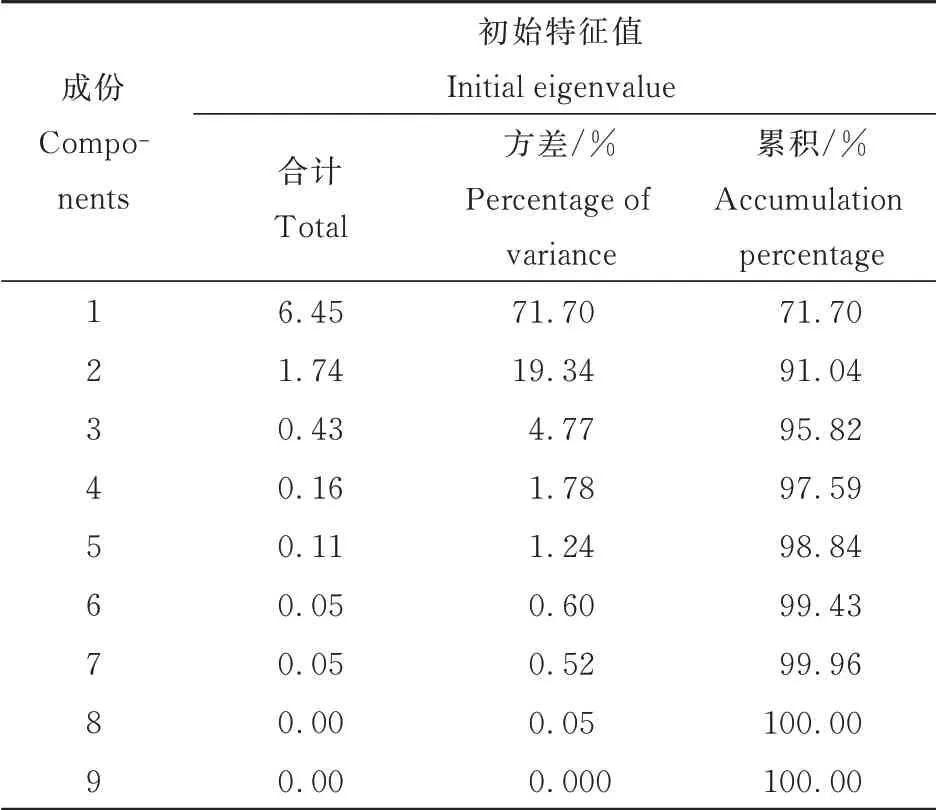
表6 主成分结果Table 6 Principal component results
根据2个主成分系数,可得到Y 1和Y 2的线性组合:

由上式可知,在主成分Y 1中SOD、根系干鲜重、H2O2和含量的系数绝对值大于其他生理指标的系数绝对值,则认为Y 1是番茄根系氧化胁迫的综合体现,能够代表根系氧化胁迫的严重程度。在主成分Y 2中MDA、POD和CAT活性的系数绝对值大于其他生理指标的系数绝对值,则认为Y 2是番茄根系抗氧化酶应激反应的综合体现。
由表7可见,各处理综合得分随处理温度的降低而提高,随施Si浓度的提高而降低,说明低温胁迫显著提高了番茄根系遭受的氧化胁迫,且根施外源Si能够显著缓解根系的氧化胁迫。其中CWSi2综合得分最低,代表其氧化胁迫程度最低;DW-Si0综合得分最高,说明其遭受的氧化胁迫最为严重。
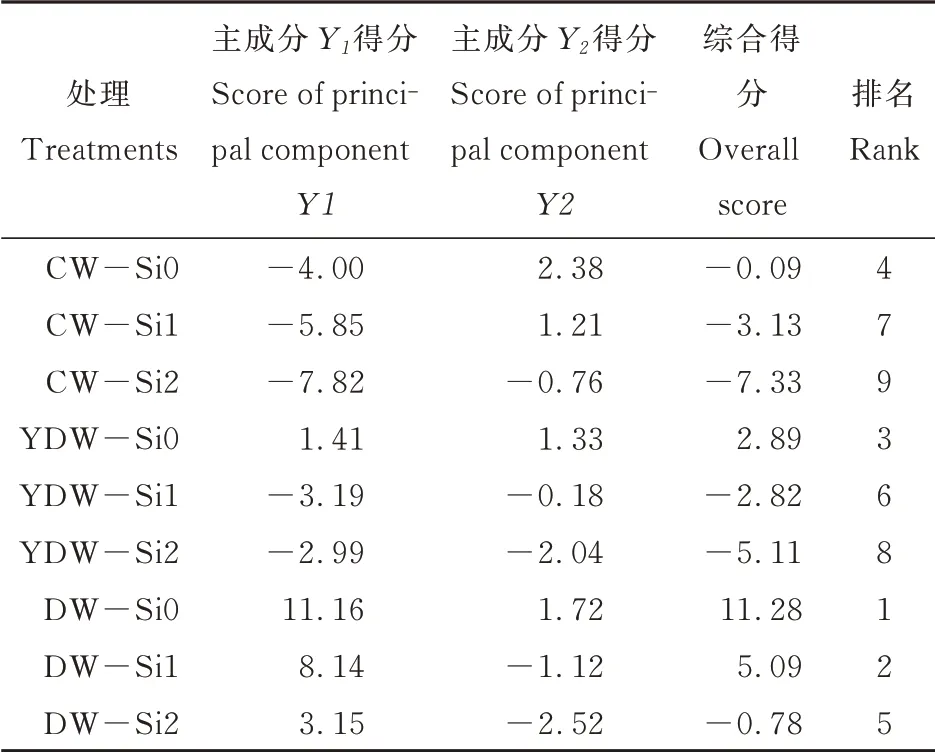
表7 主成分得分和综合得分Table 7 Principal component scores and comprehensivescores
3 讨论
番茄幼苗期对温度变化非常敏感,低温环境会严重抑制幼苗的正常生长。本试验中,常温处理组施Si后番茄幼苗根系生物量显著上升(表2),说明根施外源Si对根系生长具有促进作用,这与外源Si能够保护叶绿体膜完整性从而提高植株光合能力有关[20]。低温处理组中,番茄根系生物量随施Si浓度的提高而增加,其中YDW-Si2处理的鲜重与YDW-Si0处理相比提高了1.5倍,DW-Si2处理与DW-Si0处理鲜重相比提高了1.4倍(表2),说明根施外源Si能够有效缓解番茄根系由低温胁迫引起的生长抑制。YDW-Si2与CW-Si0处理的鲜重并无显著差异(表2),说明在亚低温条件(18℃/12℃)下根施2.00 mmol·L-1的外源Si能够恢复番茄幼苗的正常生长,生物量的提高是由于施Si能够提高植物细胞导度,进而提高CO2浓度及羧化作用速率,导致净CO2同化速率增加[21,22]。
生物膜是植物抵御非生物胁迫的第一道防线,低温胁迫对植物的侵害是从膜结构开始的[23]。低温胁迫诱导植物体内活性氧爆发的同时也会启动一系列生理机制来清除多余的活性氧,阻止氧化胁迫程度进一步加深,例如抗坏血酸(ASA)、谷胱甘肽(GSH)、类胡萝卜素等小分子活性物质组成的非酶促活性氧清除系统,以及SOD、POD和CAT等组成的酶促活性氧清除系统[24]。朱永兴等[25]研究发现,盐胁迫下H2O2和丙二醛含量显著升高,而施Si能够降低番茄中H2O2和丙二醛含量。本试验施蒸馏水处理中H2O2、和丙二醛含量均随处理温度的降低而提高(表3),说明低温胁迫诱导根系活性氧积累,引起膜质过氧化,进而积累丙二醛,丙二醛对植物蛋白具有毒害作用,导致生物膜系统稳定性下降,同时诱导SOD和POD活性显著提高(表4),缓解低温胁迫造成的氧化损伤。施Si后各处理MDA、H2O2和含量均随施硅浓度的提高而降低,其中DW-Si2处理的H2O2含量比DW-Si0降低了41.32%(表3),说明根施外源硅能够显著降低番茄根系活性氧积累量,降低过氧化胁迫程度,缓解MDA积累对生物膜的毒害。其中H2O2含量要高于(表3),这是由于番茄需要通过H2O2来传导低温刺激信号[26]。以上说明根施外源硅能够提高根系线粒体的电子利用率,减少活性氧产生速率,将番茄根系的过氧化程度维持在较低水平[27],这也是施Si后SOD和CAT活性均有不同程度下降的原因(表4)。
可溶性蛋白作为植物重要的渗透调节物质之一,因其吸水性强,能够降低细胞冰点,在缓解植物低温胁迫中具有重要作用[28]。郑凯翔等[8]试验结果表明,施Si能够提高葡萄的可溶性蛋白含量。本试验结果显示,常温处理组中施Si降低了根系可溶性蛋白含量(图1)。这是由于外源硅的沉积增加了细胞壁的强度和韧性,有助于植物细胞保持内外渗透压平衡,从而减弱诱导可溶性蛋白积累的信号强度,导致可溶性蛋白积累量减少[29,30]。低温处理下可溶性蛋白含量随施Si浓度显著上升(图1),说明施Si能够显著提高低温胁迫下番茄幼苗的可溶性蛋白积累水平。本试验将外源Si施于根系,沉积在根系的硅胶颗粒具有较大的吸附表面积,即硅和可溶性蛋白在保持细胞水分上具有协同作用。因此,施Si能够增强番茄细胞的亲水能力,增加番茄细胞的束缚水占比,提高根系对低温、亚低温环境的抗性[30]。
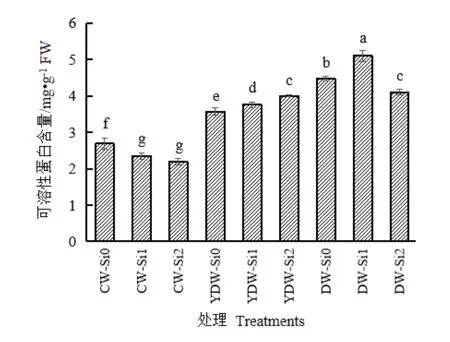
图1 外源硅对不同低温胁迫下番茄根系可溶性蛋白含量的影响Fig.1 Effect of exogenous silicon on soluble protein content in tomato seedling roots under different low temperature stress
4 结论
低温胁迫下番茄根系生长受到严重抑制,诱导活性氧爆发,氧化胁迫程度提高,导致细胞膜受损。外源Si可通过保持抗氧化酶系统稳定运行,缓解活性氧积累,降低膜脂过氧化,维持细胞膜的完整性,进而增强番茄对低温胁迫的抵御能力。由主成分综合得分可知,2 mmol·L-1Si溶液对低温胁迫引发的氧化胁迫缓解效果较好。
