68Ga-DOTATATE合成问题排查研究
2021-09-23孙占良吕太勇
赵 岩,孙占良,江 飞,吕太勇,刘 楠
1.西南医科大学附属医院核医学科(泸州 646000);2.四川省重点实验室核医学与分子影像(泸州 646000);3.四川省院士(专家)工作站(泸州 646000);4.西南医科大学药学院(泸州 646000)
核医学的推进与发展主要包括两个方面:一是诊断设备如正电子发射断层扫描仪(positron emission tomography,PET)和单光子发射计算机断层扫描仪(single photon emission computed tomography,SPECT)方面的进展[1],二是放射性药物方面的进展[2-14]。随着诊断设备的日渐成熟,放射性药物的研究已经成为推动核医学不断向前发展的主要动力。放射性药物从其放射性特点上可以分为两个研究方面:首先是放射性药物的标记合成研究[2-6],其次是放射性药物的核素生产研究[7-14]。
68Ga-DOTATATE的化学全称是68Ga-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-D-苯丙氨酸-1-酪氨酸-3-苏氨酸-8-奥曲肽,是一种在PET显像诊断中使用的放射性药物,主要应用于定位诊断表达生长抑素受体(somatostatin receptor,SSR)的神经内分泌肿瘤(neuroendocrine neoplasms,NENs)[15-19],联合MRI可以提高肿瘤性骨软化症诊断的特异性和准确性[20]。同时,在使用177Lu-DOTATATE 针对NENs 进行的肽受体放射性核素治疗(peptide receptor radionuclide therapies,PRRT)时,68Ga-DOTATATE 可以作为对应的显像剂在术前和术后为患者实行诊断和检查[21-23]。
因为其成像效果优于第一个被批准用于NENs显像的111In-喷曲肽(pentetreotide),该放射性药物已于2016 年6 月1 日被美国的食品药品监督管理局(Food and Drug Administration,FDA)批准用于NENs的诊断[19]。
68Ga-DOTATATE的合成生产过程相对18F-FDG更简单,68Ga物理半衰期为68 min,一般由锗镓发生器(68Ge/68Ga generator)生产[10-14],不需要加速器,标记反应可以使用全自动模块或半自动模块完成,也可以手动完成[24-26]。下面以使用ITG 半自动模块为例,介绍68Ga-DOTATATE注射液的生产过程:安装反应管线及产品瓶与废液瓶,预热模块与反应管,温度控制在80 ℃~100 ℃;将醋酸钠缓冲溶液和DOTATATE前体混合后推入反应管,使用超纯盐酸淋洗锗镓发生器,将68GaCl3淋洗液推入反应管,反应液最佳pH范围为3.5~4.5,加热反应10~15 min;将反应液通过C-18固相萃取柱送入废液瓶,用生理盐水再次清洗C-18 柱;使用乙醇和生理盐水淋洗C-18 固相萃取柱并经无菌滤膜过滤后送入产品瓶;测量废液和产品活度,取微量产品液检验pH并通过高效液相 色 谱(high-performance liquid chromatograph,HPLC)检测放射化学纯度(简称放化纯)[27-28]。
虽然68Ga-DOTATATE的标记方法已经成熟,但是因为国内医院开展相关业务的单位仍然较少,对于合成过程中问题排查的研究还未见报道,本报告将分享标记实验中问题的排查和解决,盼望帮助相关工作人员解决实际问题。
本院于2018 年开始开展68Ga-DOTATATE 的PET/CT 临床科研诊断显像[29-31],该放射性药物一直使用ITG 半自动模块进行标记合成,每天的药物标记由四位标记人员轮流完成,产品的放化纯正常在98%以上。在2020年4月份中下旬,不同人员标记中出现了3次产品放化纯低于98%,甚至低至90%,检查相应的废液,发现其活度高于正常水平,表明反应的标记率低于正常水平。
要查找原因,首先检查反应的标记率,使用ITG模块按照操作程序进行反应,不进行纯化,测得标记率仅为42%,远低于正常水平。造成标记率降低可能有如下几种原因:首先是反应环境的酸碱度,如果反应液pH不在正常范围内,标记率会明显下降,当pH出现异常,说明盐酸或者缓冲液的浓度有问题,可以进行相应的更换再次核验pH;其次是反应液中所含每一种物质的纯度,包括盐酸、缓冲液与前体溶液,对于标记反应金属杂质的浓度水平对反应的成败至关重要,需要核验这些物质是否被污染,对受污染的物质进行更换后,可以恢复标记率;最后是反应的物理仪器系统,像其它化学反应一样,放射性标记反应需要在特定的温度下进行,另外模块使用管线系统是否有残余或者漏夜,导致实际反应液中各种物质的比例改变,也会导致标记率降低。如果加热系统出现故障不能提供相应温度或者管线有问题,需要进行维修或更换以恢复标记率。本文将针对上面所列举的可能性展开排查实验,对问题进行溯源。
1 材料与方法
1.1 实验材料与仪器
盐酸(0.05 mol/L),使用超纯盐酸(Merck,Ultrapur,30%)和注射用水(四川美大康佳乐药业)稀释而成;醋酸钠溶液(0.25 mol/L),使用无水超纯醋酸钠(Merck,Suprapur,99.99%)和注射用水配制而成;其它浓度的缓冲溶液也是使用不同浓度超纯盐酸和醋酸钠配制而成;乙腈(赛孚瑞,HPLC/色谱纯);乙醇(Merck,Emprove);广范pH 试纸(pH 1~14,三爱思)、精密pH 试纸(pH 3.8~5.4,显色反应间隔0.5,麦克林);合成模块所用管线(ITG);C-18 固相萃取柱(Waters,Sep-Pak C18 Light);除菌滤膜(Merck,vented Millex-GS,0.22 μm);DOTATATE 前体(江苏华益)。
放射性核素活度计(Capintec,CRC-55tR);锗镓发生器(ITG);68Ga半自动合成模块(ITG);恒温混匀仪(宁波洛尚,Lawson,DHS-100);数字温度计(TP101,-50 ℃~300 ℃);放射性HPLC(Lab Alliance);pH计(雷磁,PHSJ-3F)。
1.2 质量控制
C-18反向色谱柱(Agilent,ZORBAX Eclipse C18 Plus,4.6 mm×250 mm,5 μm),放射性HPLC 流动相为:A泵,0.1%三氟乙酸乙腈溶液;B泵,0.1%三氟乙酸水溶液,洗脱梯度为:0~15 min,乙腈浓度10%~90%,流速为1 mL/min。
2 结果
2.1 pH核验
0.05mol/L 稀盐酸淋洗储备液储存于一个500 mL 的PP 瓶内,并定期分装入100 mL PP 中转瓶中。每次标记实验都是从中转瓶取盐酸,当中转瓶内盐酸使用完后,再从备用瓶取盐酸进入中转瓶。分别从中转瓶和备用瓶中取4 mL盐酸,各加入1 mL醋酸钠溶液与0.1 mL 水,模拟反应液的酸碱度,使用pH 计测量pH,平均值分别为3.6 和3.8。当用精密试纸测量时,显示其pH 都低于3.8,没有明显差别。通过此验证说明,反应液的pH 是处于最佳pH 范围3.5~4.5之内。
2.2 缓冲溶液
反应液的酸碱度是合格的,接下来检查了所使用的缓冲液,使用手动标记的方法,在独立的恒温混匀仪上,使用不同的缓冲液:①0.25 mol/L NaOAc 溶液300 μL,68Ga 淋洗液1200 μL,前体水溶液10 μg/45 μL;②NaOAc/HCl溶液(pH=4.4)300 μL,68Ga淋洗液1800 μL,前体水溶液10 μg/45 μL。测量标记率分别为98%和95%,从这里可以看到,使用不同的缓冲液的两个反应都是正常,甚至使用醋酸钠缓冲液的标记率更高。因为使用独立摇动的加热器增加了标记率,所以接下来对比了模块和独立加热器的加热效率差异,在这之前,需要验证前体的浓度是否充足。
2.3 前体浓度
在正常药物生产中,反应液的体积约为5 mL,包括4 mL68Ga 盐酸淋洗溶液、1 mL 醋酸钠溶液和0.1 mL 前体水溶液,投入的DOTATATE 前体质量为25 μg,前体在反应液中的浓度为5 μg/mL。由于锗镓发生器每次可提供的68Ga 盐酸淋洗溶液只有4 mL,所以采取降低反应体积来进行对比实验。
取三份常规体积1/10 的反应液,包括400 μL 0.05 mol/L68Ga盐酸淋洗溶液和100 μL 0.25 mol/L醋酸钠溶液,投入前体的质量分别设为1.25,2.5和5.0 μg,体积都是20 μL,这样前体在反应液中的浓度分别为2.5,5 和10 μg/mL。使用恒温混匀仪反应,测得标记率依次为99%,98%和98%。可以看出,当前体浓度降低到正常使用浓度的50%或者增加到两倍时,反应标记率都正常。
在标记合成中一直使用ITG 模块,到目前为止的实验结果表明,在模块上的标记率只有42%,而在恒温混匀仪上,标记率可以达到98%,需要进一步检查模块的加热器。
2.4 加热器
将模块和恒温混匀仪的温度控制设定为95 ℃,等待它们的温度达到设定的温度后,将带有液体的反应管放在不同加热器上,并分别记录在这些加热系统上所使用的不同反应管内液体随时间的温度变化曲线,见图1。在模块上反应管的溶液体积为5 mL,在恒温混匀仪上反应管的溶液体积为2 mL,从结果可以看出独立的加热器的温度上升比较快,两个反应管内的液体在10 min 左右达到平衡温度,它们的平衡温度接近,大约为80 ℃。在恒温混匀仪上的反应管温度上升较快,有两个可能的原因:首先,在恒温混匀仪上,只能放2 mL 的离心管,相对模块上可装纳5 mL 的反应管,溶液体积小,所以温度上升快;其次,恒温混匀仪带有摇动功能,可以加快热的传递,而模块上的溶液是静止加热的。
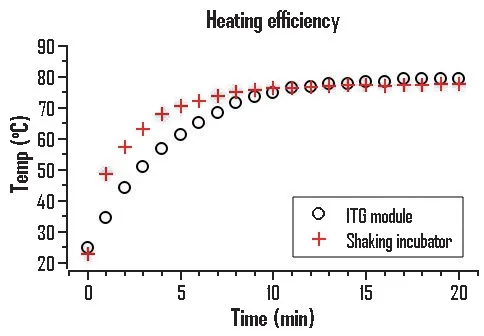
图1 ITG模块与恒温混匀仪上溶液温度随时间变化
注意,将加热器的平衡温度设在95 ℃,在ITG模块上是通过模拟信号旋钮来调控温度的,恒温混匀仪是通过数字信号来调控温度,在被加热的液体达到平衡温度时,平衡温度只达到了80 ℃,而不是95 ℃。虽然所使用的数字温度计有可能和实际的真实温度有偏差,但是使用的是同一个温度计测量温度的变化,所以这两个被加热的反应管的温度变化不存在因不同温度计而带来的误差。
2.5 反应时间
获得这两个加热器的加热效率的信息后,又进一步测量了在ITG 模块上不同加热时间的标记率,见表1。

表1 ITG模块上不同加热时间的标记率情况
前面提到,反应时间为10 min时,测得的标记率是42%,因为每次取样在HPLC 进行检测就需要大约10 min的时间,为了较好地与前面反应时长为10 min 的结果进行对比,此处没有先测10 min 时间节点的样品,而是先测量15 min时间节点的样品,经过放射性HPLC检测,其标记率是38%,说明在标记率的误差范围内增加反应时间没有提高标记率。
对于10、20 和25 min 时间节点,分别取出约1 mL反应液放在室温环境下等待检测。因为每一个样品的测量时间为10 min 左右,所以20 min 节点的样品是在室温下放置5 min后进行检测的,10 min节点的样品是在放置25 min 后进行检测的,25 min 节点的样品是在放置20 min后进行的检测。1 mL的样品液在从高温的模块上取下后,其温度会缓慢降低,在这个过程中,虽然加热停止了,但是标记反应仍然会继续进行,造成除首个检测样品外的其他时间节点样品的反应时长随着放置时间增加而延长。所以对于10 min 节点的样品,其有效的反应时间是在10~35 min 之间,这就解释了为什么所检测到标记率是60%。
从标记率的检测结果可以看出,延长有效的反应时间,标记率会有所改善,但是,即使是对于最长的25 min时间节点的样品,有效反应时间在25~45 min之间,其标记率也只是接近70%。
从这些实验可以看出,在模块上增加有效反应时间可以增加标记率,但是仍然没有达到以前的标记率水平。为了增加混匀,尝试了向反应管中吹气,分别在反应开始、5 min和10 min的三个时间节点吹20 mL 空气进入反应液,反应15 min,测量标记率为47%,比无吹气混匀情形下的38%高出了约9%。取相同的反应液在恒温混匀仪上反应,反应时间15 min,标记率为98%。从这里看出,独立加热器的混匀功能帮助了标记率达到了98%。但是,需要解释是什么原因使得以前使用模块就可以完成的反应,现在必须借助恒温混匀仪才能完成。
2.6 pH环境
使用模块时,不同的操作人员在具体操作上可能稍有不同,其中一步就是,是否把从淋洗液出口到反应管之间这段管线内剩余的盐酸淋洗液吹入反应管,这段管线内可盛装液体的体积为0.28 mL。同时,在盐酸淋洗液的出口处有一段延长管,这个延长管是为了操作方便使用的,如果使用前这段延长管是空的,它也会残留一部分的淋洗液,其体积为0.24 mL。按照这个推理,管线残余会引起盐酸淋洗液比正常的4 mL少0.52 mL。另一方面,也要了解如果盐酸过多对标记率的影响。
按照前面pH验证的方法,分别将盐酸的体积在4 mL 的基础上减少0.6 mL 和增加0.6 mL,使用pH计测量反应液的pH。盐酸体积分别为3.4,4.0 和4.6 mL,取1.0 mL 醋酸钠溶液,0.1 mL水(模拟前体水溶液体积),测量所得的pH 分别为3.89,3.61 和2.71。按照盐酸和醋酸钠溶液的比例,取340 和460 μL 的镓淋洗液,100 μL 醋酸钠溶液,2.5 μg/40 μL前体水溶液,在独立的加热器上95 ℃反应15 min,测量标记率分别为91%和42%。
可以看出,改变盐酸的体积对标记率有影响,但是,按照估算的盐酸体积,不会导致标记率减少到42%,反而是多加盐酸,改变反应溶液的酸碱度更大,使标记率大幅度下降。所以,在模块上的标记率降低不是来自残留在管线里面的盐酸。
2.7 对比模块和无混匀恒温混匀仪
为了进一步寻找原因,测量了在模块和关闭混匀功能时使用恒温混匀仪的标记率。提前预热模块和恒温混匀仪至90 ℃,将1 mL 醋酸钠溶液和25 μg/0.1 mL前体水溶液混合推入模块的反应管,然后推入4 mL 盐酸淋洗液,吹入空气混合反应液。然后从模块的反应管中用气流推出1.5 mL 反应液到离心管,放在恒温混匀仪上反应,反应10 min 后取下,各取20 μL 样品在HPLC测试,结果显示模块上的标记率是98%,这个结果同之前在相同的装置和条件下测得的42%的标记率完全不符合,见图2;测量在关闭混匀功能时使用恒温混匀仪的标记率是97%,两者标记率在误差范围内基本相同;为了验证,又再次取样测量了在模块上的标记率,结果是97%。
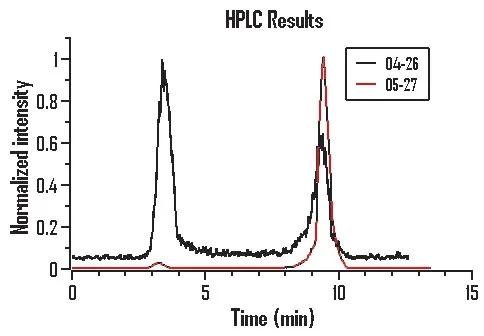
图2 ITG模块上不同日期所测量的HPLC结果
接下来于6月2日、3日、5日分别重复了三次在ITG模块上的标记实验,见表2,标记反应完全正常,产品的放化纯都在99%以上,问题已经得到解决,但是需要对问题产生和得到解决的原因进行解释。
3 讨论
3.1 对问题来源的推测
按照本文开始对问题的分析,设计实验对各种可能性进行排查,在这个过程中,问题解决了。通过进一步查看生产记录,找到了问题可能的出处。68Ga标记的DOTATATE注射液的生产记录如表2所示,4月13日,废液活度有2.4 mCi,高于正常水平,只是经过纯化后,放化纯达到99.8%,仍处于正常水平,所以问题没有引起注意;4 月14 日,产品的放化纯为95.3%,低于正常的>98%,引起了对标记问题的注意;接下来在4月21日、22日和24日连续出现异常。

表2 DOTATATE注射液04-01到06-05生产记录
在发现问题之后,进行了一系列排查实验,包括检查反应液pH 与对比使用模块和恒温混匀仪的区别,发现使用恒温混匀仪提高了标记率,所以从5月6日开始,使用恒温混匀仪手动标记,同时每次记录废液、滤膜和C-18柱上的残留活度。但是,即使是在使用恒温混匀仪的情况下,在5 月6 日和5 月18 日,标记率也出现异常,废液活度过高。最终,在5 月27日,在寻找问题的过程中发现在模块上反应恢复了正常,经过重复验证后,又改回使用ITG模块进行标记。
通过检查生产记录和总结前面的排查结果,推测标记异常是由中转瓶的盐酸被轻度污染造成的。在相同时期,也在使用同样的盐酸淋洗锗镓发生器,利用ITG模块生产68Ga-PSMA注射液,但是PSMA的标记没有出现异常,而DOTATATE对反应的体系要求较PSMA更苛刻,所以出现了明显的标记率降低,而这些又可以通过使用恒温混匀仪获得部分或者全部的补偿。当标记率不能被完全补偿时,就出现了在手动标记的情况下废液活度过高;当标记率获得全部补偿时,废液活度水平正常,所以推测是盐酸被轻度的污染,还没有达到完全使DOTATATE标记不上或者影响到PSMA标记的程度。
当用完了被污染的盐酸,从备用瓶补充了未被污染的盐酸,原来的问题也就解决了。因为要检查盐酸被污染的情况,需要特定的仪器设备,限于实验条件,无法完成此类检测。同时,因为没有记录中转瓶盐酸的具体补充日期,所以没有办法重复验证此假设。
标记实验之所以存在这样一个潜在的问题,是因为每次取盐酸的注射器在3月份之前是重复使用的,而注射器每次是伸进中转瓶吸取盐酸,当外部带有少量盐酸的注射器接触到铁质的屏蔽柜时,就有腐蚀并将铁元素带入中转瓶的可能性,从而污染盐酸。当注意到这个潜在的问题后,在3 月6 日就更新了操作规程,要求每次淋洗锗镓发生器都要更换注射器,使用新的注射器抽取中转瓶内的盐酸,避免污染。
4 月份发生的标记率异常,有可能是在更新操作规程后,有些其它实验人员在锗镓发生器淋洗的过程中,仍然重复使用了抽取盐酸的注射器,导致中转瓶盐酸被污染。因为是轻度污染,还没有达到完全使DOTATATE 标记不上或者影响PSMA 标记的程度,另外进行DOTATATE标记的人员都已经在每次使用时更换注射器,所以在最开始也没有把问题归结为这个原因。
为了防止类似问题发生,实验室规定锗镓发生器的淋洗只由常规操作人员执行,非常规人员不允许进行淋洗操作,确保每次抽取盐酸的注射器只是一次性使用。从2020年6月份到现在,已经有一年的时间,没有再出现过DOTATATE 的标记异常问题,问题得到了有效解决,这也从侧面印证了对问题原因的推断是正确的。
3.2 降低滤膜和C-18柱残留的方法
另外,生产的DOTATATE 和PSMA 的注射液都是用1 mL 50%乙醇和5 mL 生理盐水清洗C-18固相萃取柱和除菌滤膜后勾兑而成的,注意到对于DOTATATE,其在滤膜和C-18 柱的残留活度要比PSMA高,通过增加淋洗液的体积,可以减少产品在滤膜和C-18柱上的残留,增加产品的活度。
对于滤膜上残留的活度,例如,在实验中经过1 mL 50%乙醇和5 mL 生理盐水清洗后,其残余活度经测量为3.22 mCi,使用1 mL 50%乙醇再次冲洗滤膜,其残留活度减少到0.596 mCi,再使用5 mL 生理盐水冲洗滤膜后,其残余活度进一步减少至0.067 mCi,有非常明显的效果。
3.3 检查流程
通过这一次的问题排查,总结了一份检查的流程,以供相关人员参考,见图3。一般来说,当标记率降低时,游离镓就会进入废液,首先发现的是废液活度增加,同时进行质控时,因为纯化过程中游离镓清除不彻底,产品的放化纯一般就会降低,这时应该首先检查反应的标记率。前体一般一次性分装许多小份,不至于互相污染,所以该流程图没有考虑前体的污染。更换盐酸和缓冲液,使用备用盐酸和备用缓冲液进行标记就是为了排除污染引起的标记率降低,一般来说,盐酸被污染的可能性较大,所以先对其进行检查,本文遇到的问题就是属于盐酸被轻度污染。如果排除了污染,标记率还是低,那就要检查反应液的pH,如果pH异常,可能是盐酸或者缓冲液浓度有问题,分别检查它们的pH,进行必要的更换。核查pH通常是首先进行的排查工作,但是通过本文工作的经验,可以将其放在排除盐酸和缓冲液的污染之后进行,这样或许可以提高排查效率。

图3 标记问题检查流程图
前面的这些检查都是在模块上进行,如果不存在污染,反应液pH 也在正常范围内,那就要考虑模块的加热系统是否出现故障,使用独立的加热器进行标记反应进行验证。如果在上面检查的过程中,发现了标记率恢复正常,在可能的情况下,利用标记率有问题的实验条件和标记率正常的实验条件进行对比实验,确定问题的来源。
建议每次新配置盐酸、缓冲液或者前体后,要进行标记实验来验证标记率正常,并进行记录,方便出现问题后溯源。
4 结论
在生产68Ga 标记的DOTATATE 注射液的实验中,放化纯低于正常水平,经检查发现标记率出现异常,通过分析问题的原因,设计了一系列的排查实验,检查在不同条件下标记率,对问题进行了溯源。经检查,反应液的pH正常,前体的浓度足够,不是问题的来源;在ITG 模块和恒温混匀仪上有显著的标记率差异,进一步检查发现,虽然不同加热器的加热效率不同,但是增加反应时间并没有改善标记率,从而证明不是加热效率造成的问题。
在进一步对比ITG模块和关闭混匀功能的恒温混匀仪对标记反应的差异时,发现标记率异常的问题消失了。通过检查实验生产记录和总结排查实验的结果,推测造成标记率异常的原因为淋洗锗镓发生器的盐酸被轻度污染,而通过使用恒温混匀仪,使标记率得到部分或者完全的补偿。通过规范锗镓发生器的使用,此后再也没有出现过类似情况,问题得到了有效解决。最后,根据经验,总结了一份检查流程,供相关人员在解决实际问题时参考。
