急性髓细胞白血病模型小鼠B细胞易位基因1和Ikaros家族锌指转录因子1表达水平及相关性分析
2021-09-22靳娟娟LUGMAR哈萨克斯坦
姚 玉,靳娟娟,LUGMAR(哈萨克斯坦)
(1.铜川市人民医院血液科,陕西 铜川 727100;2.陕西中医药大学,陕西 咸阳 712046)
急性髓细胞白血病(Acute myeloid leukemia,AML)为主要的白血病类型之一,也是成人常见的恶性肿瘤疾病之一[1-2]。由于该病患者伴随有骨髓造血干/祖细胞分化障碍,使得积聚的白血病细胞抑制骨髓正常造血功能并可发展转移与浸润,导致病死率一直居高不下[3]。AML患者不仅病死率高,存活者具有很高的复发率,而且起病急,给临床治疗带来了极大的困难。小鼠是白血病研究的理想动物模型,目前非肥胖糖尿病/重症联合免疫缺陷(NOD/SCID)小鼠已经广泛应用于构建白血病模型,成为研究AML发病机制的重要模型之一[4-5]。随着对恶性肿瘤发病原因的不断深入研究,AML发病机制逐渐被认识,靶向治疗在临床治疗中也取得了显著的疗效,但是仍需要寻找新的分子靶点[6-7]。Ikaros家族锌指转录因子1(Ikaros family zinc finger 1,IKZF1)的编码蛋白Ikaros是血液淋巴系统发育必需的转录因子,属于锌指DNA结合蛋白家族,可通过参与染色质重塑调控淋巴细胞分化发育[8]。B细胞易位基因1(B cell translocation gene 1,BTG1)蛋白是一种ATP依赖性跨膜转运蛋白,为一种肿瘤抑制因子,可抑制白血病细胞的增殖,其高表达能提高白血病患者的生存率[9-10]。本研究检测AML小鼠模型肿瘤抑制因子IKZF1和BTG1表达情况并进行了相关性分析,希望为阐明AML发生机制提供相关依据。
1 材料与方法
1.1 实验动物 选择雄性SPF级NOD/SCID小鼠36只,周龄3周,体重10 g,购于上海赛默科技生物发展有限公司(生产许可证号:20208482881)。本实验得到了本院动物实验中心伦理委员会的批准,严格按照动物伦理学操作,实验操作前进行适应饲养1周。
1.2 主要试剂 AML细胞系HL60细胞保存于本实验室;DMEM培养液和胎牛血清购自美国Hyclone公司;抗BTG1抗体(批号:K11169-IJC,工作浓度1∶500)购自北京百奥莱博科技有限公司;抗IKZF1抗体(批号:MAB11150,工作浓度1∶200)购自美国Abnova公司。
1.3 细胞培养与动物准备 HL60细胞培养于含有10%胎牛血清的DMEM液中,在含5% CO2、37 ℃恒温饱和湿度培养箱中培养。当达到对数生长平台期后进行传代。NOD/SCID小鼠饮用酸化水(pH 4.5),以标准颗粒饲料喂养,1周添加鸡蛋喂养2次,室内空气经中效过滤,所有小鼠喂养与接触的物品均严格灭菌,定期更换饲料、垫料及灭菌水。
1.4 AML小鼠模型制备 收集对数生长期HL60细胞悬液,1000 r/min离心5 min,取下层细胞,清洗3次后用无血清培养液调整密度至2.5×107/ml和5.0×107/ml。将36只小鼠随机等分为模型A组、模型B组和对照组,前两组依次经尾静脉注射HL60细胞1×107/只、5×106/只,对照组注射0.9%氯化钠溶液,每只注射剂量为0.2 ml。
1.5 观察指标 ①观察小鼠的一般情况,包括食欲、体重、活动能力、精神、毛发等。②在接种第7、14、28天取小鼠尾静脉血,利用血细胞分析仪检测白细胞、血小板等指标。③取上述血液样本,加入抗人CD33-FITC抗体20 μl,加入红细胞裂解液1 ml,避光孵育30 min,PBS悬浮,采用流式细胞仪检测白细胞CD33表达水平。④在接种第28天处死所有小鼠,反复冲洗骨髓腔,提取总蛋白,采用Western blot法检测BTG1和IKZF1蛋白相对表达水平。
1.6 统计学方法 采用SPSS 23.00统计学软件进行分析。计量数据以均数±标准差表示,组间两两比较采用t检验,多组间比较采用方差分析,相关性分析采用Pearson法。检验水准α=0.05。
2 结 果
2.1 模型组小鼠一般情况 模型A组和模型B组小鼠成瘤率100.0%,出现精神状态差、行动迟缓、进食减少、活动减少、嗜睡、步态不稳、体重下降等情况。
2.2 三组模型小鼠不同时间点体重比较 见表1。模型A组和模型B组小鼠在接种第7、14、28天体重均低于对照组(均P<0.05)。模型A组和模型B组小鼠体重比较无统计学差异(P>0.05)。

表1 三组模型小鼠不同时间点体重比较(g)
2.3 三组模型小鼠不同时间点外周血指标比较 见表2。模型A组和模型B组小鼠在接种第7、14、28天红细胞均高于对照组,血小板均低于对照组(均P<0.05)。模型A组与模型B组小鼠外周血红细胞、血小板比较无统计学差异(均P>0.05)。
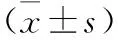
表2 三组模型小鼠不同时间点外周血指标比较
2.4 三组模型小鼠白细胞CD33阳性率比较 见表3。模型A组和模型B组小鼠接种第28天白细胞CD33阳性率均高于对照组(均P<0.05)。模型A组与模型B组白细胞CD33阳性率比较无统计学差异(P>0.05)。

表3 三组模型小鼠白细胞CD33阳性率比较(%)
2.5 三组模型小鼠BTG1和IKZF1蛋白相对表达水平比较 见表4。模型A组和模型B组接种第28天骨髓BTG1和IKZF1蛋白相对表达水平均低于对照组(均P<0.05)。模型A组与模型B组小鼠BTG1和IKZF1蛋白相对表达水平比较无统计学差异(均P>0.05)。
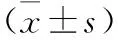
表4 三组模型小鼠BTG1和IKZF蛋白相对表达水平比较
2.6 BTG1和IKZF1蛋白相对表达水平与其他指标相关性分析 见表5。在模型组中,Pearson相关性分析显示,BTG1和IKZF1蛋白相对表达水平与CD33阳性率、体重、红细胞、血小板都存在相关性(均P<0.05)。

表5 BTG1和IKZF1蛋白相对表达水平与其他指标相关性
3 讨 论
AML是因髓系前体细胞基因受损而导致的血液性肿瘤性疾病,多数患者伴随有细胞遗传学异常。该病的自然病程仅为数周到数月,具有很高的病死率[11]。该病发生机制还不明确,遗传学异常不仅导致AML发病,也关系到疾病的进展与预后。NOD/SCID小鼠保留了脊髓损伤小鼠T、B淋巴细胞缺陷的特点,同时还具有无循环补体、巨噬细胞功能损害、渗漏现象少、不能发生自发免疫性糖尿病、NK细胞活性低等特点,是AML实验研究的理想模型[12]。本研究显示,模型A组和模型B组小鼠在接种第7、14、28天的体重、血小板均低于对照组,红细胞高于对照组,且模型A组与模型B组比较无统计学差异,表明建模成功。
AML是血液系统常见的恶性肿瘤,具有幼稚细胞失去分化能力、各种异常细胞免于被机体清除、细胞不受控制地增殖等特点[13-14]。本研究显示,模型A组和模型B组小鼠接种第28天白细胞CD33阳性率高于对照组,但模型A组与模型B组比较无统计学差异。白细胞CD33阳性率升高,表明白血病细胞的凋亡能力降低,多伴有浸润,可促进白血病细胞增殖,导致疾病恶化[15-16]。
本研究显示,模型A组和模型B组接种第28天骨髓BTG1和IKZF1蛋白相对表达水平低于对照组,但模型A组与模型B组比较无统计学差异。从机制上分析,IKZF1基因含8个外显子,其表达的蛋白包含结合DNA的N端4个锌指结构,并且C端具有2个锌指结构,锌指结构与DNA正确结合才能正常发挥功能[17-18]。抑制IKZF1的表达可以通过抑制脯氨酰羟化酶导致氧化诱导因子1α上调,使细胞的氧化还原状态发生紊乱,最终导致恶性肿瘤。BTG1可参与表观遗传学调控作用,启动或维持基因启动子CpG岛的甲基化状态,沉默相应基因的表达,其能增强Cyclin E的表达,使细胞阻滞在S期,从而抑制肿瘤细胞的凋亡[19]。BTG1表达下降也可促进癌基因的表达,如通过阻碍细胞色素C的释放以抑制肿瘤细胞Caspase-3蛋白酶级联反应,从而抑制肿瘤细胞的凋亡[20]。
NOD/SCID AML模型小鼠表现为全身性发病,血细胞呈典型“两系增殖受抑、一系增殖过度”的表现,腹腔内可出现明显的瘤体,严重者甚至将器官粘连成实体瘤,导致疾病恶化[21-22]。本研究Pearson相关性分析显示,AML模型小鼠BTG1、IKZF1蛋白相对表达水平与CD33阳性率、体重、红细胞、血小板都存在相关性。从机制上分析,BTG1、IKZF1蛋白都可以诱导B、T淋巴细胞分化,调控细胞凋亡及细胞周期,并且可以通过调节多种基因表达来调控Notch信号通路,导致细胞分化抑制,加速白血病的发生与发展[23]。
综上所述,BTG1、IKZF1蛋白在AML模型小鼠呈现高表达,其表达水平与小鼠体重、外周血及肿瘤浸润程度存在相关性。但本研究也存在一定的不足,没有进行细胞学分析,也没有进行不同模型分析,因此将在后续研究中进一步探讨。
