含铬废水的电化学法处理技术及研究进展
2021-09-22李彦娟王三反
李彦娟,王三反
(1.兰州交通大学 环境与市政工程学院,甘肃 兰州 730070;2.兰州理工大学 土木工程学院,甘肃 兰州 730050; 3.寒旱地区水资源综合利用教育部工程中心,甘肃 兰州 730070)
铬金属被广泛应用于金属电镀、油漆和颜料、皮革制革、纺织染色、木材防腐及耐火材料等工业领域[1]。涉铬行业众多,铬污染问题具有普遍性,由于重金属自身不可降解性,含铬废渣与废水的不当排放会造成严重的环境污染问题。铬元素水环境中主要以Cr(Ⅵ)和Cr(Ⅲ)两种稳定的形态存在,相比Cr(Ⅵ)毒性对环境和人类健康的毒害较大,因此,各国对饮用水中的铬含量都作了限值,我国将 Cr(Ⅵ)列为需严格控制的第1类污染物,《生活饮用水卫生标准》(GB 5749—2006)中规定水中Cr(Ⅵ)的限制为0.05 mg/L,《污水综合排放标准》(GB 8978—1996)中明确规定 Cr(Ⅵ)采样点的最高允许排放浓度为 0.5 mg/L。而将Cr(Ⅵ)去除或还原为低毒的Cr(Ⅲ)是废水除铬的关键过程[2]。
当前工业废水处理中大都采用是化学还原沉淀法,在酸性条件下,通过投加NaSO3等还原剂将Cr(Ⅵ)还原为Cr(Ⅲ),再在碱性条件下Cr(Ⅲ)转换为Cr(OH)3沉淀析出,从而从水体中去除,该方法流程复杂,药剂投加量大且宜产生二次污染风险等问题给实际生产带来了不便,加之当前严格的环保管控,使得对含铬废水处理的研究一直受到广泛关注。众多研究方法如吸附、离子交换、膜法分离、生物处理、光催化等[3-5],然而,这些方法虽然取得了一定的实验效果,但仍存在一些问题如低浓度下处理效果差、稳定性不高、再生困难、操作维护成本高以及造成废物二次处置等环境问题等,使其在实际应用中受到很大的限制。电化学方法是通过电解质离子的定向迁移或电极上电子的得失来实现Cr(Ⅵ)的去除或还原由于无须外加化学 试剂,没有或很少产生二次污染以及具有高效性等特点,得到了广泛的关注,被认为是一种绿色可行的除铬方法。本文针对不同的电化学过程原理,主要包括电絮凝、电还原、电渗析(反向电渗析)等除铬技术,对含铬废水的电化学处理与资源化方面的国内外研究进展以及研究现状进行了回顾和梳理。
1 电絮凝除铬技术
电絮凝(Electrocoagulation,EC)是在外电场作用下,金属阳极被原位氧化为金属阳离子,经水解、聚合反应生成氢氧化物和多核羟基络合物絮凝剂,相较于化学絮凝其产生的絮体更大,更易沉淀去除[6]。同时,水和有机杂质在两极被电解生成氧气、氢气等,起到气浮分离作用。此外,一些污染物质还可在电极附近直接被氧化或还原去除,因此可以说电絮凝是通过凝聚、吸附、气浮、氧化、还原等多效耦合作用实现污染物的分离去除。由于在此过程中没有添加任何化学药剂,因此污泥生成量小,具有良好的成本效益。被广泛应用于污水中重金属、有机物等污染物的去除。装置由电解池和阴/阳电极及直流电源组成,阳极又称牺牲阳极,通常是铝或铁阳极。
1.1 铁(Fe)阳极电絮凝除铬过程
在铁(Fe)阳极电絮凝系统中,阳极主要发生铁的溶解以及水的电解,主要反应如下:
(1)
(2)
在阴极发生的反应主要有水的电解和Cr(Ⅵ)的直接还原:
(3)
2Cr3++14OH-(主)E0=1.33 V
(4)
此外,电氧化产生Fe(Ⅱ)离子,将Cr(Ⅵ)还原为毒性较低的Cr(Ⅲ):
(5)
随着阴极上氢气的析出水中的pH升高,诱使铬(Ⅲ)以氢氧化物的形式沉淀:
Cr(OH)3(S)↓ Ks=6.7×10-31
(6)
溶解的金属离子和氢氧化物离子在体积溶液中反应生成几种氢氧化物:
Fe(OH)2(S)↓ Ks=1.65×10-15
(7)
Fe(OH)3(S)↓ Ks=4.1×10-38
(8)
铁阳极电氧化而产生的亚铁离子除了发挥出还原功能外,还使氢氧化铬凝聚并被吸附,加快了废水的固液分离过程,因此具有较高的效率(>90%)。影响电絮凝效果的主要因素有溶液的pH、Cr(Ⅵ)初始浓度、外加电流、反应时间等[7]。电絮凝去除Cr(Ⅵ)分为两个阶段:阴极或Fe对Cr(Ⅵ)的还原及阳极生成的Fe(Ⅲ)/Cr(Ⅲ)共沉淀,在低pH下,在低pH值下,有利于Fe(Ⅱ)对Cr(Ⅵ)的还原,而Fe(Ⅲ)/Cr(Ⅲ)沉淀发生在pH高于3处,这是由于金属氢氧化物在低pH下的低溶解度所致[8],氯离子跟质子的协同作用使得阳极氧化溶解电流效率大于100%。相关文献表明去除1 L电镀废水中的铬成本约为化学混凝剂(FeSO4·7H2O)的1.4%且产生的污泥量更低;与活性炭吸附相比,除铬速率更高[9]。
1.2 Al阳极电絮凝除铬过程
与铁阳极略有不同,铝阳极电絮凝过程主要为阳极溶解的铝离子生成多核羟基配合物,通过吸附作用将水中的除去。其表面的原位吸附作用相比化学混凝剂高出100倍[10]。Al阳极反应式如下:
阳极反应:
(9)
阴极反应:
(10)
整个电极反应:
(11)
在中性条件下Cr(Ⅵ)的去除途径主要为阴极的直接还原以及Al(OH)3的吸附絮凝作用。同时阴极氢气的析出导致局部pH的显著增加,生成两性[Al(OH)]4-,对Al电极处理后的沉淀污泥进行了定性分析,发现存在大量 Cr(Ⅵ),由此分析吸附过程可能对铬的去除起主要作用。大量研究表明,铁阳极除铬效率优于铝阳极[11],可能是Fe-Cr配合物比Al-Cr配合物具有更高的稳定性。
EC是一种高效的除铬手段,在5~120 min处理时间内(表1),可以完全去除0.2~1 000 mg/L浓度范围的Cr(VI)。 然而,这一过程也有一定的局限性,如牺牲阳极的周期性替换和阴极钝化膜的形成,需要日常的清洁和维护。为了达到更好的去除效果及更低的成本效应,常与生物法、膜分离法或其他电化学技术联用以提高除铬效率[19]。

表1 不同电絮凝系统除铬效果对比Table 1 The comparison of Cr(VI)removal by electrocoagulation in different systems
2 电还原除铬技术
电化学还原除铬是指在一定的电压下,Cr(Ⅵ) 在阴极得到电子转化为低毒的Cr(Ⅲ),在此过程中电极材料只充当电子的传递媒介,不会发生电极的溶解,避免了电极的周期性替换及溶解态金属造成的二次污染,同时还原电极一般具有较高的导电性,从而能够提高反应速率、缩短处理周期、降低处理成本[20]。相比化学法除Cr(Ⅵ),电化学还原Cr(Ⅵ)其效率是二价铁还原剂的7倍,运行成本低近30%[21]。电还原除铬的除铬技术在很大程度上取决于阴极材料及反应器的设计。
2.1 电还原电极材料的研究
2.1.1 碳材料电极 碳电极因其低成本,高催化活性被广泛应用于Cr(Ⅵ)的电还原。Golub等[22]探究了石墨毡阴极对Cr(Ⅵ)的电化学还原,实验证明了Cr(Ⅵ)至Cr(Ⅲ)的还原,但是由于阴极水电解产氢形成局部高pH环境致使不溶性 Cr(OH)3附着于电极表面,影响电极性能,通过对pH和电位的控制可实现单柱内Cr(Ⅵ)的完全去除及电极的再生。Rana等[23]制备了钛基碳气凝胶电极,其电阻率低,比表面积高(400~1 100 m2)和可控孔径分布(≤50 nm), 电还原形成的Cr(III)的部分可以在阴极上电沉积或保持在阴极层中,而一部分也可以被输送回电解质。 因此,尝试用NaOH溶液从负载金属的碳气凝胶中解吸铬,最大解吸率接近 95.36%。Wang[24]研究在不锈钢网(SSM)上气相沉积碳纳米管(CNT)阵列用于电化学还原Cr(Ⅵ)及可逆吸附Cr(Ⅲ)以减少铬金属污染物的排放,发现3D结构的碳纳米管相比不锈钢网电极其比表面积增加了13倍,加速了Cr(Ⅵ)的还原不影响Cr(Ⅲ)的吸附,通过逆转极化释放Cr(Ⅲ)再生电极,省去了化学药剂的投加再生。同时指出,电极分层结构的合理设计是提高污水电化学处理性能的可行方法。
2.1.2 导电聚合物电极 导电聚合物由于其良好的导电性、稳定性及高速的电催化还原等特性,作为Cr(Ⅵ)的自发电子供体得到了广泛的研究。其原理见图1,首先聚合物的氧化以还原Cr(Ⅵ),再通过施加阴极电位进行聚合物的还原并在一个新的循环中重复使用,聚合物薄膜沉积在衬底上还为反应提供了大的比表面积,增加了催化活性点位数量。Conroy[25]报道了铝基聚吡咯ppy膜对Cr(Ⅵ)的还原,并证实了在没有Cr(VI)的情况下以负电位对电极进行再生。Tian[26]认为,聚吡咯(ppy)修饰电极比不锈钢(SS)电极具有更高的去除率和电流效率的优点。在恒电位过程中,Cr(VI)去除效率分别达到92%(ppy电极)和18%(SS电极),Rodríguez等[27]研究了ppy电聚合条件及聚合效率对除Cr(Ⅵ)的影响,表明在低扫描速率、高合成正电势条件下制备的聚吡咯修饰电极可取得更好的除 Cr(Ⅵ)效果。与聚吡咯电极相比,Ruotolo[28]指出聚苯胺是一种更适合的导电聚合物,具有更快的反应速率和稳定性。 通过对PANI、ppy修饰的RVC电极再Cr(Ⅵ)的电化学还原应用发现,相同条件下PANI/RVC电极相较于裸 RVC 电极可取得更快的Cr(Ⅵ)还原速率及更高的电流效率,PANI/RVC电极在闭路条件电化学稳定性优于ppy/RVC,pH对反应速率有很大影响。
为进一步提高反应效率,Yang[29]采用电化学聚合和化学技术相结合的方法合成了石墨烯-聚苯胺(GR-PANI)电极。结果表明,GR-PANI具有较大的比表面积和松散的结构,对Cr(VI)还原具有较高的灵敏响应和优异的电催化活性。Mo[20]通过电化学合成法制备了硫酸-甘氨酸共掺杂聚苯胺修饰的网状玻璃碳电极(RVC/PANI-SA-GLY),构建了吸附-电还原体系加快Cr(VI)的去除(图1右),甘氨酸的加入不仅提高了共掺杂聚苯胺的电化学聚合速度,同时其氨基的正电性可对Cr(VI)阴离子起到吸附作用加速传质来提高Cr(VI)的还原效率。
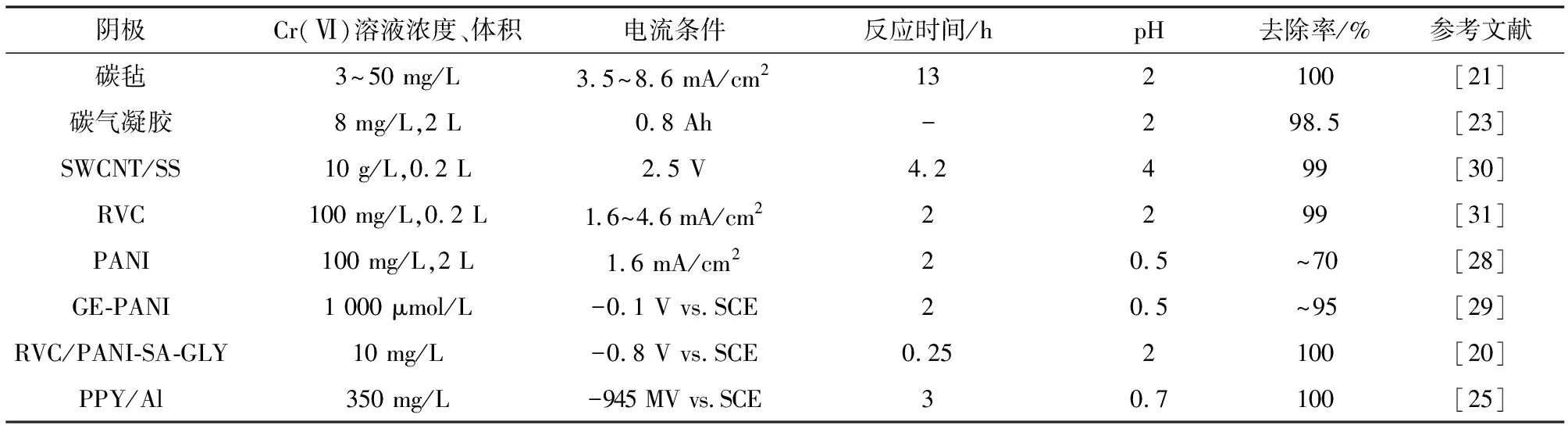
表2 电化学还原过程中不同的电极材料一览表Table 2 The comparison of electrochemical Cr(VI) reduction in different systems
2.2 电化学反应器设计优化及组合
2.2.1 反应器设计优化 反应器是电化学反应发生的场所,其结构设计对处理效果、能耗的影响至关重要。Rodriguez等[32]利用RVC电极组建了平行板反应器,分别在25,43 min内将模拟/实际废水的 Cr(Ⅵ)浓度降至0.1 mg/L,尽管实验电流效率不高,但该技术所取得的快速还原动态响应使其具有一定的处理优势和应用价值,提升了 RVC电极用于实现含Cr(Ⅵ)废水零污染排放的可能性。吉庆华等[33]研究了层状结构石墨烯负载聚苯胺(LGS-PANI)穿流电极对Cr(Ⅵ)的电催化还原,相比浸没的平行板电极,其除铬效率高出6.4倍(酸性)、17.3倍(中性),动力学模型证明该流动模式大大增加了溶液与电极的界面传质,Cr(Ⅵ)还原率为99.8%,运行40 d后还原率仍高于98%,平均电流效率为99.1%。Hou等[34]开发了一项电化学还原与生物吸附相结合的技术(ECAB),采用具有优异电催化活性的钯(Pd)膜电极用于Cr(Ⅵ)的电还原,同时协同改性海藻(MSW)生物吸附剂对Cr(II I)的吸附来实现Cr的同歩去除,在此过程中,电化学还原涉及Cr(Ⅵ)阴极直接电还原及原子H*的和间接电还原,电还原的存在加速了生物吸附剂的吸附动力学过程。
2.2.2 反应器功能化——燃料电池体系 据报道,在美国生产的所有电力中,约有3%(15 GW)来自于废水处理,而废水中仍然约有17 GW的能量尚未被回收[35]。 燃料电池是将化学能通过在电极上的氧化还原反应转化为电能的装置,近年来被广泛用于环境保护和能源领域。其中微生物燃料电池(MFC)是一种利用生物催化剂(微生物),将有机物中的化学能直接转化成电能的装置。其基本原理见图3,在厌氧环境下微生物阳极分解有机物,释放电子和质子,并通过外电路传递到阴极形成电流,质子通过质子交换膜传递到阴极,氧化剂在阴极得到电子被还原。Tandukar等[36]首次尝试采用生物阴极MFC进行Cr(Ⅵ)的还原,结果表明Cr(Ⅵ)在该系统下能够被MFC 阴极的自养混合菌降解和去除,在电流密度为123.4 mA/m2、功率密度为55.5 mW/m2条件下,获得了最大Cr(Ⅵ)还原率为0.46 mg Cr(Ⅵ)/gVSS·h。为了提高阴极还原效率Huang等[37]利用受Cr(Ⅵ)污染地区细菌作为接种剂,在初始Cr(Ⅵ)浓度为39.2 mg/L、电流密度为6.9 A/m3条件下,还原率为(2.4±0.2) mg/g VSS·h,产电功率为(2.4±0.1)W/m3。Wu[38]采用不同方法处理的多壁碳纳米管改性的碳毡电极作为MFC生物阴极,结果表明改性石墨毡由于含氧官能团的存在显著促进了MFC的Cr(Ⅵ)去除和产电量,Cr(Ⅵ)去除率提高到(2.00±0.10) mg/L·h,高出未修饰电极2.05倍。还尝试在MFC阳极上富集外电生物膜,然后将其逆转为阴极,通过优化驯化方法,提高了Cr(Ⅵ)还原型生物阴极的性能,同时该方法将生物驯化期缩短到19 d,Cr(Ⅵ)降低率提高2.9倍。除此之外,刘等[39]首次尝试在双室MFC的阴极通入空气,通过监测阴极上H2O2的积累和消耗与Cr(Ⅵ)浓度的变化,指出Cr(Ⅵ)的还原包括阴极直接电化学还原和通过原位生成的过氧化氢间接化学还原两条途径,原位生成的过氧化氢对Cr(Ⅵ)的还原比直接电化学还原更有利。Wang等[40]研究了Fe(Ⅲ)作为电子穿梭体在提高废水中有毒重金属六价铬(Cr(Ⅵ)还原率方面的作用,指出 Fe(Ⅲ)电子穿梭体增强MFCs中Cr(Ⅵ)的还原,库仑效率在Fe(Ⅲ)存在下增加1.6倍。
由于在较低的pH(pH<5)值下,细菌的外电源活性会受到明显抑制使得生物阴极MFC在酸性介质的降解存在局限性[37],Li等因此开发了无细菌阴极的MFC来处理酸性Cr(Ⅵ)废水[41],然而酸性阴极中的H+会扩散到阳极,使微生物失活,影响MFC的性能。 因此,针对一些酸性重金属废水的燃料电池或装置,张慧敏等[42]研究了利用碱性乙醇燃料电池发电同步还原Cr(Ⅵ),乙醇和六价铬所含的化学能通过电催化剂直接转化为电能,在阴极中使用较低的pH时,化学燃料电池的功率密度比MFC高两个数量级。 许伟等[43]研究了尿液/Cr(Ⅵ)燃料电池(UCrFC)进行Cr(Ⅵ)的还原,试验中采用尿液代替乙醇在碳负载纳米Ni催化剂阳极上发生电氧化,同时在无催化剂阴极上进行强酸性Cr(Ⅵ)废水的电还原。1.3 V开路电压下UCRFC的最大功率密度达到3.4 W/m2,库仑效率大于98%,Cr(Ⅵ)降低达到90%以上。
3 电渗析除铬技术
3.1 电渗析(Electrodialysis,ED)
电渗析是一种利用离子交换膜分离溶液中电解质的电化学水处理技术,即在直流电场作用下阳离子透过阳离子交换膜向阴极迁移,阴离子透过阴离子交换膜向阳极迁移,于是在交替排列的阴/阳离子交换膜之间形成了浓水和淡水隔室,从而实现了电解质的分离富集,其原理见图3。已被广泛应用于海水淡化、污水处理等领域。
ED也被用于电镀废水中铬和其他重金属的回收[44],由于铬酸根为阴离子,因此可以通过阴离子交换膜向阳极迁移,实现电镀废水中与其他金属阳离子的分离,达到回收目的。在较低的pH下,由于离子传输增强,ED对低浓度的Cr(Ⅵ)去除尤其有效,使其在电镀和金属精加工废水处理中具有优越性[45]。陈[46]开发了一种利用单价选择性电渗析膜从低pH电镀废水中浓缩和净化 Cr(Ⅵ)的ED系统。铬酸盐回收率随电流密度、流量和膜面积的增加而升高。然而高浓度的Cr(Ⅵ)废水会对离子交换膜膜孔造成堵塞导致去除效率急剧下降,因此Peng等[47]采用化学沉淀法(CP)和电渗析法(ED)相结合的方法,可以将处理过的水完全回收到电镀生产线上,减少环境问题,降低试剂和操作成本。
3.2 填充床电渗析(Electrodeio nization,EDI)
在ED过程中,随着淡室离子的减少,系统电阻增加,浓差极化加剧,致使能耗增加,去除效率降低。一种有效的解决方法是在淡室填充离子交换树脂,这种技术称为电极化(EDI),又称填充床电渗析。在EDI过程中淡室中的离子首先与填充的树脂发生离子交换,然后在电场作用下迁移过膜,同时在电场的作用下,水的电离可进行树脂的再生,如此“吸附交换-再生”循环可实现连续电脱盐,该技术常用于深度除盐工艺。
Basha等[48]采用EDI从电镀漂洗废水中去除及浓缩铬酸盐离子,回收处理后的水,在电压为12.5 V 的EDI间歇循环运行模式下,最大除铬率为98.82%。时军[49]研究了进水 pH、流量和电流密度对 EDI分离效率的影响。结果发现,当进水pH为 4.8,流量和电流密度分别为4 L/h和1.2 mA/cm2时,Cr(Ⅵ)的分离效率可达99.5%,是一种能够高效分离电镀铬漂洗废水中六价铬的新技术。
3.3 反向电渗析(Reverse-electrodialysis,RED)
反向电渗析(RED)是一种通过捕获离子交换膜之间浓水室和淡水室的盐度梯度来直接产电的过程。在膜两侧浓度差的作用下,盐离子的迁移形成内电流,内电流通过电极处的氧化还原反应转化为外电流。随着RED性能的优化,该技术也被用于废水中铬的处理研究中。Scialdone[50]就首次提出了一种基于盐度梯度的废水处理和同时产生电能的可持续技术,利用RED产生的电流在阴极进行Cr(Ⅵ)的还原反应,实现同歩除铬和产电过程。
4 结语与展望
针对目前的电化学除铬技术的机理及国内外研究现状进行了详细地回顾。利用“清洁试剂”—电子,通过电絮凝、电化学还原、电渗析等不同的电化学技术,可以成功的实现Cr(Ⅵ)的有效去除或分离。随着电化学表征手段的不断发展,使得我们对电化学原理与应用的探究取得了很大的进步,对电子转移的精确调控来实现对目标污染物的定向转化成为可能,研究过程也逐渐从宏观的去除效果到电极材料的微界面过程探索。因此综合国内外电化学除铬及资源化的研究状况,笔者认为将来可以从以下几个方面开展研究:
(1)电极材料的优化改性。电化学反应过程界面传质的优劣取决于电极材料表面的特性,如何对电极材料表面进行设计来强化铬的高效去除与电极的持续稳定传质及提高电流效率是当前和未来需要解决的一个问题。
(2)集成反应器的开发及调控。“电化学+”组合工艺表现出良好的协同效应,成为高效电化学反应器开发的科学依据,如何让铬在集成反应器内实现高效降解分离回收值得我们思考。
(3)能源的同步回收。正文中提到的MFC、FC、RED过程都涉及同步产能过程,如何在除铬的过程中同步回收低品位热能用进行能源回用,从能耗角度来看也是非常值得研究的方向。
