黑鲷钙调磷酸酶B同源蛋白2(CHP2)基因克隆及表达差异
2021-09-22陈淑吟张志勇孙瑞健贾超峰张志伟吴国均
陈淑吟,张志勇,孙瑞健,贾超峰,孟 乾,祝 斐,张志伟,吴国均
( 江苏省海洋水产研究所,江苏 南通 226007 )
钙调磷酸酶B同源蛋白2(CHP2),为钙离子结合蛋白亚家族(CHP)的一个成员[1],最初是作为肿瘤相关抗原的编码基因(HCA520)被发现[2],其表达水平与癌细胞的增殖关系密切[3],是参与细胞增殖调控的重要因子[4-5]。研究表明,减少CHP2基因表达或抑制其活性可作为加速细胞死亡的新方法[6],而对正常细胞增殖影响的研究发现,CHP2对细胞增殖和迁移的作用可能与细胞是否为癌细胞没有关系[7]。更多的研究表明,CHP2的一项重要功能是与钠氢离子交换蛋白(NHE)结合而激活该因子,调控细胞内离子转运及细胞酸碱平衡[8-10],进而影响细胞的生长、分裂、增殖、分化和细胞凋亡[11]。CHP2和NHE之间的交互作用,对于保护细胞免受血清剥夺而引起死亡至关重要[5]。而且,CHP2与NHE的亲和力是CHP1与NHE的5倍,对NHE的调节不受血清条件的约束[12]。另外,作为含有结合Ca2+的EF-hand结构蛋白,CHP2在Ca2+吸收及转运中发挥重要作用,几乎参与了从细胞增殖到细胞凋亡各方面的功能调节[9]。目前CHP2基因在海水经济鱼类中的功能研究报道较少。
黑鲷(Acanthopagrusschlegelii),又称黑棘鲷,属鲈形目、鲷科、棘鲷属,是在我国南北沿海均有分布与养殖的优质海水鱼类。其肉质细腻、味道鲜美又有较好抗逆性。由于生长速度较慢,期望通过选育或杂交培育优良新品种是20多年该类鲷鱼研究领域的一项重要内容[13-16]。在黑鲷与真鲷(Pagrusmajor)杂交得到的不同杂交后代中,杂交F2(黑鲷♀×真鲷♂)显示出最好的生长态势,而回交F1(黑鲷♂×杂交F1♀)的生长速度甚至慢于黑鲷亲本。黑鲷与这些杂交后代在30 d仔鱼期的转录组数据分析结果显示,黑鲷中与钙调磷酸酶相关的一些基因如CHP2、CHP3等的转录水平明显低于杂交子代。鉴于基因表达差异正成为当前杂种优势分子机理研究的新切入点[17],笔者以转录组中的CHP2基因序列为基础,进行该基因cDNA序列克隆与结构分析,并分析CHP2基因在黑鲷与两个杂交后代间的表达水平差异情况,为该基因在海水鱼类中的功能研究提供依据。
1 材料与方法
1.1 样本与RNA提取
试验鱼样本均由江苏海洋水产研究所人工繁育及养殖。黑鲷仔鱼用整体样本;黑鲷、杂交F2(真鲷♂×黑鲷♀)、回交F1(黑鲷♂×杂交子代F1♀)的90、180 d大规格个体,分别取脑、肌肉、肝脏等组织各约10~15 mg,放入装有RNA保护剂(QIAGEN)的1.5 mL离心管中按保护剂使用要求操作、保存。每种鱼样本均取3尾鱼作为平行。样本总RNA提取采用Trizol法,并经分光光度计测定质量浓度。
1.2 基因cDNA全长序列扩增
取部分RNA用于反转录。cDNA第一链的合成使用试剂盒RevertAid First Strand cDNA Synthesis Kit(Fermentas)。以黑鲷转录组得到的CHP2基因序列片段为基础,采用Primer Premier 5.0软件设计两条特异引物B-F1/B-R1(表1)。扩增中间片段的PCR反应体系(50 μL)为:PCR-Grade Water 15.0 μL,2×Ex taq Buffer(Takara) 25.0 μL,dNTP Mix(10 mmol/L)1.0 μL,Ex taq(Takara)1.0 μL,cDNA第一链5.0 μL,引物B-F1/B-R1(10×)各1.5 μL。PCR反应条件为:94 ℃预变性 2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。PCR产物经1.0%琼脂糖凝胶电泳,切胶目的片段并送测序,得到基因中间片段序列。根据获得的中间序列设计用于扩增5′-RACE 的3条特异性引物B-1(GSP1)、B-2(GSP2)、B-3(GSP3)及3′-RACE的2条特异性引物C-1、C-2(表1)。用试剂盒System for Rapid Amplification of cDNA Ends(Invitrogen)及SMARTerTMRACE cDNA Amplification Kit(Clotech),按说明书进行操作,扩增CHP2基因并得出5′及3′cDNA序列。PCR 扩增产物的纯化、克隆、测序与中间片段克隆的步骤相同。应用DNAStar Lasergene 7.1软件,分别组装CHP2基因的中间片段、5′-RACE片段和3′-RACE片段,获得全长cDNA序列。
表1 CHP2基因扩增与定量检测的引物序列Tab.1 The primer sequences of CHP2 gene for amplificationand quantitative detection
1.3 序列分析
基因cDNA的开放阅读框(ORF)查找使用ORF Finder(http:∥www. ncbi.nlm.nih.gov/gorf/)。跨膜区预测使用TMHMM Server v. 2.0(http:∥www.cbs.dtu. dk/ services/ TMHMM/)。信号肽预测分析采用SignalP(www.cbs.dtu.dk/services/SignalP)[18-19]。蛋白的二级结构、三级结构预测使用SWISS-MODEL服务器(http:∥www. expasy.org/ swissmod/ SWISS- MODEL. html)[20]。分子质量与理论等电点预测采用ExPASy在线服务器的Compute pI/Mw工具(http:∥ www.expasy.org/tools/pi_tool.html)。结构域分析采用NCBI Conserved domains (https:∥www. ncbi. nlm.nih.gov/Structure)。亚细胞定位采用PSORT Ⅱ软件(http:∥psort.ims.utokyo.ac.jp/ form2. html)。磷酸化位点分析使用NetPhos 3.1 Server(http:∥www.cbs.dtu.dk/services/NetPhos/)。序列相似性搜索采用NCBI网站运行BLAST程序[21]。从GenBank中搜索、下载其他鱼类CHP2氨基酸序列,并用ClustalX软件进行序列同源比对[22]。用MEGA 7软件以邻接法及最大似然法构建系统进化树[23]。
1.4 CHP2 mRNA的不同时期与不同组织的表达差异
以得到的CHP2全长cDNA序列设计合成的特异引物为:F1,CATTTTCGTCCAGCGGACTC;R1,CATCGACCGCAACACCTGAA。内参基因actin引物为:Fa,TATCGTCATGGACTCCGG TG;Ra,TGATGTCACGCACGATTTCC。进行实时荧光定量PCR。通过IO-RAD CFX ConnectTM荧光定量PCR检测系统,使用试剂Power SYBR Green PCR Master Mix (Applied Biosystems)测定基因在不同样本中的表达。荧光定量PCR反应体系为20 μL,以各样本的cDNA为模板。反应程序为:95 ℃预变性3 min;95 ℃ 10 s,55 ℃ 20 s,72 ℃ 20 s,75 ℃ 5 s并采集荧光信号,40个循环;添加溶解曲线生成程序,95~65 ℃每降0.5 ℃(5 s)采集荧光信号1次。样品和内参均设3个平行。以溶解曲线分析试验产物专一性,用2-ΔΔCt法进行初步数据统计分析结果。用SPSS 19.0分析软件进行数据统计并分析数据的差异性。试验结果用平均值±标准误表示。
2 结 果
2.1 基因cDNA全长序列与蛋白结构分析
基因中间片段扩增得到长度为479 bp的黑鲷CHP2(AsCHP2)基因序列。以此中间片段设计引物,经RACE得到基因的5′及3′两端序列,经拼接得到AsCHP2的全长cDNA为1722 bp。分析得出基因具有1个长度为69 bp的5′-非翻译区(UTR)和1个长度为1069 bp的3′-UTR,开放阅读框长度为585 bp,编码194个氨基酸(图1)。基因起始密码子为ATG,终止密码子为TGA,有加尾信号AATAAA及长度为30 bp的polyA尾巴。
分析得出AsCHP2分子式为C955H1506N274O305S5,分子质量约21.87 ku,理论等电点为4.89;不稳定指数为41.39(大于40),属不稳定蛋白;平均亲水系数为-0.559,属疏水性蛋白;脂肪指数为79.02;不含有信号肽序列,无跨膜结构;为非分泌型蛋白。AsCHP2的亚细胞定位于细胞质中的可能性最大(52.2%)。
AsCHP2结构分析显示,在氨基酸序列的113~177位之间有2个EF-hand结构域,每个结构各为12个氨基酸,特征序列分别为DQDGDGKISRDE与DADKDDAISFDE(图1)。基因序列中的EF-hand结构位置见图2a,8个Ca2+结合位点分别为在第122、124、126、163、165、167位的天冬氨酸(Asp)及第133、174位的谷氨酸(Glu)(图2b)。此外,AsCHP2序列还含有1个核输出信号(NES),氨基酸序列为LQVLRSMLGLQV(图1)。AsCHP2有6个Serine磷酸化位点。QMEAN同源建模获得AsCHP2的二级结构见图3a,其中,H对应α螺旋,S对应β折叠,T对应β转角,C对应无规卷曲;图3b为推测的基因三维结构。

图1 AsCHP2的全长cDNA序列及推导的氨基酸序列Fig.1 Full-length cDNA sequence and deduced amino acid sequence of AsCHP2*为终止密码子;两个EF-hand结构和核输出信号分别用下划线和黑框标出.*denotes the stop codon; the two EF-hand structures and nuclear output signals are underlined and black boxed, respectively.

图2 黑鲷AsCHP2基因的EF-hand结构域(a)与钙结合位点(b)Fig.2 EF-hand domain (a) and calcium binding site (b) of AsCHP2 gene in black porgy
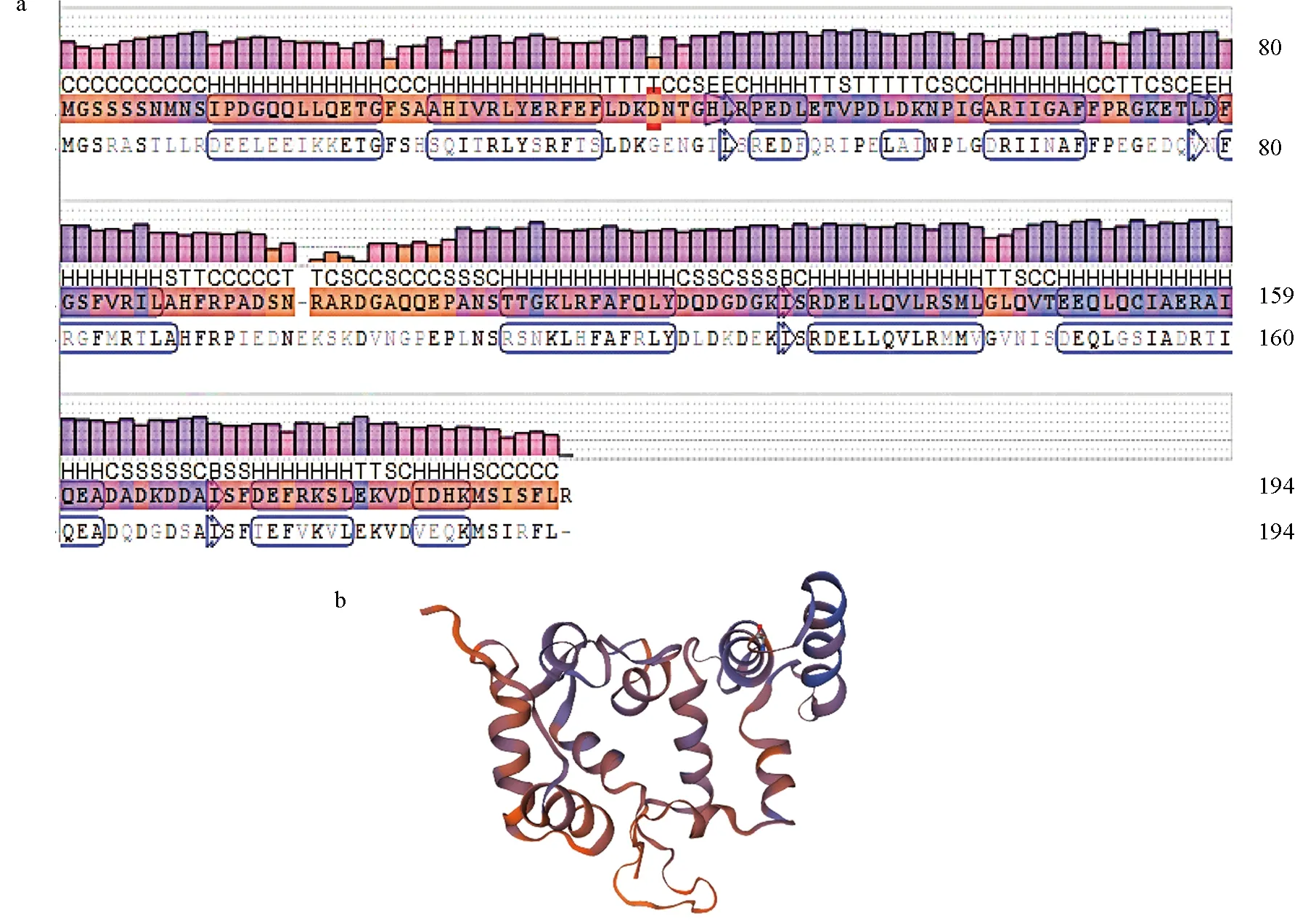
图3 AsCHP2功能结构域(a)及相应的三维结构预测结果(b)Fig.3 AsCHP2 functional domain (a) and corresponding three-dimensional structure prediction (b)
黑鲷与其他物种CHP2的氨基酸序列比对结果见图4。其中黑色部分为序列的高度保守区域,序列完全相同;蓝色和粉色部分属序列相似区域。由比对结果可知,CHP2的EF-hand及NES等结构域的序列在各物种间高度保守,提示其主要功能在各物种间也应该较为一致。黑鲷与红树林鳉(Kryptolebiasmarmoratus)、底鳉(Fundulausheteroclitus)及鲤鱼(Cyprinuscarpio)等鱼类的CHP2氨基酸序列长度一样,比人、马或虎鲸等的少了2~3个氨基酸,均为194个氨基酸,但鱼类各自的序列又有不同的变化位点,提示该蛋白可能在结构与蛋白互作上具有一定的种属特异性。利用BLAST程序比对得出,黑鲷的CHP2氨基酸序列与红树林鳉(XP 017281338)、底鳉(XP 012704873)及大黄鱼(Pseudosciaenacrocea,XP 019132367)等鱼类的相似性为80%~72%。黑鲷的CHP2核苷酸序列与大黄鱼(XM 019276822)、大刺鳅(Mastacembelusarmatus,XM 026295996)及小丑鱼(Amphiprionocellaris,XM 023296159.1)等鱼类的相似性在86%~81%间。

图4 黑鲷与其他物种的CHP2氨基酸序列同源比对结果Fig.4 Homology alignment comparison of CHP2 amino acid sequence between black porgy and other species黑色.相似性=100%; 粉色.相似性>75%; 蓝色.相似性>50%.similarity=100% in black sequence; similarity>75% in pink one; similarity>50% in blue one.
不同鱼类的CHP2氨基酸序列邻接树聚类结果显示,黑鲷未先与鲈形目的隆头鱼(Labrusbergylta)及杜氏(Serioladumerili)聚在一起,而是与颚针鱼目的青鳉(Oryziasmelastigma)、鳉形目的底鳉和茉莉花鳉(Poecilialatipinna)聚在同一分支,再与红树林鳉及鲈形目的杜氏、隆头鱼、尼罗罗非鱼(Oreochromisniloticus)、斑马宫丽鱼(Maylandiazebra)等其他鱼类聚为一支(图5)。

图5 不同鱼类CHP2氨基酸序列的邻接(a)与最大似然(b)系统进化树Fig.5 Phylogenetic tree of NJ(a) and ML(b) of amino acid sequences of CHP2 in different fishes标尺指进化距离; 节点上的数值指bootstrap验证中基于1000次重复的置信度(%).Bar refers to the evolution distance; the value on the node shows the confidence (%) based on 1000 repetitions in bootstrap verification.
同样,鳉形目也并未单独聚在一起,如红树林鳉与鲈形目的攀鲈(A.testudineus)等聚在一起,成为另一个分支。推测CHP2基因的旁系同源进化发生在鳉形目和鲈形目的形成之前。不过,鲑形目和鲤形目则聚为另外一个大支,与鳉形目和鲈形目不存在交叉。CHP2基因的邻接系统聚类树体现了不同鱼类的进化关系。同样,在最大似然系统树中也显示来自不同目的物种混杂聚在一起,而且同为鲈形目的黑鲷、隆头鱼及杜氏均未聚在一支(图5),进一步说明CHP2基因早于各个科目的旁系进化特点。
2.2 基因的mRNA差异的表达
定量检测得知,AsCHP2的mRNA在5~35 d均有表达,其中最高表达量出现在15 d(为5.88),其次出现在35 d(3.45),5 d与10 d的表达量变化不大(图6a)。90 d与180 d个体的AsCHP2基因表达量相比较,前者的肝脏、肌肉及脑各组织的表达量均显著性高于后者(图6b)。黑鲷仔鱼期的基因表达量相对低于在大个体90 d个体或180 d个体的水平。
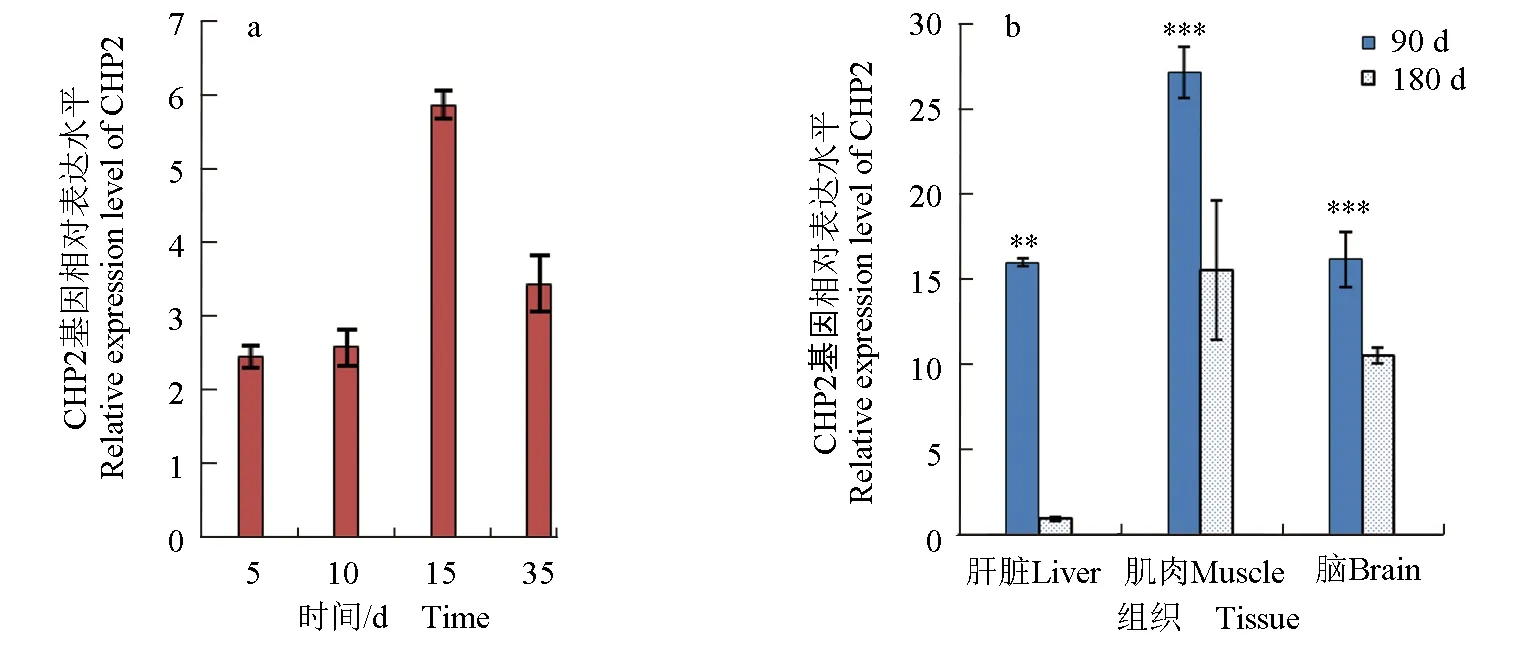
图6 黑鲷CHP2 mRNA基因不同生长阶段及组织的表达比较Fig.6 The expression of CHP2 gene mRNA in various tissues at different growth stages in black porgya.不同生长天数仔鱼的基因表达情况; b.个体各组织的基因表达情况;试验结果用平均值±标准误表示; **.P<0.01; ***.P<0.001.a.the gene expression of larvae with different growth days; b.the gene expression in various tissue; the experimental results are expressed as mean±standard error; **.P<0.01; ***.P<0.001.
同样在180 d的生长期,AsCHP2 mRNA在黑鲷、回交F1及杂交F2的肝脏、肌肉、心脏、性腺及脑等组织中均有表达,表达水平有组织特异性差异(图7)。基因在性腺组织中的表达量均为最低,呈显著性低于其他组织(P<0.01);在心脏与肝脏组织中表达量则处于相对高的水平。不同品种相比较,黑鲷的最高表达在心脏(为18.63),与其他组织相比均有极显著高表达(P<0.001),肝脏、肌肉与脑组织间的表达量无明显差异,性腺中的表达量最低。在杂交F2中,心脏组织的基因表达量也最高(为27.60),与其他组织及不同鱼种的这一组织相比有极显著性高表达(P<0.001);肝脏、肌肉、脑及性腺的表达量呈现由高到低的趋势。在回交F1中,AsCHP2 mRNA在肝脏(12.62)表达量最高,心脏组织为次高表达量(为10.0),接下来是肌肉、性腺及脑。

图7 黑鲷、回交F1及杂交F2不同组织的CHP2 mRNA表达差异Fig.7 Differences in CHP2 mRNA expression in different tissues of black porgy, backcross F1 and hybrid F2试验结果用平均值±标准误表示; Ns.无显著差异; **.P<0.01; ***.P<0.001.The experimental results are expressed as mean ± standard error; Ns.no significant different; **.P<0.01; ***.P<0.001.
3 讨 论
3.1 AsCHP2基因序列特性与功能结构
作为CHPs蛋白家族3个亚型中的一员,CHP2与其他2个亚型相比有不同的特点。CHP2基因编码区长度多为192~196个氨基酸[4]。CHP2与CHP1的氨基酸序列有61%以上的相似性[24],两者均有2个可结合Ca2+的EF-hand结构[5],不过CHP1有NES-1、NES-2两个核输出信号序列[25],CHP2只有一个NES-1序列;而CHP3序列相对较长,却仅有1个EF-hand结构(即EF3),无NES序列。本研究结果显示,AsCHP2基因编码194个氨基酸,具有2个可以结合Ca2+的EF-hand结构域(EF3、EF4)及1个NES序列,这些特性表明该AsCHP2基因属典型的CHP2基因。典型的EF-hand构型一般由12个氨基酸残基构成,包括1(D),3(D/N),5(D),6(G),8(I)、9(D/S)和12(E)位保守的氨基酸残基[26]。AsCHP2基因的2个EF-hand序列与经典的EF-hand构型一致,也为12个氨基酸残基。从哺乳动物到鱼类等不同纲目的氨基酸同源比对结果及进化树的聚类分析结果均反映出CHP2功能结构域序列的高保守性。而基因序列的高保守性多与其功能的重要性密切相关。
作为具有EF-hand结构的Ca2+结合蛋白家族中的特殊成员,Ca2+的存在影响着CHP2以及NHE的结合[27];携带Ca2+能增强CHP2与NHE1的结合能力,在血清饥饿条件下,携带Ca2+的CHP2能提升细胞抵抗死亡的能力[1]。CHP2与NHE的结合依赖于CHP2与Ca2+的结合[28]。不同物种在对Ca2+需求条件不同的进化过程,使得CHP2中的EF-hand结构及与Ca2+的结合位点也发生相应的变异。CHP2实际包含有4个EF-hand结构,不过前2个EF-hand(EF1、EF2)结构属于原始位点,不能结合Ca2+,后2个EF-hand(EF3、EF4)结构为典型的EF-hand结构,可以结合Ca2+[5,9,24]。张洪菊等[1]研究CHP2中EF-hand结构的生物功能时也发现,只有EF3、EF4结构突变才会导致CHP2结合Ca2+的功能减弱,并证明在PS120细胞系中CHP2能结合2个Ca2+,结合部位在EF3和EF4结构中。老鼠的CHP2序列中也是这2个EF-hand结构,也只有2个Ca2+结合位点[9,29]。而在AsCHP2基因的EF3、EF4结构中,却各有4个Ca2+结合位点。这是否与鱼类所处环境及对Ca2+需求与结合能力差异相关,或是不同种属间的基因变异的结果,有待于进一步探索。不过,黑鲷的另一个EF-hand基因家族的钙调蛋白(CaM)中有4个EF-hand结构,每个EF-hand结构中也是各有4个Ca2+结合[30],并且该CaM氨基酸序列与大黄鱼的相似性达到99%,显示了CaM序列在进化上比CHP2更保守。
CHP2的NES结构一般位于序列第137~148位氨基酸之间,由12个氨基酸构成[5,11]。AsCHP2的NES序列同样为12个氨基酸,只是其位于序列第135~146位氨基酸之间。CHP2的NES结构可调控蛋白独特的亚细胞分布,对蛋白的亚细胞定位至关重要。钱晓萍等[31]研究得知,CHP2不同亚细胞定位对海拉细胞增殖调控具有差异性,CHP2定位于核内将显著地促进海拉细胞的增殖和成瘤能力。
3.2 CHP2基因表达差异分析
CHP2对细胞生物学行为影响的差异可能与其在细胞内的表达量有关,表达量的差异导致了CHP2对NHEs的调节方式发生改变[32]。研究表明,CHP2是抑制细胞死亡的“因子”之一[6]。本研究中,AsCHP2 mRNA在黑鲷的仔鱼期及90、180 d个体的不同组织中均有表达,可见该基因参与了黑鲷的生长发育过程;而且,90 d个体不同组织的表达量均显著性高于180 d个体的,黑鲷的第90天生长期处于池塘水温较高的夏季,此时个体生长速度明显快于第180天的秋冬季。而且,除了性腺组织外,CHP2基因在生长快速的杂交F2个体其他各组织中的表达量,均高于在生长速度相对慢的回交F1个体。基因的高表达为杂种优势的体现[17]。本研究中的3种鱼不同组织中均检测到CHP2基因的表达,可见在这些海洋鱼类中,该基因在正常生长过程中发挥作用;而在一些哺乳动物中,CHP2基因多在肿瘤组织中有异常的高表达[24,32-33],或只少量表达于小肠、肾脏等组织中[24,29,31]。不过,本研究中CHP2基因表达有组织特异性,这一结果与在昆明鼠[34]中的表现一致。最近的研究得出,CHP2基因表达的降低可有效抑制人脐静脉血管内皮细胞(HUVEC)的增殖,CHP2基因的敲降也抑制了HUVEC细胞的迁移,明确了基因表达的多少与是否为正常组织无关[7]。目前对CHP2基因功能的了解仍较少,本研究的这些结果说明了CHP2基因在鱼类的生长发育过程中发挥作用。
4 结 论
综上所述,AsCHP2基因为典型的CHP2基因,其在早期仔鱼及成体的脑、肝脏及肌肉等组织中均有表达;CHP2基因表达量与种类及生长阶段相关,且均高表达于心脏、低表达于性腺组织。CHP2基因在海水鱼类的生长过程中发挥作用。
