不同填埋龄垃圾腐殖土中细菌群落结构特征
2021-09-19彭帅陈晓国李晓光李国文李伟李曹乐郝迎志黎佳茜
彭帅,陈晓国,李晓光,李国文,李伟,李曹乐,郝迎志,黎佳茜*
1.武汉理工大学资源与环境工程学院 2.中国环境科学研究院 3.清华苏州环境创新研究院
我国城市生活垃圾产生量巨大且与日俱增,据统计,2006—2019年我国城市生活垃圾年清运量从1.48亿t增至2.42亿t。城市生活垃圾成分较为复杂,主要由厨余废物、塑料、纺织品、废纸、木材、金属、玻璃等组成[1-3]。常见的城市生活垃圾处理方式有焚烧、堆肥、填埋等,其中卫生填埋是使用最为广泛的一种方法,占城市生活垃圾总处理量的50%以上[4-5]。垃圾进入填埋场后,经过一系列的反应最终矿化成为垃圾腐殖土。相关研究表明,腐殖土可利用性较强,一般可用作生物填料处理废水、植物栽种机质、水泥窑替代原料或用于填埋场的覆盖材料[6-9]。研究发现,堆存过程中在细菌作用下垃圾腐殖土的性质会发生较大的波动[4],因此在进行腐殖土综合利用之前,了解其细菌群落结构至关重要。
垃圾在填埋过程中,大部分可降解组分逐渐转化为填埋气体或随渗滤液排出,其余部分成为垃圾腐殖土,这个过程称为垃圾填埋场的稳定化。根据填埋场中固-液-气相的变化特征,可以将填埋场的稳定化过程分为5个阶段,分别为初始阶段、过渡阶段、酸化阶段、甲烷发酵阶段和成熟阶段[10-11]。微生物的代谢是整个过程中的主要驱动力,与真菌和古菌相比,细菌(包括纤维素水解菌群、产氢产乙酸菌群和产甲烷菌群)的参与程度更高[12-14]。近年来,大量研究人员应用克隆文库、宏基因组等生物学技术和方法,分析了填埋场中细菌群落结构和功能,结果表明,厚壁菌门、放线菌门和变形菌门是填埋场中的优势菌门,且均对纤维素等多糖类物质具有较强的分解能力[15]。此外,垃圾填埋场中细菌群落结构与垃圾本身性质(如含水率、总氮、总磷、pH等)有关。填埋年限也会影响细菌群落结构,随着填埋龄的增加,细菌群落多样性也会发生变化,呈先增加后减少的趋势[16-17]。垃圾腐殖土中存在不同程度的重金属污染,而重金属亦可显著影响微生物的丰富度以及多样性[18-19]。因此,研究不同填埋年限的垃圾腐殖土中细菌群落结构特征,有助于进一步解释垃圾在填埋过程中的生化过程。
综上所述,现有研究主要致力于探索垃圾渗滤液或填埋场周边土壤中细菌群落结构变化,而关于垃圾腐殖土中的细菌群落研究相对较少,尤其是在重金属的胁迫下,垃圾腐殖土中细菌群落结构与填埋年限的响应关系。基于此,笔者以江苏省某生活垃圾填埋场中不同填埋年限的垃圾腐殖土及填埋场周边土壤作为研究对象,系统分析细菌群落组成和变化规律,并阐明了腐殖土理化性质和重金属浓度对细菌群落的影响,以期为全面了解细菌群落在垃圾降解过程中的作用提供依据。
1 材料与方法
1.1 样品采集
垃圾腐殖土样品取自江苏省某生活垃圾卫生填埋场,该填埋场占地17万m2,总库容726万m3,设计日处理生活垃圾1 100 t,采用分区填埋,使用年限为15 a,于2005年底建成投入使用。于2020年11月对3个不同填埋年限的垃圾腐殖土进行采样,其中填埋年限1~3 a的区域记为A组,共设置2个点(A1、A2);填埋年限3~6 a的区域记为B组,共设置3个点(B1、B2、B3);填埋年限6~10 a的区域记为C组,共设置3个点(C1、C2、C3);此外,在填埋场周边采集1份土壤样品,记为D组(D1),采样点布设如图1所示。样品采集深度均为地下50 cm处,按照四分法取约500 g样品置于自密封塑料袋中低温储存。所有样品一式2份,一份用于样品理化性质和重金属浓度分析,一份用于测试细菌群落多样性,每个处理设3个平行。

图1 填埋场采样点布设Fig.1 Landfill sampling points
1.2 理化性质及重金属浓度测定
将垃圾腐殖土样品自然风干,去除其中的碎玻璃、硬质石块、金属等大块垃圾,研磨后过100目筛,储存于自密封塑料袋中。垃圾腐殖土的pH使用玻璃电极法测定,有机质(OM)浓度使用马弗炉于650 ℃灼烧后测定,总氮(TN)和总磷(TP)浓度用全自动化学分析仪测定,重金属Cd、Cr、Pb、Cu和Zn浓度用电感耦合等离子体质谱仪(ICP-MS)测定,Hg和As浓度用原子荧光分析仪测定。
1.3 细菌群落多样性分析
使用FastDNA® Spin Kit for Soil对垃圾腐殖土中的微生物DNA样品进行提取,使用338F(ACTC CTACGGGAGGCAGCAG)和860R(GGACTACHVGG GTWTCTAAT)引物对细菌16S rRNA基因的V4~V5区进行PCR扩增。采用TransGen AP221-02:TransStart FastPfu DNA聚合酶,反应体系包括4 μL 5×FastPfu的缓冲液、2 μL 2.5 mmol/L的dNTPs、0.8 μL 5 μmol/L的正向引物、0.8 μL的5 μmol/L反向引物、0.4 μL的FastPfu聚合酶、0.2 μL的BSA和10 ng模板DNA。PCR扩增程序:95 ℃变性3 min;95 ℃持续30 s,55 ℃持续30 s,72 ℃持续45 s,循环29次;最后72 ℃延伸10 min,10 ℃直至停止。用试剂盒提取扩增子在Illumina Miseq PE300平台测序。
1.4 数据统计分析
采用Microsoft Excel 2019进行数据整理和统计分析,利用Mothur(1.30.2)对样本进行α多样性分析,利用R语言对样本进行群落组成、物种Venn图以及β多样性分析。基于R语言的冗余分析(RDA)解析了细菌群落结构组成与腐殖土理化性质及重金属浓度间的关系。数据均为3个重复的平均值±标准差。
2 结果与讨论
2.1 理化性质及重金属浓度
垃圾填埋场不同腐殖土样品的理化性质如表1所示。由表1可知,不同点位腐殖土pH均位于7.0~7.9,且随着填埋年限的增长,pH呈微弱的减小趋势,填埋前期呈弱碱性,而超过6 a后,基本维持在中性。OM浓度从A组的51%~60%逐渐降到C组的10%~28%,而D组中OM浓度仅为8%,这主要是由于随着填埋年限的增加,有机物逐渐被微生物分解为无机物[1]。随着填埋年限的增加,TN浓度呈明显的下降趋势,而TP浓度在1~3 a较高,3 a后其浓度相对填埋初期稍降低,但整体趋于稳定,变化不明显。

表1 不同点位样品理化性质Table 1 Physical and chemical properties of samples at different points
不同腐殖土样品中重金属的浓度如表2所示。由表2可见,Zn、Cu、Cr、Pb、Cd、As和Hg的最高浓度分别为532.36、298.04、484.11、398.94、0.94、35.64和7.54 mg/kg,均超过GB 15618—2018《土壤环境质量 农用地土壤污染风险管控标准(试行)》中的污染风险筛选值[20]。同时,不同点位垃圾腐殖土中重金属浓度均高于填埋场周边土壤,表明腐殖土受到了一定程度的重金属污染。该污染可能会对个别生物的生长产生一定的毒害作用,不仅直接影响土壤中细菌群落结构,还可能通过食物链富集至人体,危害人类身体健康[21-24]。本研究中重金属浓度分布与填埋年限未呈现明显的相关性,各点位的重金属浓度之间存在较大差异,这可能与城市生活垃圾较为混杂有关。

表2 不同点位样品重金属浓度Table 2 Heavy metal concentrations of samples at different points mg/kg
2.2 细菌群落α多样性分析
利用α多样性指数来反映垃圾腐殖土样品中细菌群落的丰富度和多样性,结果如表3所示。由表3可见,所有样品覆盖度指数均大于98%,说明每个样本序列检测的概率足够高,测序结果能够反映样本中微生物的真实情况。一般使用ACE和Chao指数估计样本中OTU数,这2个指标的数值越高,表明其含有的物种总数越高,细菌群落丰富度越高[25]。随着填埋年限增加,细菌群落丰富度呈现轻微上升的趋势,其中丰富度最高的为D1点位,即填埋场周边的土壤,丰富度最低的为B1点位,填埋年限为3~6 a。通常利用Shannon和Simpson指数描述细菌群落多样性,Shannon指数越高,Simpson指数越低,表明细菌群落的多样性越高。不同填埋年限的垃圾腐殖土中,细菌群落多样性差异不明显,但均低于填埋场周边的D1点位。α多样性指数表明,与填埋场周边土壤相比,填埋场中腐殖土细菌群落的多样性和丰富度均有不同程度下降,这表明填埋的垃圾可能对细菌群落有一定的负面影响,导致细菌种类减少。另外,细菌群落多样性指数随着填埋年限增加有所上升,这可能是由于填埋过程中,大量有机物被降解,为微生物的生长发育提供了营养源,使细菌种类不断增加[26]。

表3 不同点位样品中细菌群落多样性和丰富度指数Table 3 Bacterial community diversity and richness index of samples at different points
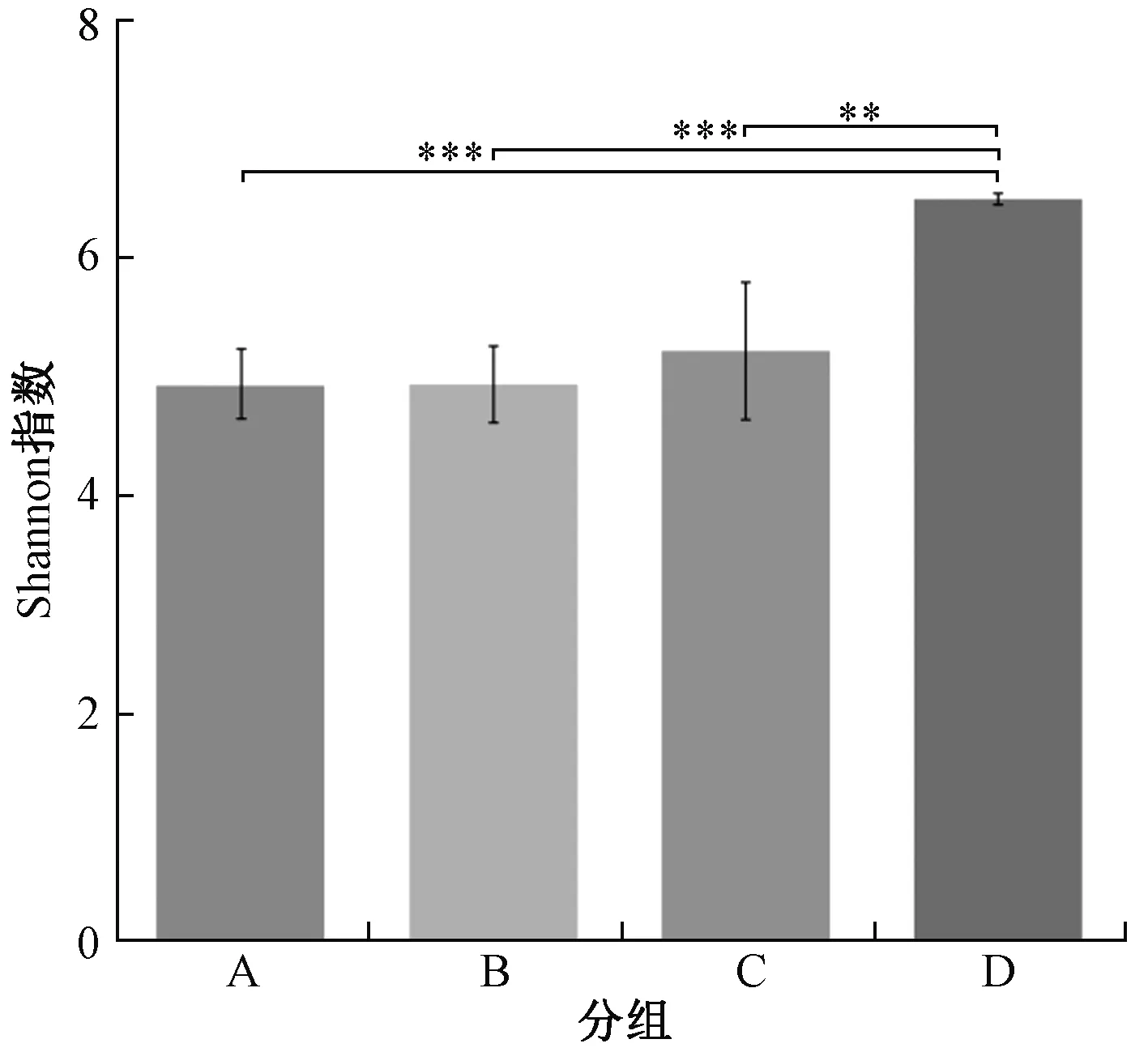
注:** 表示P< 0.01,*** 表示P< 0.001。图2 不同填埋龄腐殖土的α多样性组间差异Fig.2 Difference of α diversity among groups of humus soils at different ages of landfill
A、B、C、D各组样品α多样性组间差异性分析如图2所示。由图2可知,填埋场周边的土壤与填埋年限为6~10 a的腐殖土之间细菌群落的α多样性差异性较为显著(P<0.01),与填埋年限为1~3和3~6 a的腐殖土之间差异性极为显著(P<0.001)。不同填埋年限之间未呈现显著差异(P>0.05),这可能是因为在填埋过程中细菌群落组成不断发生改变,而部分细菌从填埋初期就一直存在于腐殖土中,并没有随填埋年限增加发生改变[27]。
Venn图可以显示不同填埋年限下垃圾腐殖土中特有和共有的OTU数差异(图3)。由图3(a)可见,A、B、C、D组的OTU数依次为 2 199、2 106、3 205 和 2 480,其中D组的特有性物种数目最大,OTU数高达 1 215;C组次之,特有OTU数为936;A组和B组特有OTU数分别为506和452。A、B组共有的OTU数为 1 171(27.2%),B、C组共有的OTU数为 1 211(21.1%),C、D组共有的OTU数为 1 136(20.0%)。从图3(b)可以看出9个点位的共有OTU数为77,D1点位的特有OTU数(1 215)最大,B2点位的特有OTU数(18)最小。上述结果表明:不同填埋年限的垃圾腐殖土中OTU数不同,且随着填埋年限的增长,会出现一些新的细菌种群,而部分细菌则参与了垃圾降解的整个过程,腐殖土中细菌群落的组成随着垃圾的降解而不断变化[1]。另外,在没有垃圾堆存的D1点位中细菌的种类较多,这与α多样性分析结论相一致。

图3 不同填埋龄和不同点位样品的细菌群落Venn图Fig.3 Venn plots of bacterial communities in samples of different landfill ages and different sites
2.3 门水平的细菌群落结构
填埋场内不同填埋年限腐殖土及周边土壤中细菌群落结构在门水平上的分布如图4所示。厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidota)是主要的优势菌门,在腐殖土中相对丰度为75%~97%,在填埋场周边的土壤中相对丰度为70%。在整个填埋过程中,放线菌门和变形菌门的比例无明显变化,其相对丰度分别维持在20%和10%左右。厚壁菌门变化较为明显,填埋初期其相对丰度较低(3%~11%),填埋中期相对丰度突增(37%~70%),填埋后期又开始下降(7%~29%)。绿弯菌门的变化趋势与厚壁菌门恰好相反,在填埋初期相对丰度为14%~20%,填埋中期降至1%左右,填埋后期,其相对丰度又升到了22%~32%。对于拟杆菌门,在填埋初期和填埋中期,其相对丰度为5%~21%,在填埋后期相对丰度出现了下降,仅为2%左右。D1点位中厚壁菌门相对丰度较低(0.6%),酸杆菌门(Acidobacteria)相对丰度为14%,其余菌门分布与填埋后期较为相似。

图4 不同点位的细菌在门水平上的相对丰度Fig.4 Relative abundance of bacteria at different points at the phylum level
相关研究表明,厚壁菌门、变形菌门、拟杆菌门是垃圾中的优势菌门,也是渗滤液中的优势菌门[28-29]。这3种菌群都具有较强的分解能力,其中厚壁菌门和拟杆菌门可以分解纤维素和淀粉,而变形菌门可以将可溶性糖降解为单糖和短链脂肪酸[30]。在本研究中,填埋年限为3~6 a的腐殖土中,厚壁菌门的相对丰度最高,可能在这个阶段厚壁菌门新陈代谢较为迅速,在填埋后期纤维素等糖类物质浓度相对较少,使得其相对丰度减小。同时,拟杆菌门也表现出相对丰度逐渐减小的变化特征。绿弯菌门广泛分布于生物圈各种生境中,形态多样,营养方式和代谢途径十分丰富,能够参与C、N、S等一系列生物地球化学循环过程[31]。填埋年限为1~3和3~6 a的腐殖土中TN浓度呈逐渐下降趋势,这可能是由于绿弯菌门参与了N元素的循环过程。在填埋年限为6~10 a的腐殖土中绿弯菌门相对丰度增大,可能由于腐殖土中其他营养物质刺激了绿弯菌门的生长,而关于其中机制仍然不明晰。
2.4 β多样性分析
基于样品中细菌门水平的相对丰度,对不同填埋年限的腐殖土以及填埋场周边土壤中的微生物进行非度量多维尺度(NMDS)分析(图5)。由图5可见,A、B和C 3组明显互相分离,表明不同填埋年限下腐殖土中的细菌群落结构差异性较大。D组与A组、B组的位置相隔较远,与C组较为聚集,说明填埋场周边土壤中细菌群落结构与填埋年限1~3和3~6 a的腐殖土中差异较大,而与填埋年限6~10 a的腐殖土中较为接近。从各点位门水平细菌相对丰度可知,D1点位与C1、C2、C3点位较为相似,其中C3点位的理化性质和重金属浓度与D1点位差异较小,可能是由于D1点位靠近填埋场的渗滤液处理池,周边土壤一定程度上受到了渗滤液的污染,因此,在填埋年限较长的腐殖土中,细菌群落结构表现出与周边土壤相同的特征。另外,各组之间的点位离散程度较小,即各阶段中,细菌群落结构较为相似。

图5 不同填埋龄细菌群落的非度量多维尺度分析Fig.5 Non-metric multidimensional scale analysis of bacterial communities at landfills of different ages
2.5 环境因子对细菌群落的影响
对表1和表2中的环境因子进行去趋势对应分析(DCA),结果显示排序轴梯度长度最大值为2.008,小于3.5,故选用线性模型较为合适。由于环境因子之间可能具有较强的多重共线性(相关)关系[32],采用VIF方差膨胀因子分析,经过筛选去除了Cr、TP和OM指标,综合剩下的环境因子在门水平对细菌群落进行RDA分析〔图6(a)〕。由图6(a)可见,前2个轴总共解释了70.02%的群落变化,第一个轴解释了59.42%,第二个轴解释了10.60%。结果表明,填埋年限为1~3 a的腐殖土中细菌群落结构主要受TN的影响,3~6 a的腐殖土主要受Cd、Zn和pH的影响,而6~10 a的腐殖土以及填埋场周边土壤受Pb的影响较大。另外,C组和D组的样本相互聚集,分布在原点附近,表明它们之间有较强的相关性,门水平的细菌群落组成以及NMDS分析也印证了这个结论。
国内外大量研究表明,土壤的理化性质和其中重金属的浓度对微生物的群落组成具有显著的影响[33-35]。pH作为垃圾降解程度的相关指标,是影响细菌群落结构的重要驱动因素[36]。氮是微生物生长所需的重要元素之一,其浓度能够显著影响微生物的群落组成[37]。另外,重金属还能够影响微生物的α多样性,对细菌的组成影响尤为严重[38]。当环境中重金属浓度较低时,大部分细菌无反应或反应较弱;重金属浓度较高时,为了应对生存威胁,细菌中可能会出现重金属抗性基因(heavy metal resistance gene,MRGs),此时部分细菌会在重金属的胁迫下死亡,而具有MRGs的细菌能进行大量的繁殖,促使细菌群落结构发生一定的变化[39]。在本研究中,Zn、Cd、TN和pH与细菌的群落结构存在极显著相关性(P<0.01),而腐殖土中Cu的浓度虽然较高,但对于细菌的影响相对较小。
结合重金属(Zn、Cu、Pb、Cd、As、Hg)浓度以及腐殖土理化性质(pH和TN),对细菌群落进行了方差分解(VPA)分析〔图6(b)〕。由图6(b)可见,重金属部分单独解释贡献度占比为36%,理化性质部分单独解释贡献度占比为13%,共同解释贡献度占比为25%,未被这2种环境因子解释到的残差为26%,说明本研究中重金属对细菌群落结构组成的影响能力较强。后续研究可以对细菌中的MRGs进行检测,从而进一步了解重金属对细菌群落结构的影响机制。

图6 门水平上细菌群落与环境因子的RDA分析和VPA分析Fig.6 RDA analysis and VPA analysis of bacterial community and environmental factors at phylum level
3 结论
(1)垃圾腐殖土中有机质和TN浓度随填埋年限的增长不断下降,而TP浓度变化不明显。pH呈微弱的降低趋势,填埋初期为弱碱性,填埋后期降至中性。腐殖土受重金属污染较为严重,其中Zn的浓度最高可达532.36 mg/kg,但重金属的浓度与填埋年限未呈现明显相关性。
(2)腐殖土中细菌群落的丰富度和多样性随填埋年限的增长逐渐增加,其中厚壁菌门、变形菌门、放线菌门、绿弯菌门和拟杆菌门为优势菌门,在整个填埋过程中相对丰度为74.7%~97.0%。不同填埋年限的腐殖土中细菌群落结构差异性较大,但填埋场周边土壤中细菌群落分布与填埋年限为6~10 a的腐殖土较为类似,这可能与垃圾渗滤液对周围土壤的污染有关。
(3)RDA分析表明,Zn、Cd、TN和pH与细菌的群落结构存在极显著相关性(P<0.01),VPA分析结果显示,相对于理化性质,重金属对细菌群落结构组成的影响能力较强。
