姜黄素衍生物通过Notch1/Hes1信号通路抑制RSV感染后人肺上皮细胞MUC5AC分泌的研究
2021-09-19叶文静翁婷婷王乐颖李海燕陈小芳董琳
叶文静 翁婷婷 王乐颖 李海燕 陈小芳 董琳
呼吸道合胞病毒(respiratory syncytial virus,RSV)是婴幼儿急性下呼吸道感染的主要病原体[1]。RSV感染后气道上皮细胞黏蛋白5AC(mucin-5AC,MUC5AC)水平升高,引发气道黏液过度分泌进而导致气道阻塞[2]。研究发现,RSV感染后气道上皮细胞高表达的IL-25可促进IL-5、IL-13等细胞因子的分泌导致黏液过度分泌[3]。RSV可通过活化Notch1信号通路加重气道炎症[4],而Notch通路特异性拮抗剂——γ分泌酶抑制剂(γ secretaseinhibitor,DAPT)能下调肥胖哮喘小鼠MUC5AC的高表达[5]。发状分裂相关增强子1(hairy enhancer of split 1,Hes1)是Notch1信号通路常见的靶基因,Notch1/Hes1信号通路能激活RSV感染后Th2型免疫反应[4],但对IL-25的调控作用尚未见报道。姜黄素具有抑制体内气道上皮细胞MUC5AC水平升高的作用[6-7],并可下调Notch1通路改善气道炎症[8],但其对气道黏液高分泌的调控效应及具体机制尚不清楚。单羰基姜黄素衍生物B6的生物利用度较天然姜黄素明显提高[9],对于脂多糖诱导的肺部炎症有良好的抑制作用[10]。本研究通过检测 RSV感染及 B6、DAPT、地塞米松(dexamethasone,DXM)干预后人肺上皮细胞 Notch1、Hes1、MUC5AC mRNA和蛋白表达及IL-25蛋白水平变化,探讨RSV感染气道黏液高分泌的调控机制及姜黄素衍生物的干预效应,以期为临床应用姜黄素衍生物治疗RSV感染提供参考。
1 材料和方法
1.1 主要实验材料 人喉癌细胞Hep-2细胞株和人肺上皮细胞BEAS-2b细胞株均采购于美国模式菌种收集中心;RSV国际标准株Long株来自北京市儿科研究所感染与病毒研究室;均保存于-80℃冰箱中。B6(温州医科大学药学院惠赠)、DAPT(上海蓝木化工有限公司,规格:10 mmol/L,批号:06)及 DXM(北京索莱宝科技公司,规格:100 mg,批号:530D056)均溶于二甲基亚砜溶液中(北京索莱宝科技公司,规格:100 ml,批号:1213C0226),分别配成 0.1 mmol/L、0.1 mmol/L 及 10 mg/ml的母液,使用时用培养液稀释成造模所需的浓度。
1.2 实验方法
1.2.1 BEAS-2b和Hep-2细胞培养 将细胞接种于培养瓶中,用DMEM培养基配制的培养液培养,置于5%CO2、饱和湿度、37℃的恒温培养箱中生长,待细胞长满至90%左右时,用0.25%胰蛋白酶消化传代;隔天换液1次,待80%~90%的细胞融合时进行下一步操作。
1.2.2 RSV增殖培养 将冻存的RSV Long株复苏,接种于长满至80%左右Hep-2细胞上,病毒培养箱培养吸附2 h后再加入DMEM配制的维持液,继续培养,观察细胞病变情况,待出现75%以上细胞融合病变(约需2~3 d),再将培养瓶置-20℃冰箱冻存2 h以上,37℃水浴箱融化,反复3次,再5 000 r/min离心15 min,弃沉淀,收集病毒上清液,每管1 ml分装,置-80℃冰箱保存待用。
1.2.3 RSV滴度测定 将Hep-2细胞以1×105/ml的浓度每孔100 μl接种于96孔培养板上。用维持液按10倍稀释法稀释病毒原液,稀释成10-1~10-9。待细胞长满,PBS洗3遍,再接种上述浓度的病毒液,每个浓度重复8孔,同时设细胞对照组。置于病毒培育箱中吸附2 h,再加维持液继续培养。观察细胞病变效应(cytopathic effect,CPE)的情况并记录,用Reed-Muench公式计算病毒的半数感染量(50%tissue culture infectious doses,TCID50)。病毒攻击量为100 TCID50。TCID50=CPE>50%病毒稀释度lg10(CPE的记录方法为:无CPE记为“-”;≤25%细胞出现病变记为“+”;>25%~50%细胞病变记为“++”;>50%~75%细胞病变记为“+++”;>75%~100%的细胞病变记为“++++”)。
1.2.4 药物细胞毒性测定 按CCK-8试剂盒说明书,将BEAS-2b细胞接种于96孔板中。利用细胞培养液稀释 B6、DAPT、DXM、DMSO,分别配制成 10~50 μmol/L B6,10~50 μmol/L DAPT,0.01 ~0.05 mg/ml DXM、0.1%DMSO。待细胞生长至80% ,每孔加入100 μl配制好的不同浓度的药物,每种药物的每个浓度处理孔、正常细胞对照孔及空白孔均设6个复孔,置培养箱中分别培育12、24 h后,PBS洗板3次,每孔重新加入新鲜的培养液,再向每孔加入10 μl的CCK-8试剂,置培养箱中孵育30min~3 h。多功能酶标仪测定450 nm处的吸光度(A),并记录。细胞存活率=(药物孔A450-空白孔A450)/(细胞对照孔A450-空白孔A450)×100%。
1.2.5 实验分组 于6孔板中接种已传代培养的BEAS-2b,随机分成以下6组:B6组、DAPT+B6组、DAPT组、DXM组、RSV组和细胞对照组。B6组在RSV感染造模0.5 h前予10 μmol/L B6预处理,DAPT+B6组在B6预处理前先以20 μmol/L DAPT预处理1 h。造模开始前1 h,DXM 组加入 0.01 mg/ml DXM。B6组、DAPT+B6组、DAPT组、DXM组以及RSV组以100倍TCID50浓度的RSV进行感染吸附BEAS-2b 2 h,再加维持液继续培养12、24 h取细胞及上清液进行检测。
1.2.6 RT-PCR检测 Notch1、Hes1和 MUC5AC mRNA表达 以Trizol法提取培养细胞的总RNA,逆转录合成cDNA。引物序列:人Notch1上游引物:5'-GCTGGACTGTGCGGAGCATGTA-3',下游引物:5'-GGAAGATCATCTGCTGGCCGTG-3'; 人 Hes1上 游 引 物 :5'-GAGAGGCGGCTAAGGTGTTT-3',下游引物:5'-GTGTAGACGGGGATGACAGG-3';人MUC5AC上游引物:5'-GGCCATA CACGGGCACAATCT-3',下游引物:5'-CATCACCTTCGACGGCACCTA-3';人GAPDH上游引物:5'-GGAGAAGGCTGGGGCTCAT-3',下游引物:5'-TGGGTGGCAGTGATGGCA-3'。参照试剂盒配置RTPCR反应体系,将上述配好的体系加入8连管中,每组3个复孔,置于荧光定量PCR仪内;预变性95℃2 min→变性95℃10 s→退火60℃40 s(循环40次);PCR扩增结束后,保存数据,建立产物的熔解曲线并进一步分析。
1.2.7 Western blot检测Notch1、Hes1和MUC5AC蛋白表达 各组细胞培养至约80%时用预冷的PBS漂洗,再加入RIPA裂解液,冰上提取蛋白质。用BCA法测定蛋白浓度,配置上样样品。每孔20 μl上样,10%SDSPAGE电泳,转膜,5%脱脂牛奶中封闭2 h,1∶1 000第一抗体4℃摇床孵育过夜;第二抗体常温孵育2 h,加ECL发光试剂,曝光机显影分析。
1.2.8 ELISA检测IL-25蛋白水平 收集造模后的细胞上清液于无菌EP管内,根据ELISA试剂盒说明书进行操作,于酶标仪450 nm测定各孔吸光度,并用软件计算蛋白水平。
1.3 统计学处理 采用SPSS 22.0统计软件。计量资料以表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 RSV滴度测定 本实验RSV的TCID50为10-4.8/50 μl,病毒攻击量为 100 TCID50,即 10-2.8/50 μl。
2.2 B6、DAPT、DXM及0.1%DMSO的细胞毒性 10μmol/L B6、20 μmol/L DAPT、0.01 mg/ml DXM 和 0.1%DMSO处理后12、24 h两个时间点BEAS-2b细胞存活率分别98.01% 、97.78% ;98.57% 、98.22% ;98.61% 、98.30% 和99.20%、98.79%,与细胞对照组相比差异均无统计学意义(均P>0.05),表明上述浓度的药物对BEAS-2b细胞无明显毒性反应。
2.3 各组细胞Notch1 mRNA及蛋白表达水平比较 细胞对照组Notch1 mRNA和蛋白表达水平最低,与细胞对照组相比,B6组、DAPT+B6组、DAPT组以及RSV组Notch1 mRNA及蛋白表达水平在RSV感染后12、24 h两个时间点均显著升高(均P<0.05);与RSV组相比,两个时间点其他组Notch1 mRNA及蛋白表达水平均有所降低(均P<0.05),以DXM组表达水平最低;而B6组、DAPT+B6组以及DAPT组同一时间点表达水平相近,差异均无统计学意义(均P>0.05),见图1、2。
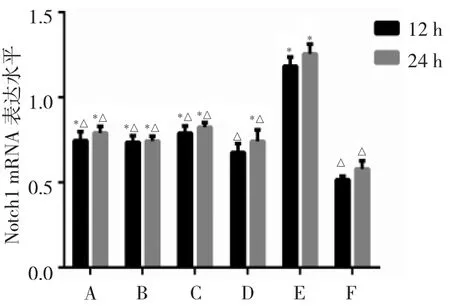
图1 各组细胞呼吸道合胞病毒(RSV)感染后12、24 h Notch1 mRNA表达水平比较(A:B6组;B:DAPT+B6组;C:DAPT组;D:DXM 组;E:RSV 组;F:细胞对照组;与F组比较,*P<0.05;与 E 组比较,△P<0.05;n=3)
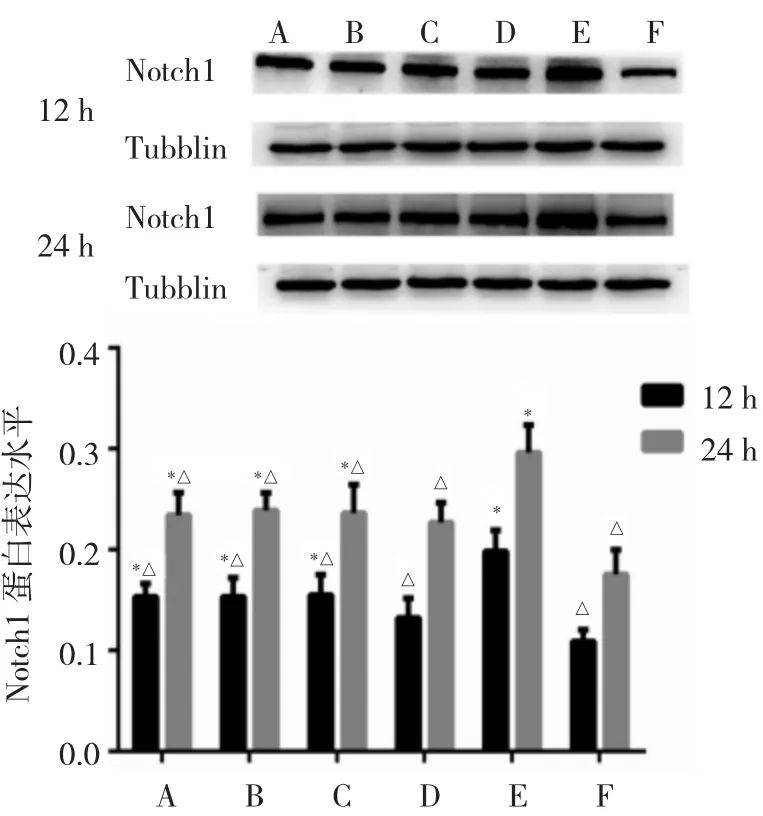
图2 各组细胞呼吸道合胞病毒(RSV)感染后12、24 h Notch1蛋白表达水平比较(A:B6组;B:DAPT+B6组;C:DAPT组;D:DXM组;E:RSV组;F:细胞对照组;与 F 组比较,*P<0.05;与E组比较,△P<0.05;n=3)
2.4 各组细胞Hes1 mRNA及蛋白表达水平比较 细胞对照组Hes1 mRNA和蛋白表达水平最低,与细胞对照组相比,B6组、DAPT+B6组、DAPT组以及RSV组Hes1 mRNA和蛋白表达水平在RSV感染后12、24 h两个时间点均显著升高(均P<0.05);与RSV组相比,两个时间点其他组Hes1 mRNA和蛋白表达水平均降低(均P<0.05),以DXM组表达水平最低;而B6组、DAPT+B6组以及DAPT组同一时间点表达水平相近,差异均无统计学意义(均P>0.05),见图3、4。
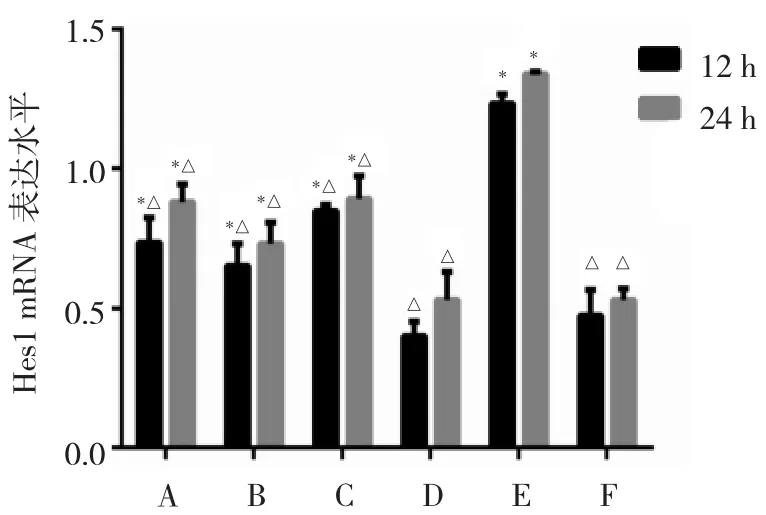
图3 各组细胞呼吸道合胞病毒(RSV)感染后12、24 h发状分裂相关增强子 1(Hes1)mRNA 表达水平比较(A:B6组;B:DAPT+B6组;C:DAPT组;D:DXM 组;E:RSV 组;F:细胞对照组;与 F 组比较,*P<0.05;与 E 组比较,△P<0.05;n=3)
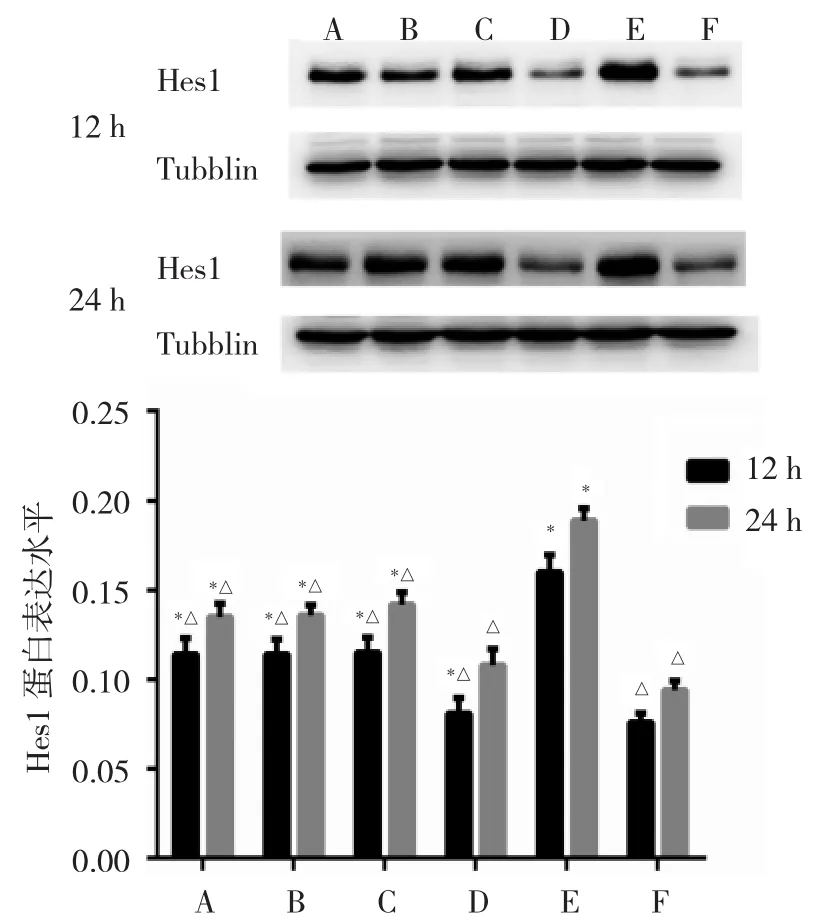
图4 各组细胞呼吸道合胞病毒(RSV)感染后12、24 h发状分裂相关增强子 1(Hes1)蛋白表达水平比较(A:B6组;B:DAPT+B6组;C:DAPT 组;D:DXM 组;E:RSV 组;F:细胞对照组;与 F 组比较,*P<0.05;与 E 组比较,△P<0.05;n=3)
2.5 各组细胞MUC5AC mRNA及蛋白表达水平比较细胞对照组MUC5AC mRNA和蛋白表达水平最低,与细胞对照组相比,B6组、DAPT+B6组、DAPT组以及RSV组MUC5AC mRNA和蛋白表达水平在RSV感染后12、24 h两个时间点均显著升高(均P<0.05),24 h升高更明显。与RSV组相比,两个时间点其他组MUC5AC mRNA和蛋白表达水平均降低(均P<0.05),以DXM组表达水平最低;而B6组、DAPT+B6组以及DAPT组同一时间点表达水平相近,差异均无统计学意义(均P>0.05),见图 5、6。
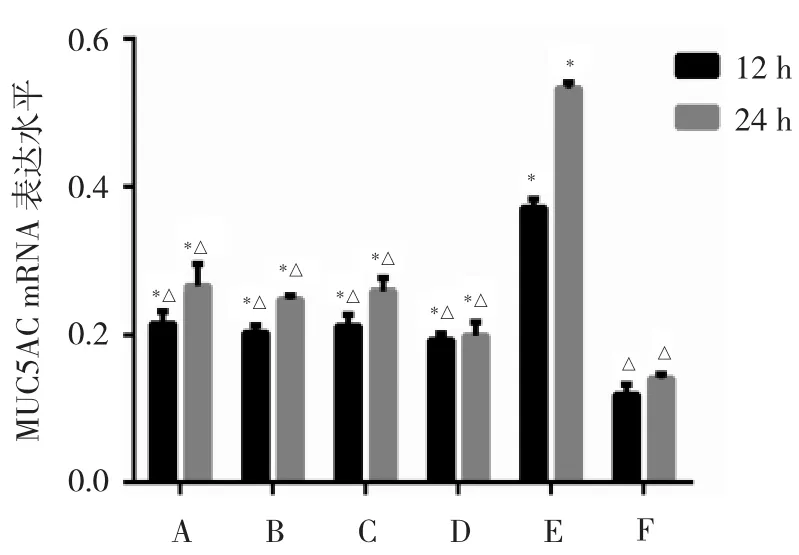
图5 各组细胞呼吸道合胞病毒(RSV)感染后12、24 h黏蛋白5AC(MUC5AC)mRNA 表达水平比较(A:B6组;B:DAPT+B6组;C:DAPT组;D:DXM组;E:RSV 组;F:细胞对照组;与 F 组比较,*P<0.05;与 E 组比较,△P<0.05;n=3)
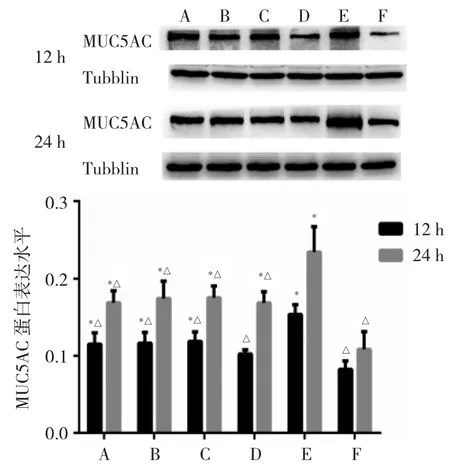
图6 各组细胞呼吸道合胞病毒(RSV)感染后12、24 h黏蛋白5AC(MUC5AC)蛋白表达水平比较(A:B6组;B:DAPT+B6组;C:DAPT 组;D:DXM 组;E:RSV 组;F:细胞对照组;与 F 组比较,*P<0.05;与 E 组比较,△P<0.05;n=3)
2.6 各组细胞IL-25蛋白水平比较 细胞对照组IL-25水平最低,与细胞对照组相比,其他组IL-25水平明显增高(P<0.05)。与RSV组相比,感染RSV后12、24 h两个时间点B6组、DAPT+B6组、DAPT组以及DXM组IL-25水平均明显降低(均P<0.05),其中DXM组蛋白水平最低;而B6组、DAPT+B6组以及DAPT组同一时间点水平相近,差异无统计学意义(P>0.05),见表1。
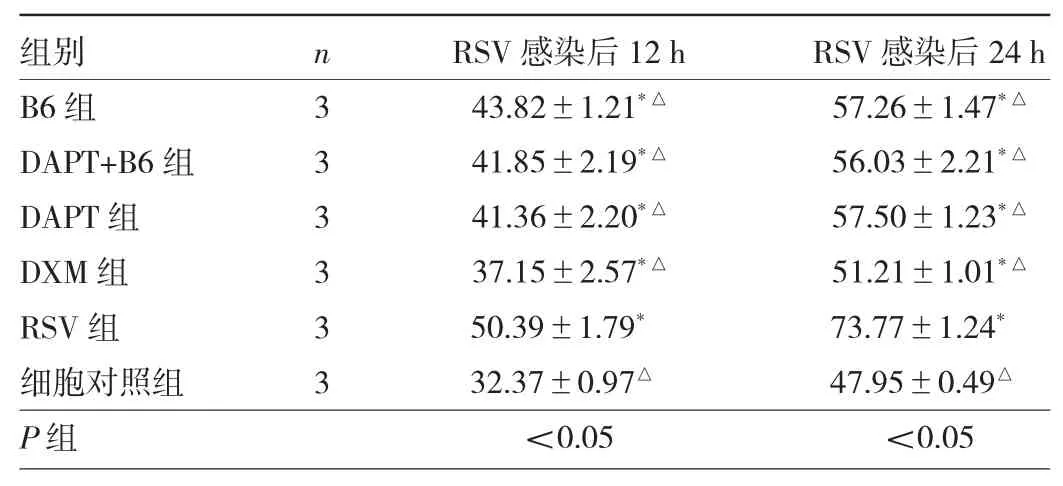
表1 各组细胞RSV感染后12、24 h IL-25蛋白水平比较
3 讨论
体内外研究已证实RSV感染后会导致气道黏液高分泌,MUC5AC表达明显增加[2]。本实验结果与以上结论相一致,RSV感染BEAS-2b细胞后,MUC5AC mRNA及蛋白表达水平均显著增加,与感染后12 h相比,24 h表达水平增加更明显,具有时间依赖性。Notch1信号通路可能在气道黏液高分泌的调控中发挥重要作用,但存在复杂的作用机制且正负效应尚未明确[11-12]。已有研究发现,RSV感染支气管上皮细胞可以活化Notch1信号通路,进而促进气道微环境中Th2淋巴细胞的分化[4]。故本研究选择Notch1/Hes1信号通路,探讨其在RSV感染MUC5AC高表达中的作用。
本研究结果显示,RSV感染BEAS-2b 12、24 h后,Notch1、Hes1的表达水平明显升高,支持RSV感染可激活Notch1信号传导通路这一推测。但与感染后12 h相比,感染后24 h Notch1、Hes1表达上调作用未见明显增加,提示需延长作用时间以进一步明确其时间依赖性。结果进一步显示RSV感染后IL-25的表达增加,趋势与Notch1、Hes1相平行。RSV感染后,DAPT干预组的Notch1、Hes1及IL-25表达明显减少,表明抑制Notch1/Hes1信号通路能下调IL-25的释放,提示Notch1信号通路参与调控RSV感染后IL-25的高表达。同时,DAPT干预组MUC5AC mRNA表达及蛋白水平均较病毒对照组明显下降,提示DAPT可以抑制RSV感染后MUC5AC的高表达。上述结果表明,抑制Notch1/Hes1信号传导通路介导的IL-25释放可以下调MUC5AC表达。
Yang等[13]研究发现姜黄素可以抑制Notch1/Hes1信号通路进而减轻内皮细胞氧化应激损伤。本研究中,与RSV感染组相比,姜黄素衍生物B6干预组Notch1、Hes1表达水平明显降低,提示B6对RSV感染后Notch1/Hes1信号通路的活化具有抑制作用。同时,B6干预组的MUC5AC mRNA及蛋白表达水平和IL-25蛋白水平明显降低,提示B6可通过下调MUC5AC及IL-25表达从而抑制RSV感染导致的气道黏液高分泌,与文献报道一致[7,14]。B6与DAPT作用类似,但DAPT预处理后再加B6干预组的上述指标表达水平下降与B6或DAPT单独干预组相比无统计学差异,提示预处理的DAPT可能拮抗了B6的作用,B6的作用机制可能与DAPT相同。DXM具有强大的抗炎功能,能抑制血管内皮生长因子诱导的支气管上皮细胞MUC5AC的高表达[15]。本实验以DXM作为阳性对照,结果发现DXM干预组Notch1、Hes1、MUC5AC及IL-25蛋白表达均明显下降,其中对Hes1表达的抑制效应最为明显,此与Revollo等[16]报道的糖皮质激素能迅速而稳定地沉默Hes1的研究结论相一致。与DXM干预组相比,B6干预组上述指标表达水平下降不明显,提示B6的抑制效应弱于DXM。
综上所述,RSV感染可激活Notch1/Hes1信号通路,进而通过上调IL-25的释放参与调控气道黏液高分泌,而姜黄素衍生物对此具有抑制效应。本研究为姜黄素衍生物应用于RSV感染的治疗提供实验依据,深化了对姜黄素衍生物抗炎及免疫调节机制的认识。
