耐辐射奇球菌R1对大鼠的慢性毒性实验
2021-09-18李建瑛是文辉刘晓禄刘爱中宋来阳刘江伟
许 琴,王 玮,董 翔,李建瑛,是文辉,刘晓禄,刘爱中,马 娜,宋来阳,刘江伟
(1.新疆军区总医院,新疆特殊环境医学重点实验室,乌鲁木齐830000;2.新疆农业科学院微生物应用研究所,新疆特殊环境微生物重点实验室,乌鲁木齐830091;3.新疆农业大学科学技术学院,乌鲁木齐830091)
耐辐射菌于1956年由美国科学家Anderson发现,该菌在5~15 kGy的γ射线照射下仍能存活(一般细菌在2~5 kGy的γ射线照射下即可完全灭活),将其命名为Micrococcusradiodurans[1]。后经研究发现,该菌的生长特性、生理生化特征及16 SrRNA明显异于普通的微球菌,因此将其更名为耐辐射奇球菌(Deinococcus radiodurans,DR),在分类学上属于异常球菌纲(Deinococci)异常球菌目(Deinococcales)异常球菌科(Deinococcaceae)异常球菌属(Deinococcus)[2]。该菌株革兰染色呈阳性,严格好氧生长,不形成芽孢,无致病性,电子显微镜下观察表明该菌常以四聚体存在,生长需要丰富的氨基酸、糖类和维生素B(或其类似物),在TGY培养基(含0.5%胰蛋白胨、0.1%葡萄糖和0.3%酵母提取物)上形成红色菌落。目前,DR已作为异常球菌属的代表菌株被广泛研究[3-4]。DR不但可以耐受15 kGy急性电离辐射和0.06 Gy/h慢性照射,并具有很强的抗干燥能力[5]。指数生长期的DR对电离辐射、紫外线的抗性分别是大肠埃希菌的200倍和20倍,经受20 kGy射线的电离辐射后,DR是测试中唯一存活的微生物[6]。研究表明,电离辐射辐照DR后,存活率和剂量关系为一个肩形曲线,在某一剂量点以前,存活率几乎为100%,充分表明了其极强的辐射抗性[7]。据此推测,DR在生命科学研究中可能有广阔的应用前景。近年来,科研人员对该菌在重金属及核污染环境修复、基因修复等方面研究较多,而动物实验及药理学研究相对较少。现有文献未见DR活菌及其菌体破碎物相关的急性和慢性毒性实验报告。因此,本实验以DR的标准菌株R1为研究对象,探讨该菌对大鼠的慢性毒性,以期为DR作为肠道益生菌的推广应用提供实验依据。
1 材料与方法
1.1 实验动物及主要试剂仪器
SPF级SD大鼠80只,雌雄各半,体质量180~220 g,购自新疆维吾尔自治区疾病预防控制中心[SCXK(新)2016-0001],饲养于屏障设施[SYXK(军)2017-0050]。动物实验经新疆军区总医院实验动物福利伦理审查委员会批准[DWLL20190729]。DR标准菌株耐辐射奇球菌R1(Deinococcus radioduransR1,DRR1)由新疆农业科学院应用微生物研究所提供,DRR1菌株的复壮及培养均在该单位的特殊环境微生物重点实验室内完成。全自动生化分析仪(BS-180)、全自动电解质分析仪(IMS-972)和全自动血细胞分析仪(BC-2800vet)均购自中国深圳迈瑞公司;台式低速离心机(TDZ5)购自湖南赫西仪器装备有限公司;超声破碎仪(SK3310LHC)购自上海科导超声仪器有限公司。
1.2 DRR1浓度确定及其细菌破碎物的制备
DRR1菌培养至对数生长期,测定其吸光度值;吸光度值达到1.9~2.0,细菌增殖基本停止,根据其生长曲线,此时的DRR1菌液浓度为109/mL,即为高浓度活菌菌液。高浓度DRR1菌液用TGY琼脂培养液(含0.5%胰蛋白胨、0.1%葡萄糖和0.3%酵母提取物)稀释至107/mL,作为低浓度活菌菌液。分别将高、低浓度的活菌液于-80℃冰箱及超声破碎仪中(37℃,50 kHz,30 min)反复冻融和超声破碎5~7次,得到高、低浓度的DRR1菌体破碎物。新疆特殊环境微生物重点实验室每次为本实验提供5 d用量的新鲜高浓度DRR1菌液,共6批次。每批次菌液经上述处理后得到4组受试样品,按日需求量进行无菌分装及标记,然后置于4℃医用冰箱内保存,每日按需进行灌胃给药。
1.3 实验分组及给药
80只大鼠随机分为5组,DRR1高浓度(109/mL)组(简称LDRH组)、DRR1低浓度(107/mL)组(简称LDRL组)、DRR1破碎物高浓度(109/mL)组(简称BDRH组)、DRR1破碎物低浓度(107/mL)组(简称BDRL组)和对照组(即TGY组),每组16只,雌雄各半。各组动物按1 mL/100 g体质量灌胃给药,每日1次,连续给药30 d,末次给药后2 h,称重。每组随机取8只大鼠,以0.15 mL/100 g体质量腹腔注射3%戊巴比妥钠溶液,深度麻醉大鼠,留取抗凝静脉血及生化检测静脉血,进行血常规、血清电解质及血清生化指标检测,并留取各主要脏器,称质量,计算脏器系数。心脏、肝脏、肾和肺组织经体积分数10%的中性甲醛溶液固定,HE染色,光学显微镜下观察其病理改变。剩余8只大鼠停止给药后正常饲养2周(恢复期),按上述方法留取标本,同法检测。
1.4 观测指标
给药期间及恢复期每日观察记录大鼠毛色、活动、精神状态、进食饮水、大便等一般情况。定时记录大鼠日采食量,并记录灌胃后1 d、7 d、14 d、21 d、28 d、37 d和44 d的体质量,记录大鼠行为学反应、死亡数量及时间。30 d及45 d后,检测血常规、电解质及血生化指标,测定脏器系数,观察脏器病理学变化,进行毒性作用结果分析。脏器系数计算公式:脏器系数=脏器质量(g)/动物体质量(g)×100%。
1.5 统计学分析
应用SPSS 19.0统计学软件及Sigma-Plot绘图软件对观测数据进行处理分析,计量资料以±s表示。采用单因素方差分析比较组间差异,方差齐时用LSD-t检验进行组间多重比较,方差不齐时用Games-Howell法进行组间比较,以P<0.05认为差异有统计学意义。
2 结果
2.1 DRR1活菌及其破碎物对大鼠体质量和采食量的影响
2.1.1 DRR1给药期间大鼠行为学变化
DRR1活菌及菌体破碎物给药期间,除TGY组因灌胃操作失误给药至肺部,致一只大鼠死亡外,其余各组大鼠均存活,但未观察到运动、呼吸异常,也未观察到反应迟钝、瞳孔改变、眼球凸出、皮肤颜色改变等异常现象,口、耳、鼻和眼角未见异常分泌物,排便及粪便形态也均正常。
2.1.2 DRR1给药期间大鼠体质量变化
给药期及恢复期大鼠体质量增长数据列于表1。给予DRR1活菌或其破碎物后,受试大鼠的体质量增长与TGY组比较,差异均无统计学意义(P>0.05)。
表1 DRR1给药期及恢复期大鼠体质量Table 1 Body weight of rats in period of DRR1 administration and recovery(±s,m/g)
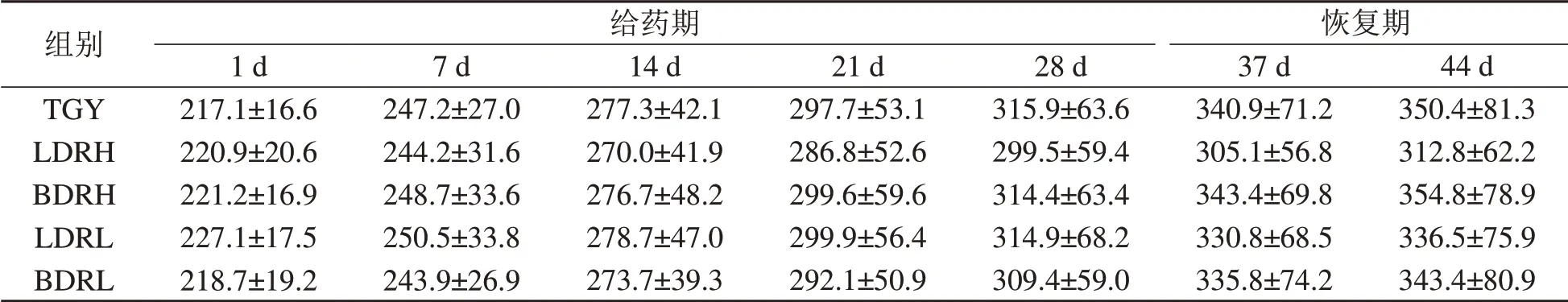
表1 DRR1给药期及恢复期大鼠体质量Table 1 Body weight of rats in period of DRR1 administration and recovery(±s,m/g)
注:LDRH即DRR1高浓度(109/mL)给药组,LDRL即DRR1低浓度(107/mL)组,BDRH即DRR1破碎物高浓度(109/mL)组,BDRL即DRR1破碎物低浓度(107/mL)组,TGY即对照组(用含0.5%胰蛋白胨、0.1%葡萄糖和0.3%酵母提取物的琼脂培养液处理)。恢复期TGY组为7只(因第一周灌胃末期操作意外,死亡1只)。其余各组均8只。
组别TGY LDRH BDRH LDRL BDRL给药期1 d 217.1±16.6 220.9±20.6 221.2±16.9 227.1±17.5 218.7±19.2 7 d 247.2±27.0 244.2±31.6 248.7±33.6 250.5±33.8 243.9±26.9 14 d 277.3±42.1 270.0±41.9 276.7±48.2 278.7±47.0 273.7±39.3 21 d 297.7±53.1 286.8±52.6 299.6±59.6 299.9±56.4 292.1±50.9 28 d 315.9±63.6 299.5±59.4 314.4±63.4 314.9±68.2 309.4±59.0恢复期37 d 340.9±71.2 305.1±56.8 343.4±69.8 330.8±68.5 335.8±74.2 44 d 350.4±81.3 312.8±62.2 354.8±78.9 336.5±75.9 343.4±80.9
2.1.3 DRR1给药期间大鼠摄食量变化
给药期及恢复期,DRR1活菌或其破碎物给药组大鼠日平均摄食量与TGY组无显著差异,(P>0.05,表2)。
表2 DRR1活菌及其破碎物对大鼠日平均摄食量的影响Table 2 Effect of DRR1 live bacteria and its broken products on average daily food intake of rats(±s,m/g)
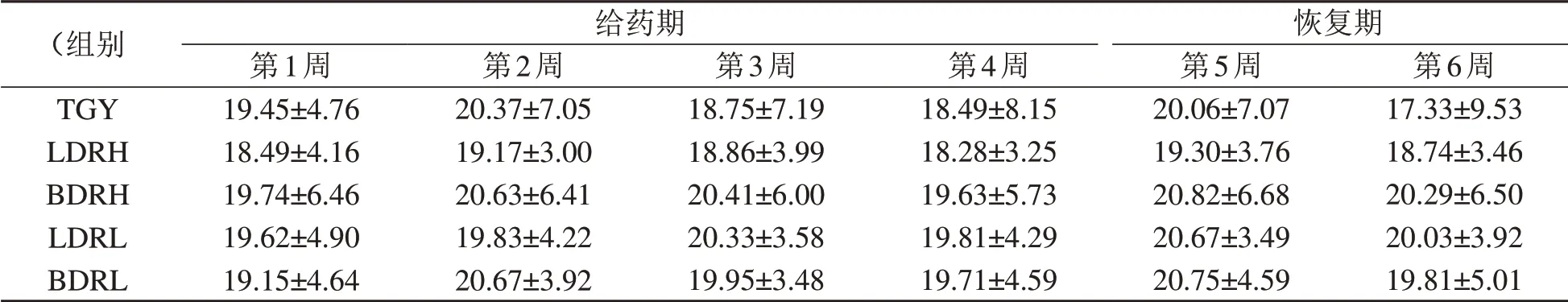
表2 DRR1活菌及其破碎物对大鼠日平均摄食量的影响Table 2 Effect of DRR1 live bacteria and its broken products on average daily food intake of rats(±s,m/g)
注:LDRH即DRR1高浓度(109/mL)给药组,LDRL即DRR1低浓度(107/mL)组,BDRH即DRR1破碎物高浓度(109/mL)组,BDRL即DRR1破碎物低浓度(107/mL)组,TGY即对照组(用含0.5%胰蛋白胨、0.1%葡萄糖和0.3%酵母提取物的琼脂培养液处理)。恢复期TGY组为7只,因第一周灌胃末期操作意外,死亡1只,其余各组均8只。
(组别TGY LDRH BDRH LDRL BDRL给药期第1周19.45±4.76 18.49±4.16 19.74±6.46 19.62±4.90 19.15±4.64第2周20.37±7.05 19.17±3.00 20.63±6.41 19.83±4.22 20.67±3.92第3周18.75±7.19 18.86±3.99 20.41±6.00 20.33±3.58 19.95±3.48第4周18.49±8.15 18.28±3.25 19.63±5.73 19.81±4.29 19.71±4.59恢复期第5周20.06±7.07 19.30±3.76 20.82±6.68 20.67±3.49 20.75±4.59第6周17.33±9.53 18.74±3.46 20.29±6.50 20.03±3.92 19.81±5.01
2.2 DRR1活菌及其破碎物对大鼠血常规的影响
30 d给药结束后,LDRH组大鼠的白细胞数有降低(P<0.05),经14 d停药后,大鼠白细胞数恢复正常;红细胞数、血红蛋白、红细胞压积、平均红细胞体积以及血小板数无显著变化(P>0.05);粒细胞、单核细胞数及其百分比在给药实验周期内无显著变化(P>0.05);各DRR1给药组与TGY组的淋巴细胞数比较,在给药结束即刻以及14 d观察期后,均无显著差异(P>0.05);给药组内,LDRL、BDRL与LDRH、BDRH比较有显著升高(P<0.05)(表3)。
表3 DRR1活菌及其破碎物给药后大鼠血常规Table 3 Blood routinetest of ratsafter administration of DRR1 livebacteria and itsbroken products(±s)
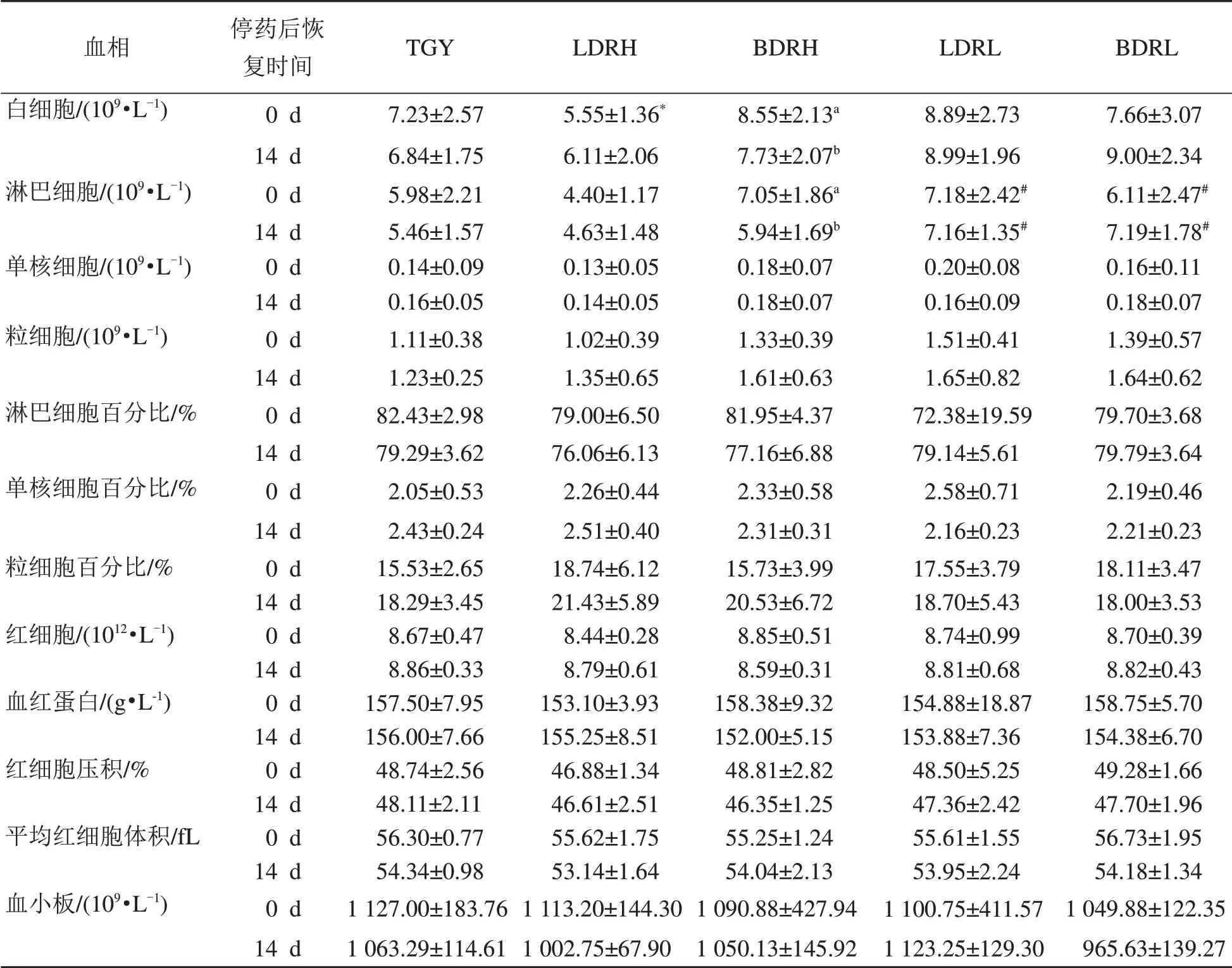
表3 DRR1活菌及其破碎物给药后大鼠血常规Table 3 Blood routinetest of ratsafter administration of DRR1 livebacteria and itsbroken products(±s)
注:LDRH即DRR1高浓度(109/mL)给药组,LDRL即DRR1低浓度(107/mL)组,BDRH即DRR1破碎物高浓度(109/mL)组,BDRL即DRR1破碎物低浓度(107/mL)组,TGY即对照组(用含0.5%胰蛋白胨、0.1%葡萄糖和0.3%酵母提取物的琼脂培养液处理)。与TGY组比较,*P<0.05,**P<0.01;与LDRH组比较,#P<0.05,##P<0.01;同一列肩标不同字母a和b表示两个时间相比P<0.05。恢复期TGY组n=7,其余各组均n=8。
血相白细胞/(109·L-1)淋巴细胞/(109·L-1)单核细胞/(109·L-1)粒细胞/(109·L-1)淋巴细胞百分比/%单核细胞百分比/%粒细胞百分比/%红细胞/(1012·L-1)血红蛋白/(g•L-1)红细胞压积/%平均红细胞体积/f L血小板/(109·L-1)停药后恢复时间0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d TGY 7.23±2.57 6.84±1.75 5.98±2.21 5.46±1.57 0.14±0.09 0.16±0.05 1.11±0.38 1.23±0.25 82.43±2.98 79.29±3.62 2.05±0.53 2.43±0.24 15.53±2.65 18.29±3.45 8.67±0.47 8.86±0.33 157.50±7.95 156.00±7.66 48.74±2.56 48.11±2.11 56.30±0.77 54.34±0.98 1 127.00±183.76 1 063.29±114.61 LDRH 5.55±1.36*6.11±2.06 4.40±1.17 4.63±1.48 0.13±0.05 0.14±0.05 1.02±0.39 1.35±0.65 79.00±6.50 76.06±6.13 2.26±0.44 2.51±0.40 18.74±6.12 21.43±5.89 8.44±0.28 8.79±0.61 153.10±3.93 155.25±8.51 46.88±1.34 46.61±2.51 55.62±1.75 53.14±1.64 1 113.20±144.30 1 002.75±67.90 BDRH 8.55±2.13a 7.73±2.07b 7.05±1.86a 5.94±1.69b 0.18±0.07 0.18±0.07 1.33±0.39 1.61±0.63 81.95±4.37 77.16±6.88 2.33±0.58 2.31±0.31 15.73±3.99 20.53±6.72 8.85±0.51 8.59±0.31 158.38±9.32 152.00±5.15 48.81±2.82 46.35±1.25 55.25±1.24 54.04±2.13 1 090.88±427.94 1 050.13±145.92 LDRL 8.89±2.73 8.99±1.96 7.18±2.42#7.16±1.35#0.20±0.08 0.16±0.09 1.51±0.41 1.65±0.82 72.38±19.59 79.14±5.61 2.58±0.71 2.16±0.23 17.55±3.79 18.70±5.43 8.74±0.99 8.81±0.68 154.88±18.87 153.88±7.36 48.50±5.25 47.36±2.42 55.61±1.55 53.95±2.24 1 100.75±411.57 1 123.25±129.30 BDRL 7.66±3.07 9.00±2.34 6.11±2.47#7.19±1.78#0.16±0.11 0.18±0.07 1.39±0.57 1.64±0.62 79.70±3.68 79.79±3.64 2.19±0.46 2.21±0.23 18.11±3.47 18.00±3.53 8.70±0.39 8.82±0.43 158.75±5.70 154.38±6.70 49.28±1.66 47.70±1.96 56.73±1.95 54.18±1.34 1 049.88±122.35 965.63±139.27
2.3 DRR1活菌及其破碎物对大鼠慢性毒性血生化指标的影响
连续给药30 d后,谷丙转氨酶(ALT)在给药结束即刻及恢复14 d后,各给药组与TGY组比较无显著变化(P>0.05);而LDRH和BDRH组在恢复期ALT升高,LDRL恢复期ALT降低(P<0.05)(表4)。谷草转氨酶(AST)在停药后即刻,LDRH组显著升高,给药各组内与LDRH组比较有显著降低,接近TGY组水平;恢复14 d后,LDRH组的AST恢复至TGY水平。碱性磷酸酶(ALP)在停药后即刻,各给药组与TGY组比较均无显著变化(P>0.05);恢复14 d后,各给药组与TGY组比较,ALP无显著差异(P>0.05);恢复14 d后各给药组与停药后即刻各给药组相比较,ALP显著降低(P<0.05)。总蛋白(TP)、尿酸(UA)、尿素(UREA)、镁(Mg)在受试给药期内各组均无显著变化(P>0.05)。血糖(Glu)在停药后即刻以及恢复14 d后,各给药组与TGY组比较无显著变化(P>0.05);恢复14 d后,LDRL、BDRL与LDRH组比较Glu明显降低(P<0.05)。肌酸激酶(CK)在停药后即刻,LDRH组显著升高(P<0.05),恢复14 d后恢复至正常水平。肌酸激酶同工酶(CK-MB)在停药后即刻,各给药组与TGY比较,LDRH组有显著升高(P<0.05),与LDRH组比较BDRL组显著降低(P<0.05);恢复14 d后,与TGY组比较,LDRH、BDRH组均有显著升高(P<0.05)。乳酸脱氢酶(LDH)在停药后即刻,相比较于TGY组,LDRH组显著升高(P<0.01);14 d恢复期后,与TGY组比较,各给药组未见显著差异(P>0.05),但与停药后即刻各相应组比较显著升高(P<0.05)。血清磷(P)的水平在给药结束后即刻以及恢复14 d后,各给药组与TGY组比较无显著变化(P>0.05);恢复期TGY、LDRH、BDRL各组血清磷的水平与停药后即刻比较,均有降低(P<0.05)。在给药实验期两个时间节点内检测受试大鼠血清生化指标的变化,均在SD大鼠正常参考范围内[8]。
表4 DRR1活菌及其破碎物给药后大鼠的血清生化指标Table 4 Serum biochemical indexes of rats after administration of DRR1 live bacteria and its broken products(±s)

表4 DRR1活菌及其破碎物给药后大鼠的血清生化指标Table 4 Serum biochemical indexes of rats after administration of DRR1 live bacteria and its broken products(±s)
注:LDRH即DRR1高浓度(109/mL)给药组,LDRL即DRR1低浓度(107/mL)组,BDRH即DRR1破碎物高浓度(109/mL)组,BDRL即DRR1破碎物低浓度(107/mL)组,TGY即对照组(用含0.5%胰蛋白胨、0.1%葡萄糖和0.3%酵母提取物的琼脂培养液处理)。与TGY组比较,*P<0.05,**P<0.01;与LDRH组比较,#P<0.05,##P<0.01;同一列肩标不同字母a和b表示两个时间相比,P<0.05。恢复期TGY组n=7,其余各组均n=8。
血清生化谷丙转氨酶/(U•L-1)谷草转氨酶/(U•L-1)碱性磷酸酶/(U•L-1)总蛋白/(g•L-1)尿酸/(µmol•L-1)尿素/(mmol•L-1)葡萄糖/(mmol•L-1)肌酸激酶/(U•L-1)镁/(mmol•L-1)磷/(mmol•L-1)肌酸激酶同工酶/(U•L-1)乳酸脱氢酶/(U•L-1)给药后时间0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d TGY 35.74±3.74 38.60±7.26 92.91±11.42 94.53±18.03 154.84±62.60a 126.71±48.99b 59.70±2.88 63.29±2.84 82.18±9.45 58.66±6.06 7.88±1.09 7.23±0.97 7.59±1.58 7.31±0.66 429.45±105.18 398.31±183.20 1.05±0.19 1.03±0.19 3.63±1.27a 2.13±0.66b 222.53±77.40 172.52±43.18 240.50±98.31a 646.07±121.56b LDRH 38.51±5.01a 40.06±9.30b 137.68±26.30**a 93.38±22.79b 155.14±49.66a 118.55±58.88b 58.78±3.08 61.00±1.89 83.04±12.49 60.86±10.41 7.92±1.36 7.91±1.03 6.51±0.66 7.78±0.36 697.47±193.38*a 480.55±52.94b 1.07±0.10 1.08±0.20 2.61±0.26a 1.76±0.75b 325.28±86.38*278.83±97.58*392.69±119.31**a 658.20±227.18b BDRH 38.55±5.22a 43.29±6.65b 110.96±22.07a 96.86±13.89b 130.53±41.57a 115.54±56.84b 58.99±4.24 62.35±2.83 76.75±9.95 69.55±10.45 7.43±0.80 6.77±0.96 6.98±0.89 7.71±0.45 607.49±196.76a 449.17±178.86b 0.99±0.09 0.91±0.09 2.74±0.35 2.34±0.42 307.46±104.23 295.37±93.62**342.48±132.26a 651.57±254.23b LDRL 38.20±5.77a 29.13±5.33b 105.32±16.21#93.99±16.92 138.28±64.71a 100.58±42.66b 59.23±3.83 62.43±3.68 83.48±15.66 64.85±11.09 6.93±0.58 6.75±0.74 6.89±0.60 6.86±0.54#551.60±166.30 500.63±223.71 0.97±0.06 0.91±0.07 2.88±0.26 2.28±0.69 270.05±97.11 216.52±36.79 271.78±95.67#a 590.10±237.34b BDRL 32.36±4.70 31.75±7.28 97.23±17.69##96.30±17.37 120.29±59.87 108.41±51.08 58.85±3.69 61.64±3.11 71.55±20.96 57.69±10.20 6.83±1.80 7.13±1.25 6.91±0.46 6.92±0.55#423.45±84.94##365.03±180.07 0.93±0.11 0.92±0.08 4.11±3.12a 2.19±0.66b 219.65±62.12#200.20±29.64 240.76±93.99##a 597.46±312.35b
2.4 DRR1活菌及其破碎物对大鼠慢性毒性电解质的影响
给药30 d后停药即刻,DRR1各组大鼠的血清电解质与TGY组比较,差异均不显著;与LDRH组比较,BDRH组、BDRL组、LDRL组的血清Cl-含量降低(P<0.05),但都在生理参考范围内。14 d恢复期后,与TGY组比较,LDRH组、BDRH组的血清pH值、Na+含量明显升高(P<0.05),血清Cl-、Ca2+水平降低(P<0.05),而血清K+未发生显著改变(P>0.05)(表5)。
表5 DRR1活菌及其破碎物给药后大鼠血清电解质的变化Table5 Changesof serum electrolytesin ratsafter administration of DRR1 livebacteria and itsbroken products(±s)

表5 DRR1活菌及其破碎物给药后大鼠血清电解质的变化Table5 Changesof serum electrolytesin ratsafter administration of DRR1 livebacteria and itsbroken products(±s)
注:LDRH即DRR1高浓度(109/mL)给药组,LDRL即DRR1低浓度(107/mL)组,BDRH即DRR1破碎物高浓度(109/mL)组,BDRL即DRR1破碎物低浓度(107/mL)组,TGY即对照组(用含0.5%胰蛋白胨、0.1%葡萄糖和0.3%酵母提取物的琼脂培养液处理)。与TGY组比较,*P<0.05,**P<0.01;与LDRH组比较,#P<0.05,##P<0.01;同一列肩标不同符号a和b表示P<0.05;恢复期TGY组n=7,其余各组均n=8。
血清离子K+/(mmol•L-1)Na+/(mmol•L-1)Cl-/(mmol•L-1)Ca2+/(mmol•L-1)pH值停药后时间0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d TGY 4.36±0.35 3.96±0.24 140.63±1.08 140.53±0.96 107.93±1.49 107.31±1.34 2.67±0.05 2.60±0.06 6.81±1.77 7.46±0.03 LDRH 4.08±0.45 3.83±0.17 141.33±1.48 143.13±0.78**109.59±1.43 104.69±1.34*2.62±0.05a 2.36±0.06**b 7.42±0.03 7.51±0.02**BDRH 3.94±0.34 4.07±0.28 140.61±0.99 142.45±0.80**106.79±1.26##105.15±1.38 2.61±0.10 2.45±0.07 7.43±0.05 7.52±0.02**LDRL 4.22±0.38 3.96±0.42 140.66±0.68 142.17±1.33 107.13±1.10#105.71±1.94 2.62±0.12 2.54±0.17##7.44±0.03 7.51±0.04 BDRL 4.02±0.15 4.02±0.22 141.01±0.84 140.54±0.86##107.38±1.90#106.39±0.93 2.62±0.04 2.60±0.04##7.44±0.02 7.47±0.02
2.5 DRR1活菌及其破碎物对大鼠脏器系数的影响
给药30 d后,停药即刻及停药14 d后的脏器系数见表6。与TGY组比较,受试大鼠除LDRH组的心脏脏器系数有显著降低(P<0.05)外,其他各脏器的脏器系数差异均无统计学意义(P>0.05)。
表6 DRR1活菌及其破碎物给药后大鼠的各脏器系数Table6 Organ coefficientsof ratsafter administration of DRR1 livebacteria and itsbroken products(±s,%)

表6 DRR1活菌及其破碎物给药后大鼠的各脏器系数Table6 Organ coefficientsof ratsafter administration of DRR1 livebacteria and itsbroken products(±s,%)
注:LDRH即DRR1高浓度(109/mL)给药组,LDRL即DRR1低浓度(107/mL)组,BDRH即DRR1破碎物高浓度(109/mL)组,BDRL即DRR1破碎物低浓度(107/mL)组,TGY即对照组(用含0.5%胰蛋白胨、0.1%葡萄糖和0.3%酵母提取物的琼脂培养液处理)。与TGY组比较,*P<0.05,**P<0.01;与LDRH组比较,#P<0.05,##P<0.01;恢复期TGY组n=7,其余各组均n=8。
脏器名称心肝脾肺肾脑胸腺停药后时间0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d 0 d 14 d TGY 0.33±0.03 0.29±0.03 2.81±0.29 2.77±0.25 0.21±0.05 0.19±0.02 0.46±0.05 0.49±0.07 0.65±0.05 0.61±0.06 0.67±0.14 0.52±0.08 0.14±0.02 0.16±0.16 LDRH 0.30±0.01*0.29±0.03 2.73±0.20 2.87±0.35 0.22±0.04 0.22±0.03 0.51±0.08 0.50±0.07 0.64±0.09 0.65±0.05 0.60±0.11 0.59±0.12 0.14±0.06 0.15±0.02 BDRH 0.30±0.02 0.30±0.04 2.95±0.19 2.77±0.16 0.21±0.04 0.22±0.04 0.50±0.07 0.48±0.04 0.67±0.06 0.60±0.03 0.63±0.12 0.49±0.15 0.14±0.02 0.13±0.04 LDRL 0.32±0.02 0.31±0.05 2.76±0.24 2.86±0.08 0.21±0.03 0.20±0.01 0.49±0.09 0.52±0.09 0.66±0.06 0.64±0.03 0.62±0.14 0.56±0.13 0.15±0.04 0.14±0.05 BDRL 0.33±0.03#0.29±0.02 2.77±0.25 2.98±0.18 0.23±0.03 0.20±0.03 0.49±0.07 0.49±0.05 0.68±0.06 0.61±0.08 0.68±0.09 0.51±0.09 0.14±0.02 0.12±0.03
2.6 DRR1活菌及其破碎物对大鼠主要脏器的病理学影响
给药30 d后停药即刻,可见心肌细胞排列规则,偶见心肌细胞间微血管扩张充血(箭头所示),未见炎性细胞浸润及心肌细胞水肿变性等病理改变(图1A1、A3);停药14 d后,可见心肌细胞排列规则,偶见心肌细胞间微血管扩张充血(箭头所示),与正常大鼠心脏病理学结构一致(图1A2、A4)。给药30 d后停药即刻,可见肝小叶肝细胞排列整齐,偶见部分肝细胞轻微肿胀,汇管区微静脉充血(图1B1、B3);停药14 d后,可见肝细胞结构完整,排列整齐,偶见汇管区微静脉充血(箭头所示),与正常组织结构一致(图1B2、B4)。给药30 d停药后即刻,偶见肾小球及部分近曲小管上皮细胞肿胀,肾小球囊腔狭窄(图1C1、C3);停药14 d后,可见肾小球囊腔清晰(箭头所示),肾小球结构完整,肾小管上皮细胞肿胀减轻(图1 C2、C4),髓质部未见上皮细胞肿胀及微小静脉扩张充血,与正常组织结构一致。
给药30 d后停药即刻及停药14 d后,肺脏病理形态学结构均未见病理学变化(图1D1、D2、D3、D4)。心脏、肝脏、肾脏、肺与正常大鼠组织结构比较(图1A0、B0、C0、D0),给药30 d后停药即刻及停药14 d后,均未见实质性病理学改变。
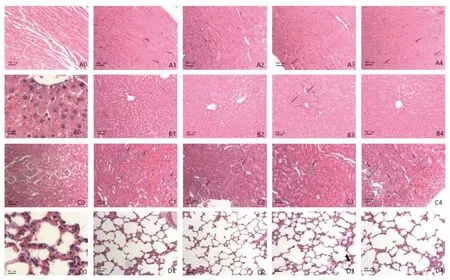
图1 DRR1活菌及破碎物高浓度给药大鼠主要脏器的病理学变化(HE染色)Figure 1 Pathology of main organs in rats treated with high concentration of DRR1 live bacteria and its broken products(HE staining)
3 讨论
DR具有很强的辐射与放射抗性,同时具有强抗氧化、抗干燥、抗强化学诱变剂和抗强紫外线的特性。DR的pprI、pprM基因能够在毕赤酵母以及哺乳动物细胞株或小鼠体内稳定转染,并发挥抗氧化与抑制肿瘤生长的作用[9-11]。鉴于DR特有的DNA损伤强修复能力,DR体内抗氧化保护酶系相关基因的高水平表达,以及其复杂的细胞壁结构,可以推测DR在生命科学中有很广阔的应用前景。
发现DRR1已60多年,国内研究者就其抗辐射相关基因群、相关蛋白因子以及抗氧化应激酶系统进行了原核基因重组转化真核细胞、电转化人类肿瘤细胞株及小鼠等方面的研究,均获得了可喜成果[12-17]。临床上已将双岐杆菌乳杆菌三联活菌片(金双岐)用于调节肠道菌群,可治疗肠道菌群失调引起的腹泻、慢性腹泻及便秘。那么,DR是否也能以活菌片的形式应用于临床,调节肠道菌群或者增强机体的免疫功能?基于这种想法,本研究组就DR标准菌DRR1活菌及其代谢产物、菌体破碎物的毒性进行了实验,将109/mL DRR1活菌,以0.4 mL/10 g体质量,24 h内间隔6 h,连续3次灌胃KM小鼠,观察48 h,未见小鼠死亡及其他中毒症状;又以109/mL DRR1活菌,间隔8 h连续灌胃2次后,观察14 d,未检测到小鼠的毒性反应(结果待发表)。在此急性毒性实验的基础上,研究组进行了大鼠的慢性毒性实验。本实验中给予大鼠不同浓度的DRR1活菌及其破碎物,实验期间除1只大鼠(对照组内大鼠)因灌胃操作不当致死外,其余大鼠均被毛光滑,饮食、活动、排泄等未见异常、未见眼角有异常内分泌物。给药30 d结束后及停药14 d后,深度麻醉大鼠,进行各指标的毒理学检测,各主要脏器肉眼观察无大体病理学变化。白细胞数在大鼠中给予高浓度DR活菌时有一过性的降低,但2周后恢复正常。与TGY组比较,LDRH组大鼠的血清AST、CK、CK-MB、LDH值均有所升高;停药14 d后除CK-MB、LDH外,其余均恢复至正常水平。血清离子浓度在给药30 d结束后,未发生显著变化;但在停药14 d时出现了波动,表现在Cl-、Ca2+降低,而Na+、pH升高。为检查这种变化对相关脏器是否存在器质性损伤,研究组在给药30 d后即刻以及停药14 d,对给予高浓度DRR1活菌以及高浓度DRR1菌体破碎物的大鼠的心、肝、肺、肾进行了病理学检查;镜检发现,30 d给药结束时即刻及停药14 d后,心脏、肝脏、肾脏、肺未观察到实质性病理改变,证实DRR1菌对各脏器未发生毒副作用。实验进一步证实了文献所述,DRR1菌为革兰阳性菌,无致病性[18]。
虽然不断有研究表明益生菌有抑制肿瘤生长、调节肠道菌群、提高机体免疫力等多种生理功能,但由于目前对益生菌的作用机制及其安全性的研究还不够深入,尚有许多机制未完全阐明,因此益生菌作为药品使用时,其品种规格与数量在市场上仍然很少,主要应用尚限于食品和保健品行业[19]。本次大鼠慢性毒性实验初步验证了DRR1对生物机体的安全性,证明DRR1对大鼠无实际毒性。本研究为DRR1活菌或菌体破碎物在食品医药卫生领域的推广应用提供了实验依据。
