二甲双胍对阿尔茨海默症模型大鼠认知功能障碍及PI3K/Akt通路的影响
2021-09-18王百乔林小茹唐超玲
王百乔,林小茹,韩 敏,刘 煜,唐超玲
(1.海南医学院第一附属医院药学部,海口570100;2.海南医学院第一附属医院基础实验室,海口570100)
阿尔茨海默症(Alzheimer's disease,AD)又名老年痴呆症,以老年斑、神经原纤维缠结和神经元缺失为主要病理表现,是一种复杂的中枢神经系统退行性疾病[1-2]。随着社会老龄化加重,AD发病率呈逐年升高的趋势,给家庭和社会都造成了沉重负担[3]。AD发病机制复杂,其认知功能障碍发生、发展的机制一直是临床研究的热点和重点问题之一[4]。
磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)通路可调控细胞生长、增殖、分化及凋亡等多种生理活动[5]。近年来研究发现,PI3K/Akt通路参与AD神经元凋亡、自噬等多种生理过程[6]。因此,研究AD病理过程中PI3K/Akt通路的调控机制,具有一定的临床意义。
二甲双胍(metformin,Met)是国际公认的人用降糖药[7]。近来临床报告显示,Met能够通过改善AD患者胰岛素抵抗,改善AD患者的认知功能[8]。但Met改善AD患者认知功能的具体分子生物学机制还不甚明确。本研究建立AD大鼠模型,探究Met对AD大鼠认知功能的影响,以及对PI3K/Akt通路的调控作用,以期阐明AD认知功能障碍发生、发展的机制,并为临床合理用药提供参考。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠,体质量为200~220 g,由广东省医学实验动物中心[SCXK(粤)2018-0002]提供。所有大鼠常规饲养于海南药物研究所有限责任公司[SYXK(琼)2019-0007]动物设施。本实验经本院伦理委员会批准(IACUC-20190003)。
1.2 主要试剂及仪器
Met(批号20032322,规格0.25 g×48T)购自江苏苏中药业集团股份有限公司;链脲霉素(streptozotocin,STZ)(货号:sf1446)购自上海士锋生物科技有限公司;苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(货号G1120)购自北京索莱宝科技有限公司;检测β-淀粉样蛋白42(β-amyloid 42,Aβ42)用ELISA试剂盒(货号E-EL-R1402)购自上海振誉生物科技有限公司;检测磷酸化Tau蛋白(phosphorylated Tau protein,p-tau)用ELISA试剂盒(货号EHJ-ZH1216)购自厦门慧嘉生物科技有限公司;PI3K抗体、磷酸化Akt(p-Akt)抗体、胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)抗体、糖原合酶激酶-3(glycogensynthasekinase-3,GSK-3)抗体(货号分别为ab39307、ab38449、ab40777、ab93926)均购自美国Abcam公司;BCA蛋白定量试剂盒和胰蛋白酶(货号分别为P0768、P0231)均购自美国Pierce公司。
手动轮转式切片机(型号RM2125RTS)购自德国Leica公司;光学显微镜(型号SMZ745)购自日本Nikon公司;蛋白电泳仪(型号1659001)、半干转膜仪(型号Trans-Blot SD)购自美国Bio-Rad公司;凝胶成像仪(型号GIS-500)购自杭州米欧仪器有限公司。
1.3 大鼠AD模型建立及分组给药
取SD大鼠50只,用随机数字表法分为正常组(Normal组)、AD模型组(AD组)、Met低剂量(50 mg/kg)组、Met中剂量(100 mg/kg)组、Met高剂量(200 mg/kg)组,每组10只。除Normal组大鼠脑双侧室注射10μL生理盐水(即0.9%氯化钠溶液)外,其余各组大鼠均参照文献[9],于脑双侧室注射10μL的STZ溶液(3 mg/kg)建立AD模型。具体建模操作方法:将大鼠用3%戊巴比妥钠麻醉后,将其头部固定于脑立体定位仪上,剪去局部毛发,碘伏消毒,沿矢状线切开皮肤,将骨膜向两侧推开,暴露颅骨;以前囟点为基准,在前囟后1.0 mm、矢状缝旁开1.5 mm处用骨钻钻孔,利用微量注射泵和10μL微量注射器将10μL的STZ溶液按3 mg/kg的剂量缓慢注入,注射完毕后留针1 min;以同样方法在大鼠另一侧脑室注射10μL STZ溶液,术后间隔2 d再重复注射一次;术野洒青霉素溶液,缝合皮肤,碘伏消毒;术后大鼠分笼饲养,并连续5 d肌内注射庆大霉素3 U/d,以防感染。Normal组除注射生理盐水外,其余操作同模型组。各组大鼠均于术后观察9 d,于第10天开始给药,参照文献[10]用生理盐水将Met配制成5、10和20 mg/mL的溶液,按10 mL/kg的剂量灌胃给予相应质量浓度的Met溶液;Normal组及AD组按10 mL/kg的剂量灌胃给予生理盐水。各给药组连续给药14 d,1次/d。
1.4 大鼠Morris水迷宫行为检测实验
各组大鼠在末次给药后12 h,参照文献[11]进行Morris水迷宫行为检测。首先制作一个直径150 cm、深60 cm、黑色内壁的不锈钢水池,四周带有不同视标并用布帘围绕。将黑色圆形逃生平台(直径14 cm,高29 cm)置于水池第一象限中央,注水后深度超过平台1~2 cm,水温(23±2)℃。水池上方安装有与计算机相连的摄像头,用于记录大鼠游泳轨迹。实验分两部分。(1)定位航行实验:即将大鼠面朝池壁随机从4个象限之一放入水中,记录大鼠找到隐藏在水下的平台的时间,即逃避潜伏期。如果大鼠120 s内未找到平台,则引导其找到平台,并让其在平台上停留10 s。每只大鼠每日训练4次,平均值作为该鼠当日的平均逃避潜伏期。连续训练观察5 d,以第5天数据的平均值进行比较。(2)空间探索实验:定位航行实验结束后24 h,撤去水下平台,随机选2个象限(平台所在的第一象限除外),将大鼠面朝池壁投入池中,并让其自由游泳120 s,统计大鼠穿越原平台位置的次数,计算在原平台象限内游泳时间占总时间的比值,以及游过路程占总路程的比值。(3)可视平台验证实验:航行实验和空间探索实验结束后,降低水位露出平台,大鼠随机投放后应无困难地游向平台,以排除前两项实验过程中其存在视觉或运动障碍的可能性,证明结果可信。
1.5 大鼠标本采集
各组大鼠在Morris水迷宫行为检测实验结束后第2天,麻醉下心脏灌注PBS,断头。冰块上迅速取出一侧海马组织,并将海马组织浸泡于质量分数为4%的多聚甲醛溶液中固定,备用。然后,迅速取另一侧海马组织,放于冻存管中,并迅速置于液氮罐中速冻,转移至-80℃冰箱中保存备用。
1.6 大鼠海马组织HE染色
取经4%多聚甲醛溶液中固定24 h的海马组织,用含30%蔗糖的多聚甲醛溶液脱水,行海马组织冷冻切片。取部分切片,根据试剂盒说明书进行HE染色,并在在显微镜下观察海马组织变化。
1.7 免疫组织化学法检测大鼠海马组织中PI3K阳性表达
取16节HE染色实验剩余的海马组织石蜡切片,经二甲苯脱蜡、梯度乙醇溶液水化、过氧化氢灭活、内源性过氧化物酶封闭进行抗原修复后,加入抗PI3K抗体(稀释比例为1∶500),置于湿盒内4℃孵育过夜。然后按PV6001试剂盒说明书方法滴加羊抗兔二抗溶液,孵育50 min后,进行DAB显色、苏木精对比染色、封固。最后用光学显微镜观察,用Image Pro Plus 5.0图像分析系统分析单位面积(1 mm2)阳性染色区的平均吸光度值,以此反映PI3K阳性表达量。
1.8 ELISA法检测海马组织中Aβ42、p-tau含量
取-80℃保存的海马组织,于4℃冰箱解冻后,用组织匀浆器匀浆,再经离心分离后取上清液。用ELISA试剂盒检测Aβ42、p-tau含量,具体操作按说明书进行。
1.9 蛋白质印迹法检测海马组织中PI3K、p-Akt、IRS-1和GSK-3蛋白表达
取-80℃保存的海马组织,于4℃冰箱中解冻后,用组织匀浆器匀浆,离心分离后,取上清液。用蛋白提取试剂盒提取组织总蛋白,用蛋白定量BCA试剂盒检测总蛋白浓度后,取50μg蛋白上样,进行电泳和转膜反应。TBST溶液清洗后,加入5%脱脂牛奶,室温下封闭1 h;TBST溶液清洗3次后,加入抗PI3K、p-Akt、IRS-1、GSK-3和β-actin(内参)抗体[除β-actin抗体(1∶2 000)外,稀释比例均为1∶1 000],于4℃摇床室温孵育过夜;TBST振荡漂洗后,加入辣根过氧化物酶标记的羊抗兔二抗(稀释比例为1∶2 000),于37℃摇床上室温孵育1 h;TBST清洗3次后,采用增强化学发光法显色,以凝胶成像仪观察条带并拍照,并用Image J软件分析各组蛋白的相对表达水平。
1.10 统计学分析
用SPSS 22.0软件对实验数据进行统计分析。计量资料以±s表示。2组间比较采用t检验;多组间比较采用单因素方差分析,然后进一步行SNK-q检验;百分率比较采用卡方检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠的空间学习记忆能力
Morris水迷宫行为检测结果显示:与Normal组相比,AD组大鼠平均逃避潜伏期延长(P<0.05),穿越平台次数减少(P<0.05),原平台象限游泳距离与总距离的比值、游泳时间与总时间的比值均降低(P<0.05);与AD组相比,Met低、中、高剂量组大鼠的平均逃避潜伏期缩短(P<0.05),穿越平台次数增加(P<0.05),原平台象限游泳距离与总距离的比值、游泳时间与总时间的比值均升高(P<0.05)。Met各剂量组的上述指标变化均呈剂量依赖性(表1)。
表1 各组大鼠的Morris水迷宫行为指标比较Table1 Comparison of behavioral indicatorsof ratsin each group detected by the Morriswater mazetest(±s,n=10)

表1 各组大鼠的Morris水迷宫行为指标比较Table1 Comparison of behavioral indicatorsof ratsin each group detected by the Morriswater mazetest(±s,n=10)
注:Normal指生理盐水对照组,AD指阿尔茨海默症模型组,Met低、中、高剂量指AD建模后分别灌胃给予50 mg/kg、100 mg/kg和200 mg/kg二甲双胍(Met)溶液的用药组。与Normal组相比,a P<0.05;与AD组相比,b P<0.05;与Met低剂量组相比,c P<0.05;与Met中剂量组相比,d P<0.05。
组别Normal AD Met低剂量Met中剂量Met高剂量平均逃避潜伏期/s 19.00±1.01 32.21±1.64a 28.85±1.57ab 24.07±1.26abc 20.08±1.68bcd穿越平台次数/次4.86±0.49 1.21±0.31a 2.85±0.37ab 3.87±0.46abc 4.68±0.48bcd原平台象限游泳距离与总距离的比值0.39±0.03 0.21±0.01a 0.27±0.02ab 0.33±0.03abc 0.38±0.02bcd原平台象限游泳时间与总时间的比值0.40±0.04 0.20±0.02a 0.28±0.03ab 0.34±0.02abc 0.38±0.03bcd
2.2 各组大鼠海马组织的病理损伤情况
HE染色结果(图1)显示:Normal组大鼠海马神经元细胞体积大而圆,细胞核居中,核仁核膜清晰,层次丰富,细胞质着色浅且均匀;与Normal组相比,AD组大鼠海马神经元细胞排列紊乱,数量减少,体积变小且拉长,细胞核固缩且染色较深,胞体收缩,形状呈多角形且极不规则;与AD组相比,Met各剂量组海马神经元细胞排列紊乱、变性等病理损伤逐渐减轻。

图1 各组大鼠海马组织的HE染色(×400)Figure1 HEstaining of hippocampusof theratsin each group(×400)
2.3 各组大鼠海马组织中Aβ42、p-tau含量
ELISA法检测结果显示:与Normal组相比,AD组大鼠的海马组织中Aβ42、p-tau含量升高(P<0.05);与AD组相比,Met低、中、高剂量组的大鼠海马组织中Aβ42、p-tau含量降低(P<0.05),且Met各剂量组上述指标变化呈剂量依赖性(表2)。
表2 各组大鼠海马组织中Aβ42、p-tau含量及PI3K阳性表达量比较Table 2 Comparison of Aβ42 and p-tau levels and PI3K positive expression in hippocampus of the rats in each group(±s,n=10)
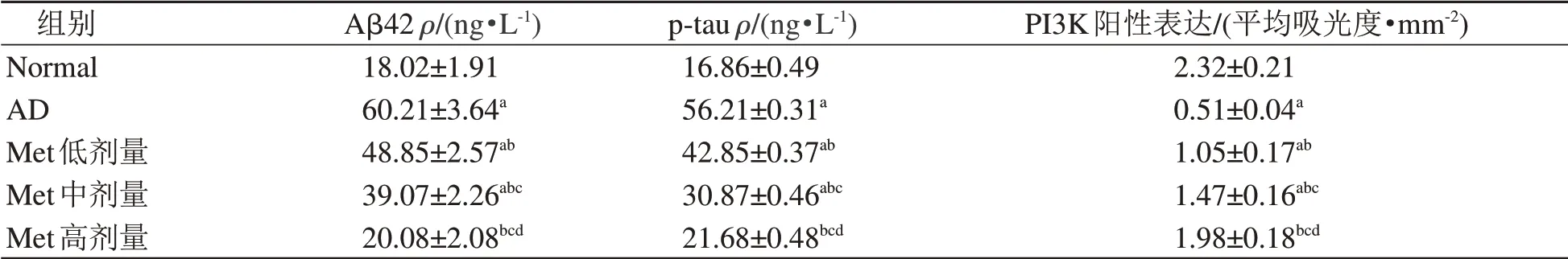
表2 各组大鼠海马组织中Aβ42、p-tau含量及PI3K阳性表达量比较Table 2 Comparison of Aβ42 and p-tau levels and PI3K positive expression in hippocampus of the rats in each group(±s,n=10)
注:Aβ42即β-淀粉样蛋白42,p-tau即磷酸化Tau蛋白。Normal指生理盐水对照组,AD指阿尔茨海默症模型组,Met低、中、高剂量指AD建模后分别灌胃给予50 mg/kg、100 mg/kg和200 mg/kg二甲双胍(Met)溶液的用药组。与Normal组相比,a P<0.05;与AD组相比,b P<0.05;与Met低剂量组相比,c P<0.05;与Met中剂量组相比,d P<0.05。
组别Normal AD Met低剂量Met中剂量Met高剂量Aβ42ρ/(ng·L-1)18.02±1.91 60.21±3.64a 48.85±2.57ab 39.07±2.26abc 20.08±2.08bcd p-tauρ/(ng·L-1)16.86±0.49 56.21±0.31a 42.85±0.37ab 30.87±0.46abc 21.68±0.48bcd PI3K阳性表达/(平均吸光度·mm-2)2.32±0.21 0.51±0.04a 1.05±0.17ab 1.47±0.16abc 1.98±0.18bcd
2.4 各组大鼠海马组织PI3K、p-Akt、IRS-1和GSK-3蛋白表达
蛋白质印迹法检测结果显示:与Normal组相比,AD组大鼠海马组织中PI3K、p-Akt、IRS-1蛋白表达水平均明显降低(P<0.05),GSK-3蛋白表达水平升高(P<0.05);与AD组相比,Met低、中、高剂量大鼠海马组织中PI3K、p-Akt、IRS-1蛋白表达水平升高(P<0.05),GSK-3蛋白表达水平降低(P<0.05),且Met各剂量组上述指标的变化呈剂量依赖性(图2)。

图2 蛋白质印迹法检测各组大鼠海马组织中PI3K、p-Akt、IRS-1、GSK-3蛋白表达水平Figure 2 Expressions of PI3K,p-Akt,IRS-1,and GSK-3 proteins in hippocampus of the rats in each group were detected by Western blotting
2.5 各组大鼠海马组织zhong PI3K阳性表达
免疫组织化学法染色结果显示,PI3K可阳性表达于神经元细胞胞质中。与Normal组相比,AD组大鼠海马组织的PI3K阳性表达量降低(P<0.05);与AD组相比,Met低、中、高剂量组大鼠海马组织中PI3K阳性表达明显升高(P<0.05),且Met各剂量组的PI3K表达量呈剂量依赖性(图3)。
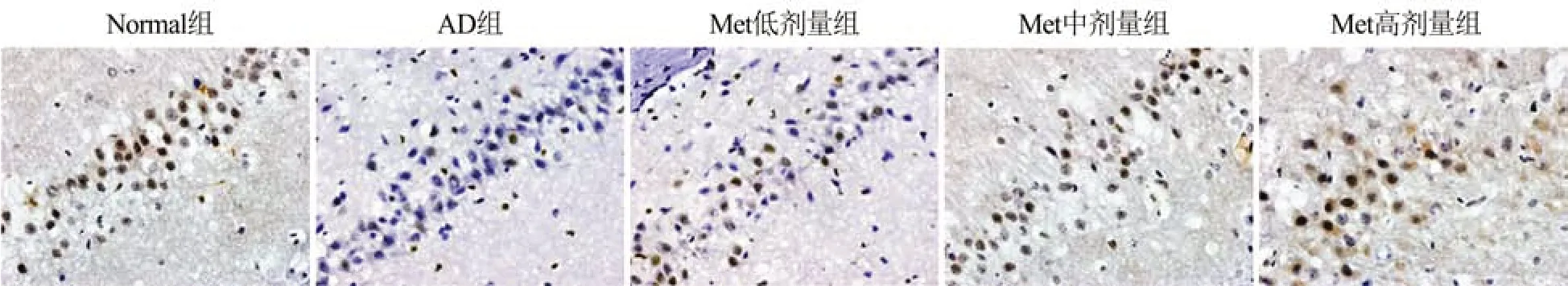
图3 大鼠海马组织PI3K免疫组织化学染色(DAB,×400)Figure 3 Immunohistochemical staining of PI3K in hippocampus tissue of the rats(DAB,×400)
3 讨论
AD的主要临床病理表现为认知功能缺失、学习记忆障碍及语言功能下降等[12]。侧脑室注射STZ可影响脑内葡萄糖代谢,引起脑内tau蛋白过度磷酸化以及Aβ沉积,导致海马神经元损伤而损伤学习和记忆功能,是模拟人类AD脑进行性能量代谢紊乱和认知功能障碍的常用方法[13]。本研究采用上述方法建立AD大鼠模型发现,AD模型组大鼠平均逃避潜伏期延长,穿越平台次数、原平台象限游泳距离与总距离比值、游泳时间与总时间比值减少,预示其学习记忆功能下降,脑内Aβ42与p-tau含量增多的同时,海马神经元也出现缺失、减少等病理损伤,表明造模成功。
目前临床上仍缺乏有效药物来预防、改善或逆转AD发生[4]。因此寻找和探索新型、有效的AD预防药物,已成为临床探索研究的重要任务之一。临床报告发现,降糖药Met对AD具有一定的防治作用[14]。Lu等[15]发现Met可通过降低胰岛素抵抗,来缓解Aβ沉积,改善AD神经功能损伤,并推测Met可能是有应用前途的AD治疗药物。本研究发现,Met低、中、高剂量组大鼠空间学习及记忆功能增加的同时,海马组织神经元缺失、减少等病理损伤明显得到缓解,且Met剂量越高,海马组织中Aβ42与p-tau降低越明显,与Lu等[15]研究结果相一致,证实了Met可能是缓解AD神经元损伤及认知功能下降的潜在药物。但具体分子生物学机制还不明确,仍需继续探究。
大量研究证实P13K/AKT通路活化,与AD发生发展关系密切。Yao等[16]发现激活P13K/AKT通路,可通过抑制GSK-3表达,抑制γ分泌酶活性,降低Aβ合成,减缓Tau蛋白磷酸化过程而缓解神经损伤。本研究也在AD大鼠脑组织内检测到P13K、p-AKT蛋白表达的降低及GSK-3表达的升高,提示AD大鼠脑组织P13K/AKT通路被抑制,GSK-3活化,可能是引起Aβ蓄积及神经元损伤的主要原因。另外,IRS-1也与神经元存活和代谢关系密切。但IRS-1与AD的关系还存在争议。Tian等[17]及刘耀萌等[18]发现IRS-1在AD大鼠脑组织内表达降低,并认为IRS-1降低,脑内胰岛素信号转导不足而引起糖元转换障碍,脑组织代谢降低,有害物质蓄积,是导致AD神经元损伤及认知功能降低的重要原因,升高IRS-1表达可激活P13K/AKT通路,改善神经元损伤;而罗俊等[19]及郝宏铮等[20]发现IRS-1在AD小鼠脑组织内表达升高,降低IRS-1表达,可促进P13K/AKT信号通路活化,改善大鼠神经元损伤及认知功能障碍。本研究发现,AD模型组大鼠海马组织中PI3K、p-AKT蛋白表达降低的同时,IRS-1表达也降低,推测大鼠侧脑注射STZ后,海马组织内可能存在胰岛素抵抗和葡萄糖转换障碍,IRS-1表达被抑制,未能激活下游P13K/AKT通路,使活性AKT(即p-AKT)减少,不足以抑制GSK-3活性,引起p-tau、Aβ42合成增多,而导致AD大鼠认知功能障碍,与文献[17-18]报告的AD发病机理一致。而Met低、中、高剂量组大鼠海马组织中IRS-1、P13K、p-AKT蛋白表达升高,GSK-3表达降低,且Met各剂量组上述指标呈剂量依赖性,推测Met改善AD大鼠认知障碍、降低海马组织p-tau、Aβ42含量、缓解神经元损伤的作用,可能与P13K/AKT通路激活有关。
综上所述,Met可激活AD大鼠海马组织PI3K/AKT通路,降低海马组织p-tau、Aβ42含量,改善AD大鼠认知障碍,这可能为阐明Met改善AD认知功能障碍的作用,提供一定参考,但PI3K/AKT通路与神经元损伤的关系及机制复杂,本研究未设置通路抑制剂进行验证,Met激活PI3K/AKT通路改善AD认知功能障碍的具体生物学机制仍需继续研究。
