菊黄东方鲀卵黄蛋白原肽段vWD的真核重组表达及功能研究
2021-09-18蒋彩云刘智禹黄文树
蒋彩云 ,乔 琨,许 旻,陈 贝,刘智禹,3,黄文树,3
( 1.集美大学水产学院,福建 厦门 361021;2.福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013;3.福建省海洋生物资源开发利用协同创新中心,福建 厦门 361021)
0 引言
大多数的河鲀都含有河豚毒素(tetraodotoxin,TTX),TTX是一类毒性极强的非蛋白类神经毒素[1],它可以选择性地与肌肉和神经组织中的电压门控Na+通道结合,从而封闭神经轴突传导能力,导致进行性瘫痪,甚至使生物因呼吸和心力衰竭而死亡[2]。TTX对小鼠的半数致死量(LD50)约为8 μg/kg(按小鼠体重计),对人的最小致死剂量只有0.5~1.0 mg[3],其毒性是氰化钠的1 250倍[4],但目前还没有对TTX中毒治疗的特效药。由于河鲀肉味鲜美、营养丰富,日本、澳大利亚、孟加拉国、中国素有食用河鲀的习惯;然而,TTX的化学性质稳定,一般烹调手段难以破坏[5];因此,人们因食用河鲀而导致TTX中毒的事件,屡有发生,严重威胁人们的生命安全[6-8]。
四齿鲀科的许多河鲀都可以贮积TTX。野生河鲀可通过食物链的毒素富集作用,大量贮积TTX于特定组织,如肝脏、卵巢和皮肤等[9]。养殖的无毒的红鳍东方鲀(Takifugurubripes)和星点东方鲀(Takifuguniphobles),若饲喂含TTX的饵料后,其肝脏、卵巢和皮肤中也可累积TTX[10-11]。对野生斑点东方鲀(Takifugupoecilonotus)进行研究发现,在性成熟期(12月至3月),随着性腺指数(gonadosomatic index,GSI)的升高,卵巢中的TTX毒性含量增加,与此同时,肝脏中的TTX含量显著降低[12],提示河鲀体内的TTX可通过组织间转运从肝脏转移到卵巢。为了探究TTX组织间转运机制,Yin等[13]提取和纯化了豹纹东方鲀(Takifugupardalis)卵巢中的高分子量物质,获得分子质量为10 ku左右的毒素结合蛋白(TPOBP-10),通过Edman法为其氨基酸测序,并进行cDNA克隆,结果显示该蛋白与红鳍东方鲀的卵黄蛋白原vWD结构域(vitellogenin subdomain,vWF type D)高度同源,提示卵黄蛋白原肽段vWD可能具有结合TTX的功能,进而参与TTX在河鲀卵巢中的富集作用[13]。然而,卵黄蛋白原肽段vWD是否可结合TTX,是否可中和TTX的毒性,目前仍缺少相关的证据。
为此,本研究采用真核表达系统体外重组表达菊黄东方鲀(Takifuguflavidus)中卵黄蛋白原vWD结构域肽段,并采用Biacore-表面等离子体共振(SPR)检测重组蛋白结合TTX的能力,并进一步研究重组蛋白对TTX毒性的中和作用,为阐明TTX从肝脏转移到卵巢的机制积累重要基础资料。
1 材料与方法
1.1 材料
1.1.1 实验材料
菌株:E.coliDH5α感受态细胞为本实验室保存,毕赤酵母菌株GS115购自Invitrogen公司;质粒:pMD19-T-TF_vWD克隆质粒为本实验室保存,表达载体pPIC9K购自Invitrogen公司;实验动物:19.0~21.0 g的无特定病原体级(SPF)ICR品系雄性健康小鼠,由厦门大学实验动物中心提供。
1.1.2 实验试剂
胰蛋白胨(tryptone)、酵母粉(yeast extract)购自OXOID公司;生物素购自上海生工生物公司;无氨基酵母氮源(YNB)购自Difco公司;DL2000 DNA Maker(3427A)、Ex Taq酶试剂盒、EcoR I和Not I限制性内切酶、核酸共沉剂试剂盒、T4 DNA ligase均购自TaKaRa公司;预染蛋白质分子质量标准Marker(DM131-01)购自北京全式金生物公司;DL10 000 DNA Marker(SM0331)购自赛默飞世尔科技有限公司;His-Tag抗体(6×His,His-Tag Antibody)、羊抗鼠二抗(Goat Anti-Mouse IgG (H+L))购自Proteintech公司;河豚毒素粗品(C11H17N3O8,纯度≥98%)购自泰州康特生物工程有限公司;HisTrapTMFF Crude 5mL亲和层析柱、氨基偶联试剂盒(氢氧化钠、乙醇胺、醋酸钠缓冲液(pH=4.0,4.5,5.0,5.5)、NHS(N-羟基马来酰亚胺)、EDC-HCl(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)等)、甘氨酸-盐酸(pH=2.0),以及传感生物芯片CM5均购自美国GE Healthcare Life Sciences公司;PBS缓冲液(pH=7.4)由本实验室制备。
1.2 方法
1.2.1 pPIC9K-TF_vWD载体的构建
根据菊黄东方鲀TF_vWD蛋白质编码基因(GenBank登录号:MT160192),采用Primer Premier 6.0软件设计上下游引物。上游引物为TF_vWD-F:5′-GGGGAATTCACCACCTTCAACGACATCA-3′;下游引物为TF_vWD-R:5′-ATGCGGCCGCTCAATGGTGATGGTGATGATGCCCGTTGGGCATAC GGA-3′。下划线部分为限制性内切酶 EcoR I和Not I的酶切位点,终止密码子前为6×His标签(如加粗部分)。引物合成由生工生物工程(上海)股份有限公司完成。
以菊黄东方鲀pMD19-T-TF_vWD阳性质粒(本实验室保存)为模板,分别以TF_vWD-F和TF_vWD-R为上、下游引物,采用Ex Taq©酶扩增目的基因片段,获得含有酶切位点的TF_vWD目的基因片段。使用EcoR I和Not I限制性内切酶进行双酶切,同时对pPIC9K载体质粒进行EcoR I和Not I双酶切,用核酸共沉剂试剂盒按照说明书回收酶切后的目的基因片段及载体。采用T4 DNA ligase于16 ℃下将具有EcoR I和Not I黏性末端的pPIC9K载体与具有相同黏性末端的TF_vWD基因片段连接,转化至E.coliDH5α感受态细胞中,涂布于含有卡那霉素的LB琼脂平板上进行抗性筛选,用PCR法鉴定阳性克隆菌,交由生工生物工程(上海)股份有限公司完成测序。根据测序结果,将已构建成功的阳性菌株-80 ℃保存于终体积分数为20%的甘油中备用。
真核表达载体的构建过程如图1所示,分泌型表达载体pPIC9K的N端含有AOX 1启动子,利用酵母信号肽α-factor因子引导TF_vWD分泌表达,其C端加入6×His标签,可以通过Ni+亲和层析纯化目的蛋白。
1.2.2 pPIC9K-TF_vWD载体的转化
将测序正确的pPIC9K-TF_vWD菌株进行培养并提取质粒,通过Sac I限制性内切酶对其线性化。用核酸共沉剂对酶切产物进行纯化,通过电击法将线性化的质粒转化至毕赤酵母GS115感受态细胞中,并立即将转化液涂布于MD平板上,放入培养箱(28 ℃)中培养2~3 d,随机挑取MD平板上的单克隆菌落接种于YPD平板培养。
1.2.3 TF_vWD重组蛋白的表达与纯化
挑取YPD平板上GS115单菌落接种于20 mL BMGY培养基中,然后放入培养箱(28 ℃)。以230 r/min摇菌至600 nm波长下OD值为4~6时,2000g离心10 min收集细胞,再加入20 mL BMMY培养基。比较在pH=7.0、诱导甲醇体积分数为0.5%、不同诱导时间(0,12,24,48,72,96 h)下重组蛋白的表达量(每隔24 h,补加0.5%的甲醇)。利用SDS-PAGE对TF_vWD重组蛋白(rTF_vWD)的表达量进行分析,其余表达菌液的上清,经PBS透析缓冲液透析3次,每次24 h,经0.45 μmol/L 膜抽滤收集上清液并用Ni+亲和层析柱纯化。
按照GE公司的HisTrapTMFF crude亲和层析柱操作说明书进行纯化:用5~10倍体积超纯水清洗层析柱,用5~10倍柱体积的平衡缓冲液平衡HisTrap层析柱;将过滤后的蛋白液上柱,用3~5倍柱体积的平衡缓冲液平衡过柱,洗去未结合的杂蛋白;用洗脱缓冲液过柱,5~10倍柱体积,洗脱目标蛋白;收集洗脱峰,取少量洗脱液进行SDS-PAGE电泳鉴定rTF_vWD的纯度,并以Mouse Anti-6His Tag为一抗,进行Western Blot鉴定。
1.2.4 rTF_vWD与TTX的亲和力检测
1)pH筛选 使用Biacore T200系统中的控制软件(Biacore T200 Control Software)进行表面等离子体共振(SPR)分析TTX与rTF_vWD的相互作用。在将rTF_vWD固定在传感器芯片CM5上之前,筛选合适的结合缓冲液的pH值,以PBS缓冲液为工作缓冲液,用10 mmol/L醋酸钠缓冲液(pH值分别为5.0、4.5和4.0)稀释rTF_vWD至终质量浓度为30 μg/mL。进样完成后选取偶联量最大的pH值进行后续实验,每次进样后用50 mmol/L NaOH再生表面。
2)rTF_vWD在CM5传感片表面的偶联 系统设置将EDC和NHS以1∶1比例进行混合,活化传感器芯片CM5表面,再进样30 μg/mL rTF_vWD重组蛋白溶液(用pH=4.0的醋酸钠缓冲液配制,pH条件根据上述实验筛选所得),最后以1 mol/L乙醇胺盐酸封闭液封闭活化的芯片表面。
3)rTF_vWD与TTX的动力学分析 用PBS缓冲液分别稀释TTX粗品浓度至0,31.25,62.5,125,250,500,1000,2000,4000 μmol/L,依次通入到传感芯片上进行测量,在每次测量后以pH=2.0 的甘氨酸进行洗脱。本实验在25 ℃下进行,利用Biacore Evaluation Software评估软件从结合和解离曲线计算出rTF_vWD与TTX的平衡解离常数(KD)。
1.2.5 利用腹腔注射验证rTF_vWD对TTX的中和作用
选取19.0~21.0 g的无特定病原体级(SPF)ICR系雄性健康小鼠50只,称量并记录体重。实验操作方法参照食品安全国家标准“水产品中河豚毒素的测定”[14]。
1)对照组:准备10只小鼠,每只小鼠腹腔注射0.15 μg TTX,等待小鼠死亡,记录在2 h内的生存时间及死亡数量。
2)实验组:提前将TTX与rTF_vWD按摩尔比为1∶1和1∶50分别混匀,在15 ℃条件下分别孵育15 h。准备20只小鼠,随机分为2组,每组小鼠分别腹腔注射0.15 μg TTX与对应摩尔比的rTF_vWD混合液,等待死亡,记录在2 h内的生存时间及死亡数量。
2 实验结果
2.1 pPIC9K-TF_vWD真核载体的构建与鉴定
经PCR扩增获得TF_vWD ORF框的编码序列,大小为435 bp,编码145个氨基酸,分子质量为16.49 ku,pI值为5.58。分别使用EcoR I和Not I对目的基因及pPIC9K载体进行酶切,将酶切后的载体与目的基因连接,获得475 bp+9.2 Kbp的pPIC9K-TF_vWD重组质粒(见图2a),并转化至大肠杆菌DH5α中。挑取若干单克隆,进行PCR鉴定,得到阳性重组子克隆片段约500 bp,与预期片段大小相符(见图2b)。分别取阳性菌液测序,结果证明连接正确,核苷酸的开放阅读框编码连续,最终获得正确构建的pPIC9K-TF_vWD融合表达载体。
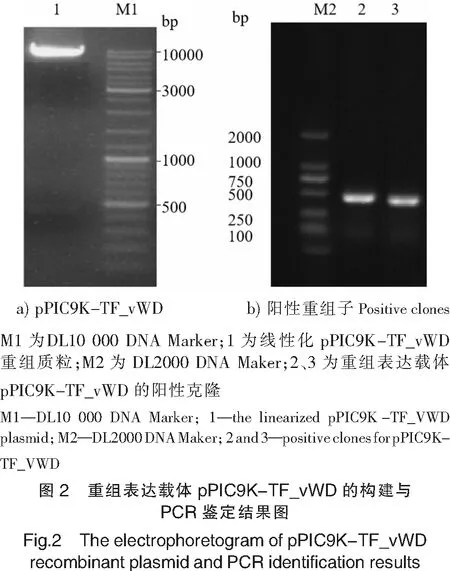
2.2 TF_vWD在毕赤酵母中表达及纯化
实验在培养基pH为7.0,诱导表达的甲醇体积分数为0.5%的条件下,比较了不同时间点(0,12,24,48,72,96 h)rTF_vWD的表达量。结果表明:在各诱导表达条件下,在约16 ku位置均出现目的条带,且72 h后,表达量最高(见图3a)。
重组毕赤酵母诱导表达后,离心后收集上清,经透析和过滤后,利用镍离子螯合亲和层析柱纯化rTF_vWD真核表达产物。用低浓度咪唑(20 mmol/L)洗脱杂蛋白,高浓度咪唑(500 mmol/L)洗脱螯合的融合蛋白,280 nm检测紫外吸收曲线,可见到明显的洗脱蛋白峰。收集洗脱组分进行SDS-PAGE电泳,经Quanlity One软件分析,得到了纯度为90%的rTF_vWD。对纯化后的rTF_vWD进行Western Blot鉴定,结果在分子质量约为16 ku的位置发现单一目的条带(见图3b)。
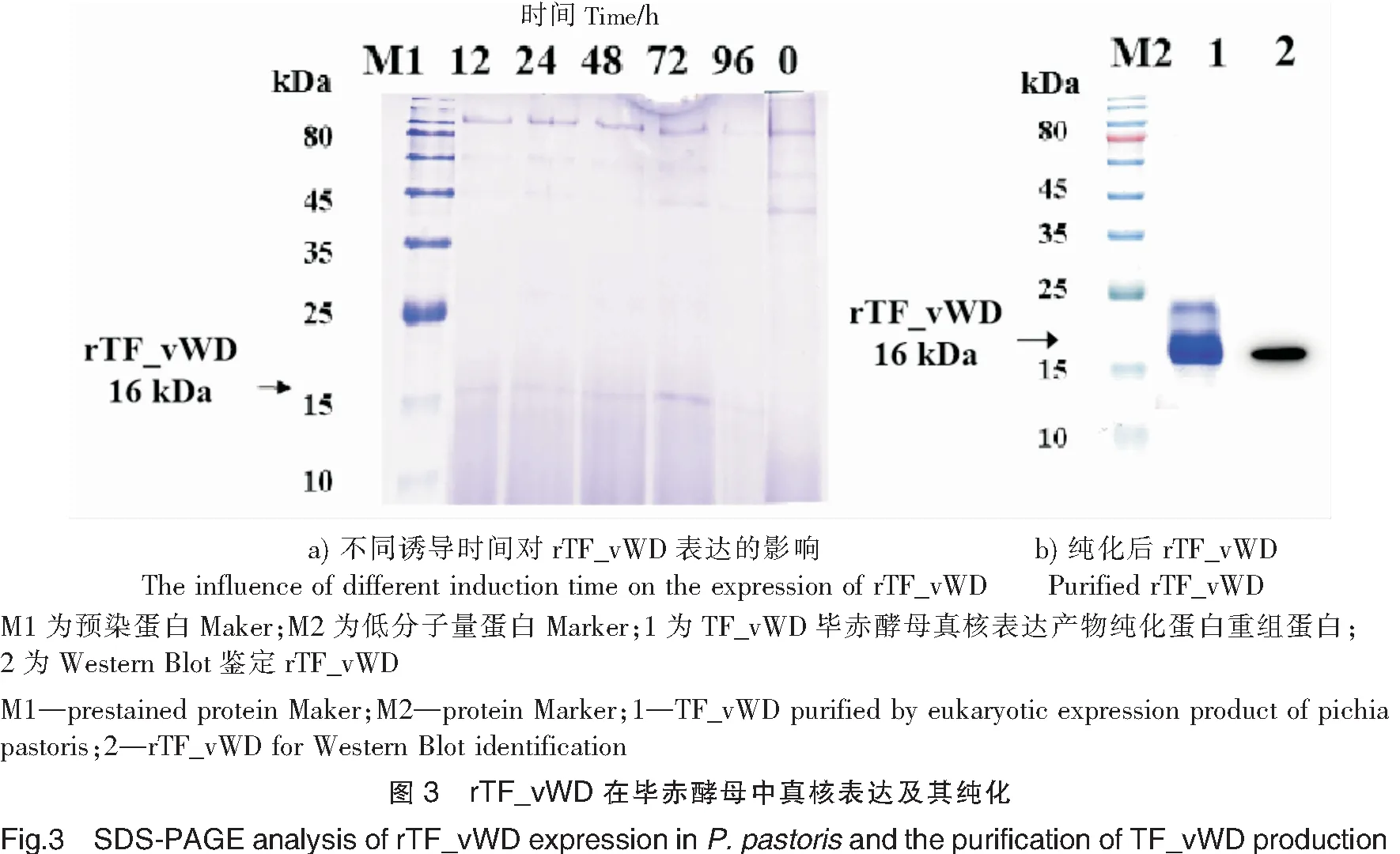
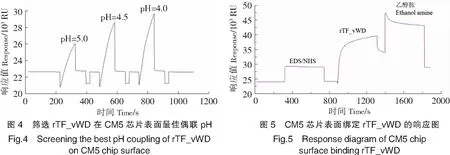
2.3 rTF_vWD蛋白与TTX的动力学分析
用pH值分别为5.0、4.5和4.0的醋酸钠缓冲液稀释rTF_vWD,进样完成后选取偶联量最大的pH值进行后续实验。实验结果表明,最佳偶联pH值为4.0(见图4),rTF_vWD在CM5芯片表面最终偶联量为4946 RU(见图5)。以0,31.25,62.5,125,250,500,1000,2000,4000 μmol/L的TTX粗品流过固定有rTF_vWD的芯片,测定并分析配体与受体的相互作用。结果显示,rTF_vWD与TTX结合的响应值(Rmax)为100 RU,通过稳态拟合(Affinity)计算出rTF_vWD与TTX的平衡解离常数KD为3.15 mmol/L(见图6)。结果表明rTF_vWD能够与TTX结合,且亲和力较弱。
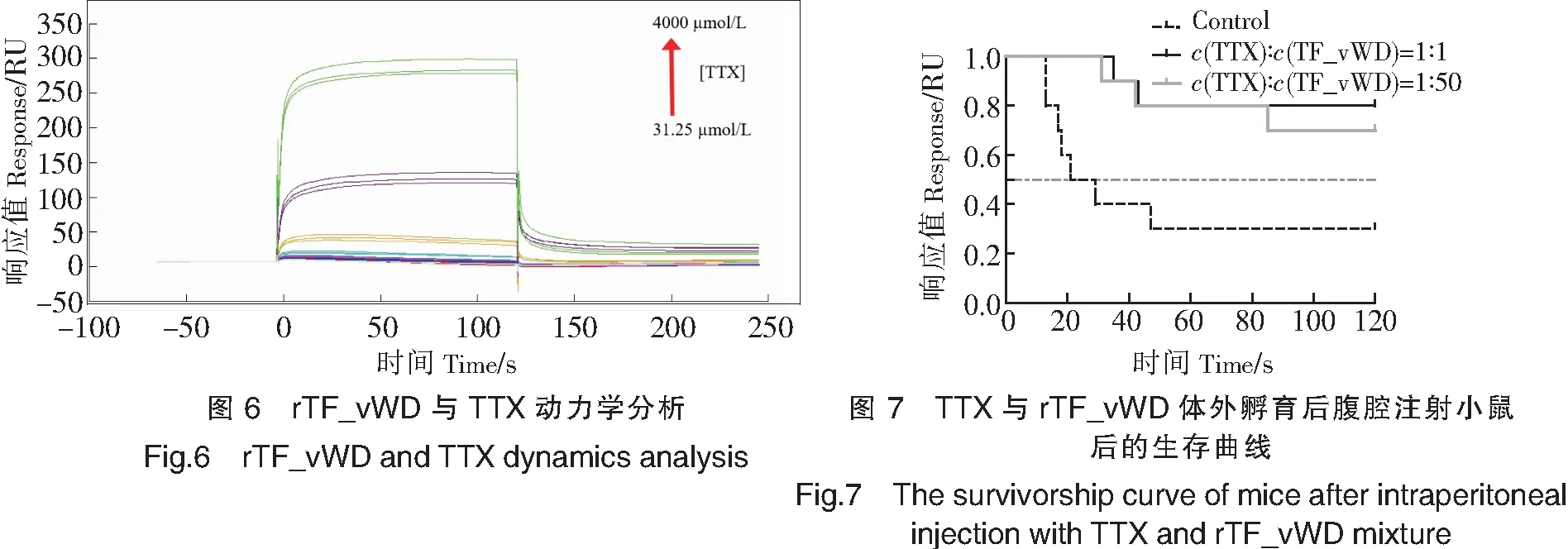
2.4 rTF_vWD蛋白对TTX的中和作用
对照组中,对小鼠按每千克体重腹腔注射7.5 μg TTX(或按0.15 μg/鼠的量注射TTX),2 h内10只小鼠死亡7只,致死速度较快,因此选择在10 min后进行肌肉注射rTF_vWD。实验组中,腹腔注射TTX与rTF_vWD孵育后的混合液,小鼠存活率显著上升(P<0.05)(见图7),这表明TTX与蛋白体外孵育后,TTX毒性显著降低了,即rTF_vWD对TTX的毒性有中和作用。
3 讨论
卵黄蛋白原是卵黄蛋白(vitellin,Vn)的前体,主要是在肝脏中合成的,通过体循环将其分布至全身,并携带到卵巢。卵黄蛋白原被储存在早期卵母细胞体内,然后裂解为卵黄脂磷蛋白(I和II)、卵黄高磷蛋白和vWD结构域[15]。除了作为卵黄蛋白前体的作用外,卵黄蛋白原还能作为金属、无机磷酸盐、脂类和碳水化合物的载体蛋白[16],其中vWD结构域具有与病毒或细菌互作的性质,对微生物进行识别并介导微生物的清除[17]。最近有研究发现从豹纹东方鲀卵巢中分离纯化的卵黄蛋白原肽段vWD可能参与TTX的结合[13]。为了验证卵黄蛋白原肽段vWD与TTX的结合能力,本研究利用毕赤酵母表达系统,经诱导表达条件的优化,在0.5%(体积分数)甲醇、pH=7.0的条件下,诱导表达72 h时,rTF_vWD蛋白表达量最高,通过Ni+亲和层析柱纯化得到rTF_vWD蛋白纯度为90%。
Biacore-表面等离子体共振(SPR)是一种高度敏感的技术,常用来验证包括蛋白质和核酸在内的生物系统的相互作用[18]。SPR的主要优势是它能够实时测量亲和力和动力学,并且是一种无标签,使用材料相对少的技术[19]。近年来,应用SPR分析不同蛋白质和小分子相互作用的研究进展表明,SPR在分析生物大分子和潜在候选药物的亲和力方面具有广泛的应用价值[20-22]。本文利用 Biacore T200生物分子相互作用分析系统,将rTF_vWD作为受体,以TTX作为配体进行相互作用的亲和力和动力学分析。结果表明rTF_vWD能够与TTX结合,平衡解离常数为3.15 mmol/L,且亲和力较弱。本研究提供了rTF_vWD可结合TTX的直接证据,为卵黄蛋白原肽段vWD可作为不同组织器官间TTX的传递[23-24]介质提供重要的证据。本研究还提供了rTF_vWD可中和TTX毒性的重要佐证:预先将TTX与rTF_vWD孵育后,再腹腔注射小鼠,则小鼠死亡率显著下降,结果表明rTF_vWD可中和TTX毒性作用。本研究为河鲀对TTX耐受和TTX在河鲀体内转移和富集等机理的研究提供重要资料。
